- 2021-11-10 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版化学九下第10单元检测
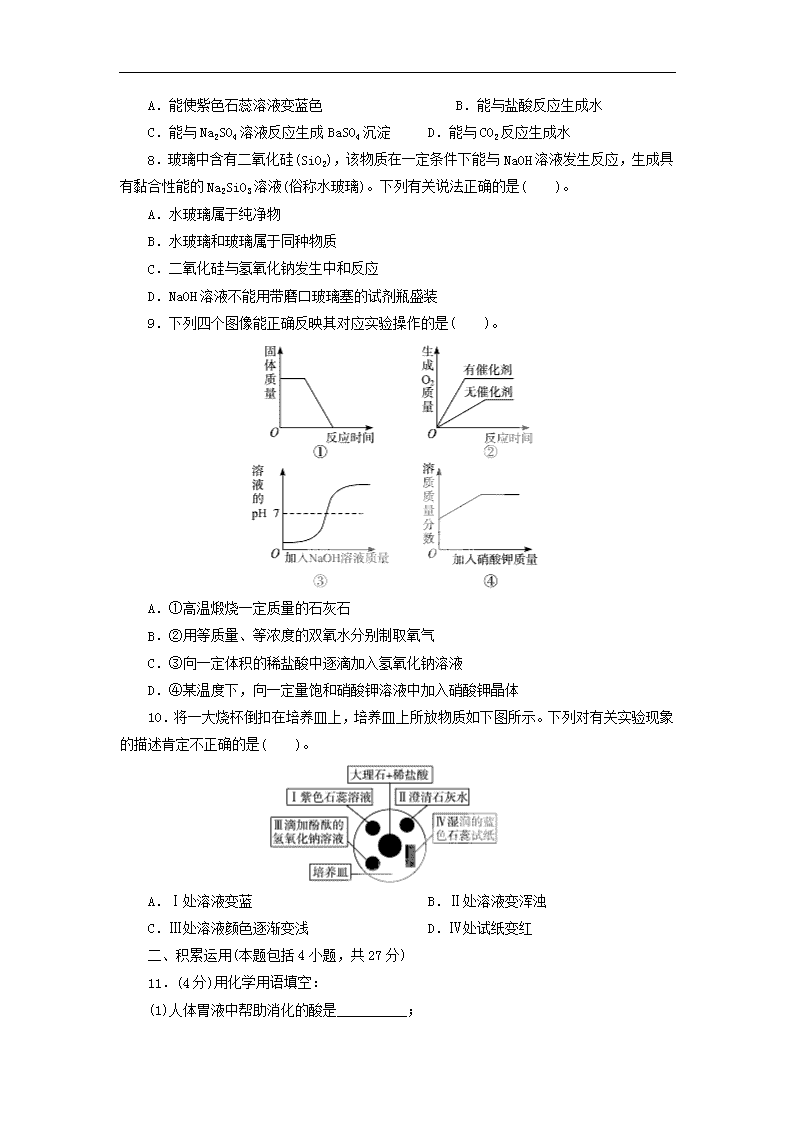
化学人教九年级下第十单元 酸和碱单元检测 (时间:45 分钟 满分:100 分) 一、快乐点击(每小题 3 分,共 30 分) 1.化学实验室中的药品按物质类别分类放置。下面是做“酸和碱的识别”实验时,实 验桌上部分药品的摆放情况。小林取用了硫酸以后,应该把它放回的位置是( )。 2.下列家庭小实验不能成功的是( )。 A.用紫卷心菜制酸碱指示剂 B.用闻气味的方法鉴别白酒和白醋 C.用食盐水浸泡菜刀除去表面的锈斑 D.用果汁、小苏打、柠檬酸、凉开水等自制汽水 3.常温下,一些物质的 pH 如下,其中显酸性的物质是( )。 A.柠檬汁 pH=2 B.鸡蛋清 pH=8 C.蒸馏水 pH=7 D.肥皂水 pH=10 4.下列对实验意外事故的处理错误的是( )。 A.硫酸洒在实验台上,立即用烧碱溶液冲洗 B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓 C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭 D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上 3%~5%的碳酸氢钠溶液 5.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( )。 A.除去氯化钠溶液中的碳酸钠 B.除去铜粉中混有的铁粉 C.除去熟石灰中的石灰石 D.除去铁丝上的铁锈 6.推理是一种重要的研究和学习方法。下列推理正确的是( )。 A.碱中都含有氢氧根,所以碱中一定含有氢元素 B.分子是构成物质的微粒,因此物质都是由分子构成的 C.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应 D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中燃烧 7.碱溶液中都含有 OH-,因此不同的碱表现出一些共同的性质。下列关于 Ba(OH)2 性质 的描述中不属于碱的共同性质的是( )。 A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水 C.能与 Na2SO4 溶液反应生成 BaSO4 沉淀 D.能与 CO2 反应生成水 8.玻璃中含有二氧化硅(SiO2),该物质在一定条件下能与 NaOH 溶液发生反应,生成具 有黏合性能的 Na2SiO3 溶液(俗称水玻璃)。下列有关说法正确的是( )。 A.水玻璃属于纯净物 B.水玻璃和玻璃属于同种物质 C.二氧化硅与氢氧化钠发生中和反应 D.NaOH 溶液不能用带磨口玻璃塞的试剂瓶盛装 9.下列四个图像能正确反映其对应实验操作的是( )。 A.①高温煅烧一定质量的石灰石 B.②用等质量、等浓度的双氧水分别制取氧气 C.③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液 D.④某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 10.将一大烧杯倒扣在培养皿上,培养皿上所放物质如下图所示。下列对有关实验现象 的描述肯定不正确...的是( )。 A.Ⅰ处溶液变蓝 B.Ⅱ处溶液变浑浊 C.Ⅲ处溶液颜色逐渐变浅 D.Ⅳ处试纸变红 二、积累运用(本题包括 4 小题,共 27 分) 11.(4 分)用化学用语填空: (1)人体胃液中帮助消化的酸是__________; (2)2 个碳酸根离子__________; (3)消石灰的主要成分__________; (4)硫酸中硫元素的化合价为+6__________。 12.(7 分)小霖将一枚生锈的铁螺丝放入足量的稀盐酸中,观察到______________,该 反应的化学方程式为________________;一段时间后,又观察到__________________,该反 应的化学方程式为____________________。小霖结合学过的化学知识,向管理人员提出了一 些防止机械设备进一步锈蚀的建议,请写出一条小霖的建议:__________________________。 13.(8 分)通过化学学习,我们认识了“酸”和“碱”,请回答下列问题: (1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在相同的________(填符号), 因此,它们有很多相似的化学性质,如:________________、____________________等(写 两条即可)。 (2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥____气体, 氢氧化钙可由生石灰与水反应制得,反应的化学方程式为________________________。 (3)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的 污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为____________________。 (4)2010 年 4 月 14 日青海玉树大地震灾害发生后,为了灾区人民群众的饮用水安全, 卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取 它的酸碱度,应如何操作:________________________________。 14.(8 分)如下图所示 A~G 是初中化学常见的物质。图中“→”表示转化关系,“—” 表示相互能反应。已知 A 是人体胃液中含有的酸,G 是最轻的气体,B、C、D、E、F 是氧化 物。请回答: (1)G 的化学式为______,E 与 F 反应的基本反应类型是______,写出物质 B 的一种用 途______________________; (2)C 与 D 反应的化学方程式可能是____________________。 三、情景分析(本题包括 2 小题,共 15 分) 15.(7 分)(1)小亮在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图 1),瓶内发生反应 的化学方程式是__________________。小亮思考:瓶能吞蛋,能不能吐蛋呢?他进行了如下 图 2 的实验,他加入试剂 P,结果鸡蛋吐了出来,试写出反应的化学方程式________________, 吐蛋的原因是____________________。 (2)近年来,世界各地地震灾害频发。震灾过后,饮用水的消毒杀菌成为抑制大规模传 染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。漂白粉的主要成分是次氯酸钙 [Ca(ClO)2]和氯化钙。工业上将氯气通入石灰乳[Ca(OH)2]来制取漂白粉,试写出该反应的化 学方程式________________________。 16.(8 分)家庭厨房实际上就是一个化学世界,“柴米油盐酱醋糖”等都是化学物质。 厨房内有一瓶无标签的液体,经步骤①:观察颜色与状态;步骤②:闻气味;步骤③:取该 液体适量与一枚生锈的铁钉作用,看到铁锈逐渐溶解;步骤④:另取少量该液体与纯碱反应, 发现有气泡产生。确认该液体为食醋。根据上述实验回答下列问题: (1) 在 上 述 ① 至 ④ 的 四 个 步 骤 中 , 其 中 根 据 物 质 的 物 理 性 质 来 判 断 的 有 ____________(填序号,下同),利用物质的化学性质来判断的有______________________。 (2)在步骤②中能闻到特殊气味,这是因为醋酸分子________________________的缘故。 (3)当食醋中的醋酸(CH3COOH)与纯碱反应时除有气泡生成外,还生成了醋酸钠(CH3COONa) 和水,请写出该反应的化学方程式:______________________________。 四、实验探究(本题包括 2 小题,18 分) 17.(8 分)实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关 探究。请根据要求回答问题: (1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有 ____________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如上装置 (脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象 是________________,发生反应的化学方程式为________________。 (2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕 色气体产生。据此现象可推知浓硝酸________________(填一条化学性质)。 (3)通过上述两个实验可知,实验室应如何保存浓硝酸? ________________________________________________________________________。 18.(10 分)通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否 变质以及变质的程度”展开了探究活动,请你一同参与: (1)提出问题:氢氧化钙是否变质? (2)猜想与假设:同学们经过讨论认为样品存在三种可能情况:没有变质;部分变质; 完全变质。 (3)实验探究: 实验步骤及操作 实验现象 实验结论 取样品于试管中,加入足量蒸馏 水振荡,静置。 ①取上层清液,滴入无色酚酞溶 液 ②倒去上层清液,再向试管中注 入稀盐酸 ①无色酚酞溶液变红 ②____________ 部分变质 ①无色酚酞溶液不变红 ②____________ ____________ ①____________ ②没有气泡产生 ____________ (4)小结与思考: ①小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,请写出实验中反应的 化学方程式:__________________、__________________。 ②氢氧化钙俗称熟石灰,农业上常用来______________。 五、计算应用(本题包括 1 小题,10 分) 19.某地一辆满载浓硫酸的罐车翻倒,导致 25 t 溶质的质量分数为 98%的浓硫酸泄漏, 并向路基两边蔓延,接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫 酸解除了险情。请回答: (1)25 t 溶质的质量分数为 98%的浓硫酸中含 H2SO4 的质量为______ t。 (2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙? (3)处理一定量的浓硫酸,理论上既可用 m1 吨氢氧化钙粉末,也可选用 m2 吨氧化钙粉末, 还可用 m3 吨碳酸钙粉末,则 m1、m2、m3 的数值大小关系为________。 参考答案 1. 答案:B 2. 答案:C 3. 答案:A 4. 答案:A 5. 解析:除杂的目的是除去杂质、保留主要成分,又不混入新的杂质,而 C 中熟石灰 [Ca(OH)2]和石灰石(CaCO3)都能与稀盐酸反应,达不到除杂的目的。 答案:C 6. 答案:A 7. 解析:碱的通性是能使紫色石蕊溶液变蓝色,能与酸反应生成盐和水,能与 CO2 反 应。而 C 项中钡离子与硫酸根离子结合生成 BaSO4 沉淀,氢氧化钡是唯一能与 Na2SO4 溶液反 应生成 BaSO4 沉淀的碱。故 C 正确。 答案:C 8. 解析:水玻璃是 Na2SiO3 溶液,属于混合物;水玻璃和玻璃的成分不同,属于不同种 物质;二氧化硅是氧化物,与氢氧化钠发生的反应不是中和反应;氢氧化钠溶液能与玻璃中 的二氧化硅反应,若用磨口玻璃塞,时间长了会黏合在一起而无法打开,应选用橡皮塞。 答案:D 9. 解析:本题考查对图像的分析和判断能力,解题时要注意图像中一些特殊的点、段 的意义。高温煅烧石灰石生成氧化钙和二氧化碳,其中氧化钙为固体,故固体质量不可能变 为 0,A 错误;催化剂只能改变反应速率,而不能改变最终产物的质量,B 错误;在稀盐酸 中逐滴滴加氢氧化钠溶液,溶液的 pH 逐渐升高,最终会超过 7,C 正确;饱和的硝酸钾溶液 不能再溶解硝酸钾,因此溶质的质量分数不会随着硝酸钾的加入而增大,D 错误。 答案:C 10. 解析:大理石与稀盐酸反应产生二氧化碳,二氧化碳与水反应生成碳酸,能使紫色 石蕊溶液和蓝色石蕊试纸变红色,A 错误,D 正确;二氧化碳能使澄清石灰水变浑浊,B 正 确;二氧化碳与氢氧化钠溶液反应生成碳酸钠,碱性减弱,酚酞溶液颜色变浅,C 正确。 答案:A 11. 答案:(1)HCl (2) 2 32CO (3)Ca(OH)2 (4) 6 2SH O4 12. 答案:锈迹消失,溶液变为黄色 Fe2O3+6HCl===2FeCl3+3H2O 有气泡产生 Fe +2HCl===FeCl2+H2↑ 保持机械设备干燥、刷漆、涂油等 13. 解析:酸在水溶液中都能电离出 H+,所以酸具有相似的化学性质(通性),如都能 使酸碱指示剂变色、与活泼金属或金属氧化物反应等;氢氧化钠能吸收水蒸气而潮解,故可 作干燥剂,如干燥氧气、氢气等气体,但应注意,能与氢氧化钠反应的气体不能用氢氧化钠 干燥,如二氧化碳、氯化氢等气体。 答案:(1)H+ 能使紫色石蕊溶液变红 使无色酚酞溶液不变色 能与较活泼金属发生 反应等(任写两条) (2)H2(或 O2) CaO+H2O===Ca(OH)2 (3)H2SO4+Ca(OH)2===CaSO4+2H2O (4)取待测水样,滴到 pH 试纸上,把 pH 试纸显示的颜色与标准比色卡比较,读出 pH 14. 解析:A 是人体胃液中含有的酸,可知 A 是盐酸,G 是最轻的气体,应是 H2,H2 与 氧化物 F 能相互转化,F 是 H2O;B 是氧化物,并且能由盐酸制取,B 应是 CO2,则 C 是 CO;E、 D 两种氧化物都能与盐酸反应,则都是金属氧化物。部分金属氧化物与水能发生化合反应, CO2 可用于灭火或用作气体肥料等;C 与 D 的反应是 CO 与金属氧化物的反应。 答案:(1)H2 化合反应 灭火(或气体肥料、化工产品的原料等) (2)3CO+Fe2O3 2Fe+3CO2(其他合理答案也可) 15. 解析:“瓶吞鸡蛋”是由于瓶内的二氧化碳气体被氢氧化钠溶液吸收,压强减小, 大气压将鸡蛋压入瓶内;要想让瓶内的鸡蛋“吐”出来,可使瓶内压强增大,利用气压将鸡 蛋压出,酸可与碳酸钠溶液反应生成二氧化碳气体,故 P 试剂可能为盐酸(或硫酸)。 答案:(1) 2NaOH+CO2===Na2CO3+H2O Na2CO3+2HCl===2NaCl+H2O+CO2↑ 反应后生成 二氧化碳气体,瓶内压强增大(其他合理答案也可) (2)2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O 16. 解析:(1)颜色、状态、气味等属于物质的物理性质;能与生锈铁钉和纯碱反应属 于该物质的化学性质。(2)能闻到醋酸的气味是醋酸分子不断运动的结果。(3)可仿照碳酸钠 与盐酸的反应来书写化学方程式。 答案:(1)①和② ③和④ (2)在不断运动 (3)Na2CO3+2CH3COOH===2CH3COONa+H2O+CO2↑ 17. 答案:(1)挥发性 脱脂棉的颜色由红色褪为无色 HNO3+NaOH===NaNO3+H2O (2)见光或受热易分解 (3)密封、避光、阴凉处保存 18. 解析:由实验结论部分变质可知,部分氢氧化钙肯定变化为碳酸钙,而碳酸钙能与 盐酸反应生成二氧化碳气体;由无色酚酞溶液不变红可知,溶液已经不显碱性,表明氢氧化 钙已全部变质,加入盐酸肯定生成二氧化碳气体;由加入盐酸没有气泡产生可知,样品中没 有碳酸钙,即没有变质,氢氧化钙仍能使无色酚酞溶液变红。 1 9. 解析:(1)25 t 溶质的质量分数为 98%的浓硫酸中含 H2SO4 的质量为:25 t×98%=24.5 t; (2)可利用氢氧化钙与硫酸反应的化学方程式,根据硫酸的质量来求氢氧化钙的质量。 (3)根据三种物质与硫酸反应的化学方程式: H2SO4+Ca(OH)2===CaSO4+2H2O 98 74 H2SO4+CaO===CaSO4+H2O 98 56 H2SO4+CaCO3===CaSO4+H2O+CO2↑ 98 100 比较三个化学方程式可知中和相同质量的硫酸,需要碳酸钙的质量最多,其次是氢氧化 钙,需要氧化钙的质量最少。 答案:(1)24.5 (2)解:设理论上需要氢氧化钙的质量为 x。 H2SO4+Ca(OH)2===CaSO4+2H2O 98 74 24.5 t x 98 74 = 24.5t x x=18.5 t (3)m3>m1>m2查看更多