- 2021-11-06 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
课题化学式与化合价
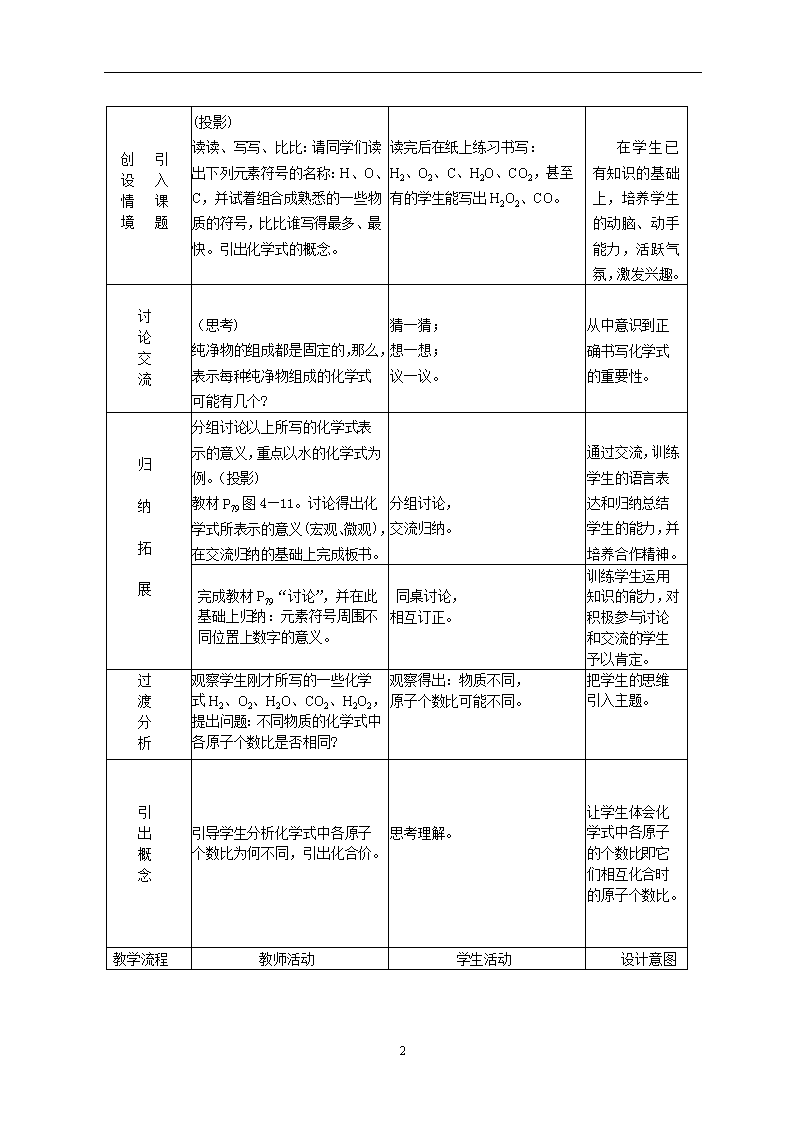
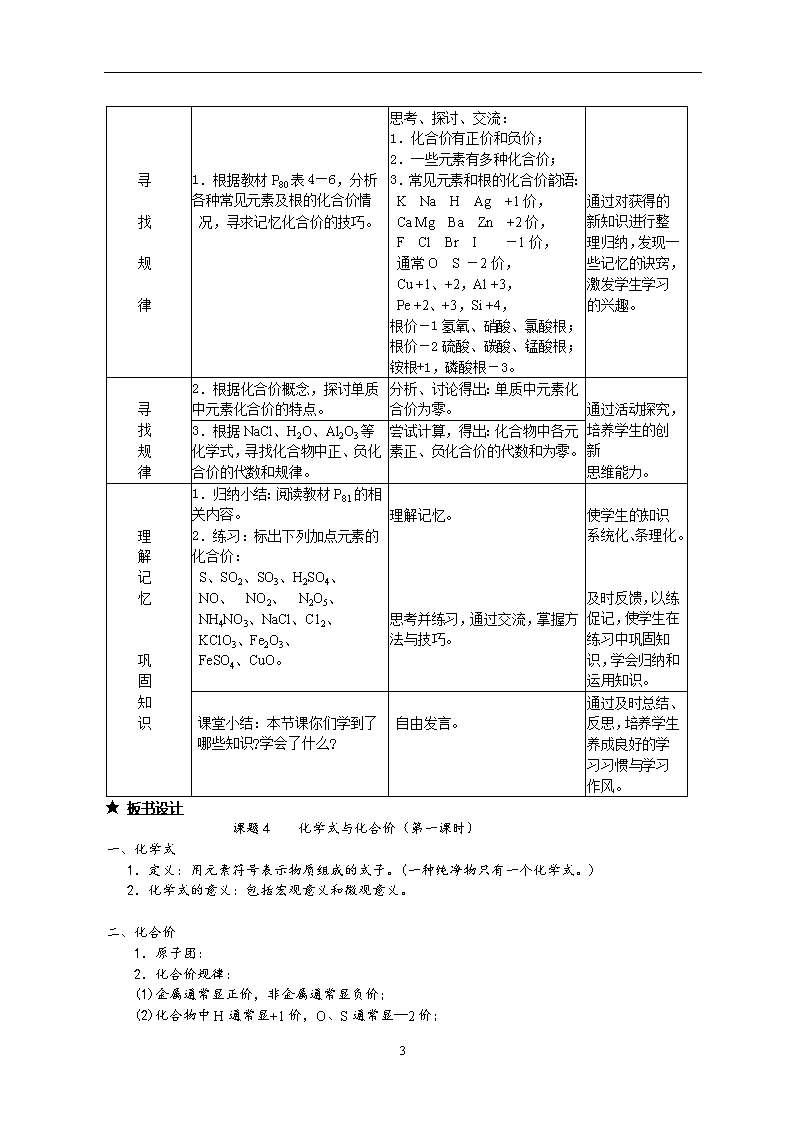
课题4 化学式与化合价 ★ 教学目标 1.知识与技能: (1)、了解化学式及其意义; (2)、了解常见元素及原子团的化合价; (3)、能用化学式表示某些物质的组成,并能利用化合价推求化学式; (4)、了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成; (5)、能看懂某些商品标签或说明书上标示的物质成分和含量。 2.过程与方法: (1)、通过对图、表的观察,让学生学会对学过的知识进行整理归纳并初步运用; (2)、通过讨论交流、活动探究,培养学生利用所学的知识解决实际问题的能力和基本计算能力; 3.情感、态度与价值观: (1)、通过自编化合价口诀,激发学生的学习兴趣和求知欲; (2)、通过讨论交流、活动探究,发展学生善于合作、勤于思考、勇于实践的精神。 ★ 教学资源分析 本课题安排在第四单元的最后一部分,包括“什么是化学式”、“化合价”和“有关相对分子质量的计算”这三部分内容,它们是学习化学的重要工具,是“双基”的重要部分。虽然有元素符号知识作为基础,但仍是初三化学学习中的知识分化点。 本课题的内容比较抽象,教材首先讲述了化学式的概念,以学生最熟悉的纯净物——水为例,介绍了化学式表示的意义;接着介绍化合价知识,并以推求五氧化二磷的化学式为例讲解推求的步骤和方法,在此基础上,介绍化学式的读法;最后是有关相对分子质量的计算。课程标准对这些内容要求不高,故教学中不需要任意扩展与加深。 ★ 教学策略分析 在前面的学习中,学生已具有了有关元素符号的知识,用元素符号来表示某种元素,学生兴致很高;那么,对于物质能否用专门的符号来表示呢?学生对此的求知欲望很强。但最基本的元素、原子团化合价的记忆却又是那么枯燥乏味,因此,教师要充分发挥学生的主观能动性,以试编口诀、讨论交流、活动探究等多种形式活跃课堂气氛,提高教学的效率。 ★ 教学重、难点 重点:化合价知识及其应用、有关相对分子质量的计算。 难点:1.化合价的理解及应用。 2.物质中某元素质量分数的计算。 ★ 教学准备 1. 有关投影片; 2. 将教材P,9图4—11、P。。表4—6放大后复印。 ★ 课时建议3课时 ★ 教学过程 (第一课时) 教学流程 教师活动 学生活动 设计意图 6 创 引 设 入 情 课 境 题 (投影) 读读、写写、比比:请同学们读出下列元素符号的名称:H、O、C,并试着组合成熟悉的一些物质的符号,比比谁写得最多、最快。引出化学式的概念。 读完后在纸上练习书写: H2、O2、C、H2O、CO2,甚至有的学生能写出H2O2、CO。 在学生已有知识的基础上,培养学生的动脑、动手能力,活跃气氛,激发兴趣。 讨 论 交 流 (思考) 纯净物的组成都是固定的,那么,表示每种纯净物组成的化学式可能有几个? 猜一猜; 想一想; 议一议。 从中意识到正确书写化学式的重要性。 归 纳 拓 展 分组讨论以上所写的化学式表示的意义,重点以水的化学式为例。(投影) 教材P79图4—11。讨论得出化学式所表示的意义(宏观、微观),在交流归纳的基础上完成板书。 分组讨论, 交流归纳。 通过交流,训练学生的语言表达和归纳总结学生的能力,并培养合作精神。 完成教材P79“讨论”,并在此基础上归纳:元素符号周围不同位置上数字的意义。 同桌讨论, 相互订正。 训练学生运用知识的能力,对积极参与讨论和交流的学生予以肯定。 过 渡 分 析 观察学生刚才所写的一些化学式H2、O2、H2O、CO2、H2O2,提出问题:不同物质的化学式中各原子个数比是否相同? 观察得出:物质不同, 原子个数比可能不同。 把学生的思维引入主题。 引 出 概 念 引导学生分析化学式中各原子个数比为何不同,引出化合价。 思考理解。 让学生体会化学式中各原子的个数比即它们相互化合时的原子个数比。 教学流程 教师活动 学生活动 设计意图 6 寻 找 规 律 1.根据教材P80表4—6,分析各种常见元素及根的化合价情 况,寻求记忆化合价的技巧。 思考、探讨、交流: 1.化合价有正价和负价; 2.一些元素有多种化合价; 3.常见元素和根的化合价韵语: K Na H Ag +1价, Ca Mg Ba Zn +2价, F Cl Br I -1价, 通常O S -2价, Cu +1、+2,Al +3, Pe +2、+3,Si +4, 根价-1氢氧、硝酸、氯酸根; 根价-2硫酸、碳酸、锰酸根; 铵根+1,磷酸根-3。 通过对获得的新知识进行整理归纳,发现一些记忆的诀窍,激发学生学习的兴趣。 寻 找 规 律 2.根据化合价概念,探讨单质中元素化合价的特点。 分析、讨论得出:单质中元素化合价为零。 通过活动探究, 培养学生的创新 思维能力。 3.根据NaCl、H2O、Al2O3等化学式,寻找化合物中正、负化合价的代数和规律。 尝试计算,得出:化合物中各元素正、负化合价的代数和为零。 理 解 记 忆 巩 固 知 识 1.归纳小结:阅读教材P81的相关内容。 2.练习:标出下列加点元素的化合价: S、SO2、SO3、H2SO4、 NO、 NO2、 N2O5、 NH4NO3、NaCl、C12、 KClO3、Fe2O3、 FeSO4、CuO。 理解记忆。 思考并练习,通过交流,掌握方法与技巧。 使学生的知识系统化、条理化。 及时反馈,以练促记,使学生在练习中巩固知 识,学会归纳和运用知识。 课堂小结:本节课你们学到了哪些知识?学会了什么? 自由发言。 通过及时总结、反思,培养学生养成良好的学习习惯与学习作风。 ★ 板书设计 课题4 化学式与化合价(第一课时) 一、 化学式 1.定义:用元素符号表示物质组成的式子。(一种纯净物只有一个化学式。) 2.化学式的意义:包括宏观意义和微观意义。 二、化合价 1.原子团: 2.化合价规律: (1)金属通常显正价,非金属通常显负价; (2)化合物中H通常显+1价,O、S通常显—2价; 6 (3)单质的化合价为零; (4)化合物中各元素的化合价代数和为零。 3.记忆规律: ★ 教后小记 ___________________________________________ ________ ___________________________________________ ________ ___________________________________________ ____ 第二课时) 教学流程 教师活动 学生活动 设计意图 复 习 引 入 (热身操) 以小组为单位进行化合价记忆比赛,看谁记得最准、最多。 (提问)化学式CO2的涵义? 抢答。 巩固旧知识,为 学习新知识作铺垫。 过 渡 设 问 如果我们知道了组成化合物的元素的化合价,能否准确写出该化合物的化学式呢? 思考。 让学生结合预习情况思考,理出初步的思路。 例 题 解 析 [例1]:已知磷为+5价,氧为 -2价,写出磷的这种化合物的化学式。 归纳解题的步骤: 1.写出元素符号;2.求最小公倍数;3.算原子个数;4.检查是否正确。 [例2]:已知铁为+3价,硫酸根为-2价,写出硫酸铁的化学式。 寻求解题思路和方法。 使学生懂得化合价的运用。 巩 固 训 练 练习1:已知钠为+1价,氯为 -1价,写出氯化钠的化学式。 练习2:石灰水是氢氧化钙溶于水得到的,已知,其中氢氧根为-1价,钙为+2价,写出氢氧化钙的化学式。 解答练习,及时交流、小结。 规范解题步骤。 通过练习、交流,让学生掌握解题方法、技巧,达到学以致用的效果。 活 动 探 究 1. 写出给定物质的化学式: 溴化钠、氧化钙、氧化铝、 二氧化氮; 2.读出以下化学式的名称:MnO2、CuO、 SO3、KI、MgCl2。 3.教材P82“讨论”。 以邻座同学为一小组,对相关题目进行练习,并相互订正。 培养合作学习的意识,发扬互帮互助的精神,达到共同提高的目的。 6 归 纳 小 结 通过本节课的学习,你们觉得正确书写化学式的关键是什么?你 们有什么诀窍? 总结收获;交流体会。 让学生在交流中互相启发,相互激励,发展和完善自我。 当 堂 反 馈 教材P85:3、4、5、6。 先独立解题;后交流讨论。 再次体会化合价的运用,规范书写方式。 ★ 板书设计 课题4 化学式与化合价(第二课时) 4.根据化合价写化学式(最小公倍数法): 5.根据化学式判断元素或原子团的化合价(“化合价代数和为零”原则): ★ 教后小记 ___________________________________________ ________ ___________________________________________ ________ ___________________________________________ ________ (第三课时) 教学流程 教师活动 学生活动 设计意图 复 习 设 疑 引 入 新 课 (复习提问) 1.什么是相对原子质量? 2.下列粒子各表示什么意义? (1)2H (2)H2O (3)2CO2 (过渡) 原子的质量很小,故我们采用相对原子质量表示,那么由原子构成的分子,质量仍然很小,又如何表示呢? 引出相对分子质量的概念。 思考并口答; 思考后大胆猜想; 圈出概念中的关键字、词。 在复习旧知后自然引出新的问题,学生一下子就进入积极的学习状态。 6 例 题 解 析 互 动 教 学 [例1]:根据化学式计算相对分子质量:(1)O2 (2)H2O (3)Cu(OH)2解: Cu(OH) 2的相对分子质量= [例2]:计算组成化合物的各元素的质量比: (1)水中氢、氧元素的质量比; (2)NH4NO3中各元素质量比; (3)CO(NH2) 2中各元素质量比; [例3]:计算化合物中某元素的质量分数。 (1)求水中氢元素的质量分数; (2)分别计算化肥硝酸铵 (NH4NO3)、尿素CO(NH2) 2中氮元素的质量分数。 (练习) 解:(1)O2的相对分子质量 =16×2 = 32 (2)H2O的相对分子质量 =2×1+16 = 18 思考、探究、分析、练习、交流。 (练习) 解:NH4NO3中 N∶H∶O == 28∶4∶48 == 7 ∶1∶ 12 师生共同探究解题方法与技巧。 巩 固 练 习 拓 展 提 高 1.指导、总结解题的注意点; 2.练习: (1)求H2SO4的相对分子质量; (2)计算H2SO4中各元素的质量比; (3)计算H2SO4中氢元素质量分数; (4)98g H2SO4中含氧元素多少克? (5)多少克水中含氧元素的质量与49 g硫酸中所含氧元素 的质量相等? 3.到实验室“走一走,看一看”,了解药品的成分。 4.(作业)P94~P951、7、8、9、10。 总结出解题的格式、步骤和方法。 当堂练习; 相互纠正。 使知识条理化。 发现学生解题过程中的问题,及时更正,使解题更规范,运用知识更熟练。 ★ 板书设计 课题4 化学式与化合价(第三课时) 三、有关相对分子质量的计算 1.计算相对分子质量: 2.求化学式中各元素的质量比: 3.求化学式中某元素的质量分数: ★ 教后小记 ___________________________________________ ________ ___________________________________________ ________ ___________________________________________ 6查看更多