- 2021-11-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020九年级化学下册 第十单元 酸和碱 课题210
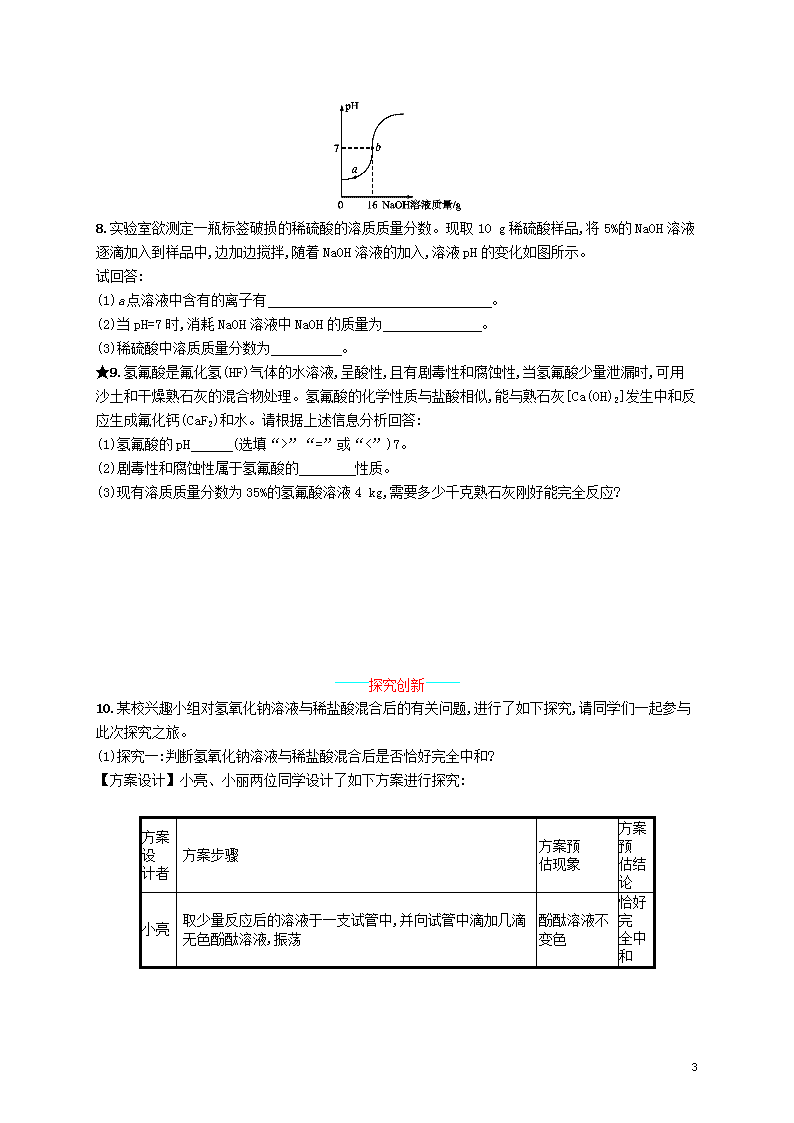
第2课时 溶液酸碱度的表示方法——pH 知能演练提升 能力提升 1.如图所示,鱼、肉的新鲜度不同,其浸出液的pH会不同。鱼、肉的浸出液pH变大,其新鲜度的变化情况为( ) A.越来越新鲜 B.趋向腐败变质 C.没有发生变化 D.无法判断 2.向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如右图所示,试剂X是下列物质中的( ) A.Mg B.H2O C.NaOH溶液 D.CaCO3 3.下列是几种液体的pH,其中酸性最强的是( ) A.食醋—3.0 B.酸雨—5.4 C.酸奶—4.5 D.果汁—6.0 4.下列做法正确的是( ) A.某同学用玻璃棒蘸取食用白醋滴在pH试纸上,测定其pH B.服用适量的氢氧化钠溶液可治疗胃酸过多 6 C.生活污水不经任何处理直接排放到河流中 D.为使农作物高产,鼓励农民大量施用化肥和农药 5.(2017浙江宁波中考)有A、B两种酸碱指示剂,它们显示的颜色与溶液pH的关系如图,它们在甲溶液和乙溶液中显示的颜色如表。下列判断错误的是( ) 溶液 指示剂 甲 乙 A 黄色 蓝色 B 无色 粉红色 A.甲溶液呈酸性 B.乙溶液的pH可能为11 C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体 D.在滴有A指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色 6.紫甘蓝汁性质稳定,其颜色随pH改变而发生如下变化: pH <6.5 7.0~7.1 7.5~8.5 8.5~12.0 >12.5 颜色 粉红色 紫色 蓝色 绿色 黄色 下列分析错误的是( ) A.紫甘蓝汁可用做酸碱指示剂 B.将紫甘蓝汁加入到不同碱度的溶液中,可能显示出不同的颜色 C.与石蕊溶液相比,紫甘蓝汁可粗略测定溶液的酸碱度大小 D.向滴有紫甘蓝汁的氢氧化钠溶液中加入盐酸,若溶液变色则说明一定恰好完全反应 7.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如右图所示。 熟石灰与盐酸反应的化学方程式为 ; 当加入熟石灰m g时,溶液中的溶质为 。若改用n g氢氧化钠与相同量的盐酸反应,所得溶液的pH (填“>”“<”或“=”)7。 6 8.实验室欲测定一瓶标签破损的稀硫酸的溶质质量分数。现取10 g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。 试回答: (1)a点溶液中含有的离子有 。 (2)当pH=7时,消耗NaOH溶液中NaOH的质量为 。 (3)稀硫酸中溶质质量分数为 。 ★9.氢氟酸是氟化氢(HF)气体的水溶液,呈酸性,且有剧毒性和腐蚀性,当氢氟酸少量泄漏时,可用沙土和干燥熟石灰的混合物处理。氢氟酸的化学性质与盐酸相似,能与熟石灰[Ca(OH)2]发生中和反应生成氟化钙(CaF2)和水。请根据上述信息分析回答: (1)氢氟酸的pH (选填“>”“=”或“<”)7。 (2)剧毒性和腐蚀性属于氢氟酸的 性质。 (3)现有溶质质量分数为35%的氢氟酸溶液4 kg,需要多少千克熟石灰刚好能完全反应? 探究创新 10.某校兴趣小组对氢氧化钠溶液与稀盐酸混合后的有关问题,进行了如下探究,请同学们一起参与此次探究之旅。 (1)探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和? 【方案设计】小亮、小丽两位同学设计了如下方案进行探究: 方案设 计者 方案步骤 方案预 估现象 方案预 估结论 小亮 取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡 酚酞溶液不变色 恰好完 全中和 6 续表 方案设 计者 方案步骤 方案预 估现象 方案预 估结论 小丽 用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸呈现的颜色与标准比色卡对照 pH=7 恰好完 全中和 【方案评价】请判断以上设计的两个方案中, 同学的方案是正确的。 【方案反思】请分析另外一个方案错误的原因: 。 (2)探究二:氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么? 【作出猜想】小亮猜想:溶质有NaCl、HCl、NaOH 小丽猜想:溶质只有NaCl 小林猜想:溶质有NaCl、HCl 你的猜想:溶质有 (填化学式)。 小丽认为小亮的猜想是错误的,她的理由是 。 【实验设计及验证】请你将下列实验报告填写完整: 实验操作 实验现象 实验结论 取反应后的溶液于试 管中,加入碳酸钠溶液 小林的猜 想正确 有蓝色沉 淀生成 你的猜 想正确 答案:1.B 由图示可以看出,新鲜肉次鲜肉变质肉,pH逐渐增大,新鲜肉趋向变质,故选B。 2.C 盐酸与Mg、CaCO3分别反应生成的MgCl2、CaCl2溶液是中性的,溶液的pH不会大于7,故A、D项错;稀盐酸加入水后,酸性减弱,pH增大至接近中性,也不会大于7,故B项错;稀盐酸中加入NaOH后,中和酸性,至恰好完全反应时,pH=7,继续加NaOH,pH>7,故C项对。 3.A 6 4.A 氢氧化钠具有强烈的腐蚀性不能用来治疗胃酸过多;生活污水如果不经处理直接排放到河流中会造成水污染;大量施用农药和化肥会造成土壤污染和水污染,应适量施用。所以选A。 5.D 由题中关系图可知,A指示剂在酸性溶液中显黄色,所以甲溶液呈酸性,A项正确;A指示剂在pH大于7.6时显蓝色,B指示剂在pH大于10时显粉红色,所以乙溶液的pH可能为11,B项正确;A指示剂在甲溶液中显黄色、在乙溶液中显蓝色,蒸馏水呈中性,A指示剂在蒸馏水中显绿色,C项正确;在滴有A指示剂的甲溶液中不断加入乙溶液,恰好完全反应时溶液显绿色,乙溶液过量时溶液显蓝色,D项错误。 6.D 紫甘蓝汁在不同酸碱度的溶液中呈现不同的颜色,可用做酸碱指示剂,A、B项正确;石蕊只能测定溶液的酸碱性,而紫甘蓝汁能粗略测定溶液的酸碱度,C项正确;紫甘蓝汁在不同碱度的溶液中颜色不同,仅根据“溶液变色”无法判断氢氧化钠溶液与盐酸是否恰好完全反应。 7.解析 Ca(OH)2与HCl发生中和反应的化学方程式为Ca(OH)2+2HClCaCl2+2H2O;当熟石灰加入量为m g时,溶液显酸性,此时溶液中溶质为反应生成的CaCl2和未参加反应的HCl;由反应的化学方程式Ca(OH)2+2HClCaCl2+2H2O和NaOH+HClNaCl+H2O,可知中和相同质量的盐酸需要NaOH的质量多,即题中n g NaOH不能完全中和一定量的盐酸,溶液中盐酸剩余,故溶液的pH<7。 答案 Ca(OH)2+2HClCaCl2+2H2O CaCl2和HCl < 8.解析 (1)a点溶液的pH小于7,说明溶液中酸剩余,溶液中含有硫酸和硫酸钠两种物质,故含有的离子是Na+、H+、S。(2)属于溶液的简单计算。解题关键是明确pH=7时,硫酸与氢氧化钠恰好完全反应,消耗氢氧化钠溶液质量为16 g,氢氧化钠的质量=16 g×5%=0.8 g。(3)属于化学方程式和溶液的综合计算,较为简单。先根据化学方程式,利用0.8 g氢氧化钠求出恰好完全反应时消耗硫酸的质量,再根据溶质质量分数公式求出稀硫酸的溶质质量分数。 解:设10 g稀硫酸样品中含H2SO4的质量为x。 H2SO4+2NaOHNa2SO4+2H2O 98 80 x 0.8 g x=0.98 g 稀硫酸的溶质质量分数:×100%=9.8% 答:稀硫酸的溶质质量分数为9.8%。 答案 (1)Na+、H+、S (2)0.8 g (3)9.8% 9.答案 (1)< (2)化学 6 (3)解:设需要熟石灰的质量为x。 2HF + Ca(OH)2CaF2+2H2O 40 74 4 kg×35% x x=2.59 kg 答:需要熟石灰2.59 kg。 10.解析 (1)两种方案中,溶液使酚酞溶液不变色,可能呈酸性或中性,所以小亮的结论错误;小丽用pH试纸检测,pH=7说明溶液显中性,恰好完全反应,所以小丽的方案正确。 答案 (1)小丽 小亮方案错误的原因:反应后的溶液如果呈酸性,酚酞溶液也不变色,因此不能判断盐酸是否已被恰好中和 (2)NaCl、NaOH HCl和NaOH要发生反应 有气泡产生 取反应后的溶液于试管中,加入CuSO4溶液 6查看更多