- 2021-11-06 发布 |
- 37.5 KB |
- 63页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏专版2020中考化学复习方案第一篇基础过关第05课时空气与氧气课件
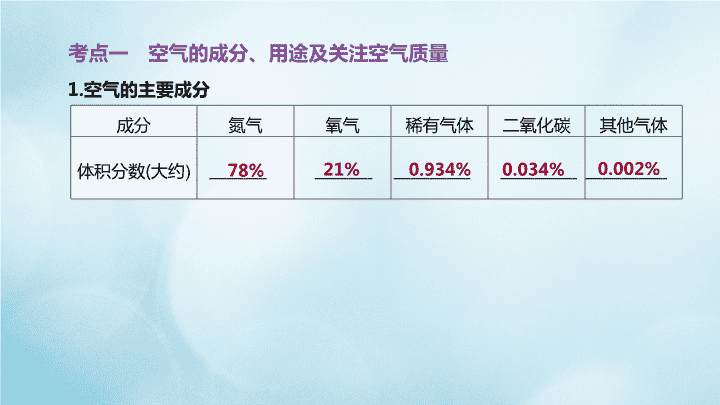
第 5 课时 空气与氧气 第一篇 基础过关 考点一 空气的成分、用途及关注空气质量 1. 空气的主要成分 成分 氮气 氧气 稀有气体 二氧化碳 其他气体 体积分数 ( 大约 ) 78% 21% 0.934% 0.034% 0.002% 气体 用途 氧气 主要用途 : 供给呼吸 , 可用于 等 ; 燃料燃烧离不开氧气 , 用于 和金属焊接等 氮气 制造 硝酸和化肥 的重要原料 ; 利用 其化学性质 , 可用作保护气 , 如灯泡里充氮气以 , 食品 包装中充氮气 以 ; 医疗 上可用液氮冷冻麻醉等 稀有气体 ( 包括氦、氖、氩 、氪 、氙、氡 ) 稀有气体化学性质 , 在通电时能发出不同颜色的光 , 可制成多种用途的 电光源 , 如航标灯、强照明灯、闪光灯、 霓虹灯 等 ; 氦可用于制造低温环境 2. 空气是一种重要的资源 医疗急救 钢铁冶炼 稳定 延长使用寿命 延长食品的保质期 非常不活泼 [ 注意 ] ① 空气中各成分所占比值指的是气体的体积分数。 ② 一般来说 , 空气的成分比较固定。 3. 关注空气质量 目前计入空气污染指数的是 和 , 主要包括 : 、 、 、臭氧、可吸入颗粒物、总悬浮颗粒物等。污染指数在 0~500, 是一个相对数值 , 数值越 , 表示污染物的含量越 , 空气质量越好。 有害气体 烟尘 二氧化硫 一氧化碳 二氧化氮 小 少 考点二 测定空气中氧气的含量 1. 实验装置 ( 如图 5-1 所示 ) 图 5-1 2. 实验现象 铜粉变成 色 , 冷却后密闭装置内的气体体积约减少 。 黑 4. 实验误差分析 所测氧气的体积小于空气总体积的原因 : (1) 装置 。 (2) 铜粉的量 , 没有耗尽氧气。 (3) 没有 就读数。 (4) 加热时 , 没有不断推拉活塞 , 氧气没有与铜粉完全反应等。 2 漏气 不足 2 冷却至室温 5. 注意事项 (1) 加热时 , 气体受热膨胀 , 为防止橡皮塞冲出 , 小气球起缓冲作用。 (2) 铜粉替代品需满足以下条件 : 只与空气中的氧气反应 , 且生成物为固体。若可燃物还能与空气中的其他气体反应 , 则注射器内气体体积减小量大 , 测定结果偏大 ; 若燃烧生成其他气体 , 会使注射器内气体体积变化不大 , 导致测定结果偏小。 6. 变式装置 图 5-2 1. 物理性质 通常氧气是无色无味的气体 , 溶于水 , 密度比空气 , 液态或固态时呈淡蓝色。 2. 化学性质 氧气化学性质活泼 , 能与许多物质反应 , 同时氧气具有 性 , 能使带火星的木条 , 但不具有可燃性。 考点三 氧气的性质 不易 大 助燃 复燃 发出白光 , 放出热量 氧化 火星四射 黑色 氧化 明亮 氧化 考点四 氧气的制备 1. 氧气的实验室制法 药品 高锰酸钾 氯酸钾 过氧化氢 反应原理 发生装置 收集装置 实验步骤 ① 查 : 检查装置的气密性 ② 装 : 把药品装入试管中 , 使之平铺在试管底部 , 组装仪器 ③ 定 : 固定实验 装置 ④ 点 : 点燃酒精灯加热 ⑤ 收 : 收集气体 ( 用向上排空气法或排水法 ) ⑥ 离 : 撤离 导管 ⑦ 熄 : 熄灭酒精灯 谐音记忆 : 茶庄定点收利息 ① 查 ② 装 ③ 定 ④ 收 ⑤ 离 (续表) (续表) 验 满方法 用向上排空气法收集时 , 将带火星的木条放在瓶口 , 如果木条复燃 , 说明已收集满 检验方法 将带火星的木条伸入集气瓶内 , 如果木条复燃 , 证明是氧气 放置方法 收集 满氧气后 , 集气瓶应正立放置在桌面上 2. 工业制备氧气 利用液态氧和液态氮的 不同 , 采用分离液态空气的方法。此过程发生 变化。 沸点 物理 催化剂是指在化学反应中能 其他物质的 , 而本身的 和 在反应前后都没有改变的物质。即 “ 一变两不变 ” 。 催化剂在化学反应中所起的作用叫作 。 考点五 催化剂和催化作用 改变 化学反应速率 质量 化学性质 催化作用 [ 提示 ] ① 催化剂只改变化学反应速率 , 不能改变生成物的质量 , 也不能决定反应是否进行。 ② 在化学反应前后 , 催化剂本身化学性质没变 , 物理性质可能会变。 ③ 催化剂改变化学反应速率 , 既包括加快 , 也包括减慢。 ④ 催化剂在化学反应前后不改变 , 在反应过程中有可能改变。 ⑤ 不同的化学反应有不同的催化剂 , 同一化学反应也可能有几种催化剂。 考点六 氧化反应、氧化物及自然界中的氧循环 1. 氧化反应与化合反应的关系 图 5-3 2. 化合物和氧化物的比较 化合物 氧化物 宏观组成 由两种或两种以上元素组成的纯净物 由两种元素组成的化合物 , 其中一种元素是氧元素 关系 3. 自然界中的氧循环 (1) 产生 : 绿色植物的 。 (2) 消耗 : 燃料的燃烧、动植物的 。 (3) 意义 : 维持了相对恒定的大气含氧量 , 构建了陆地、海洋和大气等环境的物质和能量平衡 , 为生态系统的正常运转提供可靠的资源保障。 4. 缓慢氧化 缓慢氧化进行得很慢 , 甚至不容易被察觉 , 如动植物呼吸、食物腐烂、酒和醋的酿造、农家肥料的腐熟等。 光合作用 呼吸作用 化学方程式网络构建 图 5-4 考向一 空气的成分及用途 ( 6 年 3 考) 1. [2019· 娄底 ] 空气中含量较多且化学性质比较活泼的气体是 ( ) A. 氧气 B. 氮气 C. 稀有气体 D. 二氧化碳 [ 答案 ] A [ 解析 ] 空气的主要成分是氮气和氧气 , 氮气化学性质不活泼 , 氧气是比较活泼的气体。 2. [2019· 天水 ] 空气是一种宝贵的自然资源 , 由多种物质组成。下列说法错误的是 ( ) A. 氦气可用来填充探空气球 B. 氮气充入食品包装袋防腐 C. 二氧化碳是植物光合作用的基本原料 D. 氧气可用作火箭发射的燃料 [ 答案 ] D [ 解析 ] 氧气可以支持燃烧 , 不能燃烧 , 可用作火箭发射的助燃剂。 考向二 氧气的性质 ( 6 年 1 考) 3. [2019· 天津 ] 下列对实验现象的描述不正确的是 ( ) A. 镁条在空气中燃烧 , 发出耀眼白光 B. 硫在氧气中燃烧 , 发出蓝紫色火焰 C. 蜡烛在空气中燃烧 , 生成二氧化碳和水 D. 氢气在空气中燃烧 , 产生淡蓝色火焰 [ 答案 ] C [ 解析 ] 蜡烛在空气中燃烧 , 生成二氧化碳和水是实验结论 , 不是实验现象。 4. [2019· 苏州 ] 下列关于氧气的说法正确的是 ( ) A. 分离液态空气获得氧气是化学变化 B. 植物的光合作用会消耗氧气 C. 氧气的化学性质不活泼 D. 液态氧可用作火箭助燃剂 [ 答案 ] D [ 解析 ] 分离液态空气获得氧气 , 是利用液态氧气、氮气的沸点不同 , 将其分离的过程中没有新物质生成 , 属于物理变化 ; 植物的光合作用是指植物利用光能把二氧化碳和水转化成有机物 , 并释放氧气的过程 ; 氧气是一种化学性质比较活泼的气体 , 许多物质都可以与氧气发生化学反应 ; 氧气具有助燃性 , 所以液态氧可用作火箭助燃剂。 【 方法点拨 】 燃烧的实验现象描述及注意事项 现象描述 ① 发光 : 发出 …… 色的光 ( 火焰 ) ② 放热 : 放出热量 ③ 产物色、味、状态 : 生成 …… 色 ( 味 ) 气体 / 固体 ( 大量白烟 ) 注意事项 ① 区分 “ 光 ” 和 “ 火焰 ”: 气体燃烧有火焰 , 固体燃烧一般发光 ② 区分 “ 烟 ” 和 “ 雾 ”: 一般生成物中液体为雾 , 固体为烟 ③ 区分反应物浓度 : 在氧气中燃烧更剧烈 ④ 区分现象与结论 : 能直观感受到的如色、味、状态等为现象 , 生成物名称出现时为结论 5. [2019· 广东 ] 燃烧是人类最早利用的化学反应之一。请回答 : (1) 按图 5-5 进行铁丝在 O 2 中燃烧的实验 , 反应的化学方程式为 。该实验装置存在明显不足 , 改进措施是 。 [ 答案 ] (1)3Fe+2O 2 Fe 3 O 4 在集气瓶底铺一层细沙 ( 或放少量的水 ) [ 解析 ] (1) 为防止铁丝燃烧生成的高温熔融物溅落炸裂瓶底 , 应事先在集气瓶底铺一层细沙或放少量的水。 图 5-5 5. [2019· 广东 ] 燃烧是人类最早利用的化学反应之一。请回答 : (2) 对比铁丝在空气中不能燃烧、在氧气中剧烈燃烧的现象 , 分析室内起火时 , 如果打开门窗 , 火会烧得更旺的原因是 。 [ 答案 ] (2) 打开门窗起到补充氧气 ( 或增大氧气浓度 ) 的作用 [ 解析 ] (2) 铁丝在空气中不能燃烧 , 在氧气中剧烈燃烧 , 原因是氧气的浓度不同。室内起火时 , 如果打开门窗 , 火会烧得更旺 , 原因是打开门窗起到补充氧气 ( 或增大氧气浓度 ) 的作用。 图 5-5 6. [2019· 常州改编 ] 某化学兴趣小组利用如图 5-6 所示装置进行氧气的制取和性质实验。 (1) 仪器 a 的名称是 。 图 5-6 分液漏斗 6. [2019· 常州改编 ] 某化学兴趣小组利用如图 5-6 所示装置进行氧气的制取和性质实验。 (2) 实验中 , 点燃酒精灯后 , 可观察到硫粉在氧气中燃烧呈现 色火焰 ; 装置 C 中的现象是 。 [ 答案 ] (2) 蓝紫 溶液褪色 [ 解析 ] (2) 硫粉在氧气中燃烧 , 发出明亮的蓝紫色火焰 ; 二氧化硫具有还原性 , 可以使高锰酸钾溶液褪色。 图 5-6 6. [2019· 常州改编 ] 某化学兴趣小组利用如图 5-6 所示装置进行氧气的制取和性质实验。 (3) 装置 D 的作用是 ( 用化学方程式表示 ) 。 [ 答案 ] (3)2NaOH+SO 2 Na 2 SO 3 +H 2 O [ 解析 ] (3) 二氧化硫与氢氧化钠反应生成亚硫酸钠和水 , 化学方程式为 2NaOH+SO 2 Na 2 SO 3 +H 2 O 。 图 5-6 6. [2019· 常州改编 ] 某化学兴趣小组利用如图 5-6 所示装置进行氧气的制取和性质实验。 (4) 为了证明装置 C 中出现的现象不是由氧气造成的 , 在不改变装置的情况下 , 操作方法是 , 并观察装置 C 中的现象。 [ 答案 ] (4) 点燃酒精灯前先通一段时间氧气 [ 解析 ] (4) 要排除装置 C 中出现的现象不是由氧气造成的 , 可以在点燃酒精灯前先通一段时间氧气 , 如果高锰酸钾溶液不褪色 , 说明溶液褪色与氧气无关。 图 5-6 6. [2019· 常州改编 ] 某化学兴趣小组利用如图 5-6 所示装置进行氧气的制取和性质实验。 (5) 实验时加入 6% 的过氧化氢溶液 51 g, 理论上可生成 氧气。 [ 答案 ] (5)1.44 g 图 5-6 考向三 空气中氧气含量的测定 ( 6 年 1 考) 图 5-7 7. [2017· 常州 ] 如图 5-7 是测定空气中氧气含量的实验装置。实验如下 : 用注射器抽取 30 mL 空气 ( 活塞拉至 30 mL 刻度处 ), 硬质玻璃管中空气的体积为 50 mL, 在硬质玻璃管中放入过量的铜粉 , 在右侧导管口套上瘪的气球 ; 点燃酒精灯 , 反复推拉注射器和挤压气球 , 待充分反应后 , 冷却至室温 , 将气球中的气体全部挤入硬质玻璃管 , 注射器中气体的体积为 14 mL 。 (1) 写出铜粉与氧气反应的化学方程式 : 。 [ 答案 ] (1)2Cu+O 2 2CuO [ 解析 ] (1) 铜粉与氧气反应的化学方程式为 2Cu+O 2 2CuO 。 7. [2017· 常州 ] 如图 5-7 是测定空气中氧气含量的实验装置。实验如下 : 用注射器抽取 30 mL 空气 ( 活塞拉至 30 mL 刻度处 ), 硬质玻璃管中空气的体积为 50 mL, 在硬质玻璃管中放入过量的铜粉 , 在右侧导管口套上瘪的气球 ; 点燃酒精灯 , 反复推拉注射器和挤压气球 , 待充分反应后 , 冷却至室温 , 将气球中的气体全部挤入硬质玻璃管 , 注射器中气体的体积为 14 mL 。 (2) 实验时 , 铜粉过量的目的是 ; ( 填 “ 能 ” 或 “ 不能 ”) 用木炭 代替铜粉进行相同实验。 (3) 实验测得空气中氧气的含量为 。 图 5-7 [ 答案 ] (2) 使氧气完全反应 不能 (3) 20% (1) 除铜外用其他药品也可以完成该实验 , 替代品需满足的条件是 : 只与空气中的 反应 , 且生成物为 。若替代品还能与空气中的其他气体反应 , 会使测定结果偏 ; 若替代品燃烧生成其他气体 , 会使测定结果偏 。 (2) 实验中不断推拉注射器的原因是 。 · 拓展延伸 · 氧气 固体 大 小 使空气流动与铜粉接触 , 保证铜粉与氧气充分反应 氮气的化学性质比较稳定 ( 或氮气不与铜反应 , 合理即可 ) (4) 使用红磷利用如图 5-8 所示装置也可以测定空气中氧气的含量 , 可使用红磷代替金属铜的原因是 。红磷燃烧时的现象是 , 已知广口瓶液面以上被平均分为了 5 份 , 冷却后 , 你认为水进入广口瓶的体积约占液面以上体积的 。若最终测得氧气的体积分数偏小 , 则造成实验误差的原因可能有 ( 答一点即可 ) 。 图 5-8 红磷只与空气中的氧气反应且生成物为固体 产生大量白烟 装置气密性不好 ( 或红磷的量不足或装置未冷却至室温就打开弹簧夹等 , 合理即可 ) 8. 空气中氧气含量测定的再认识。教材中介绍了拉瓦锡用定量的方法研究了空气的成分 ( 实验装置如图 5-9 甲 ) 。 [ 经典赏析 ] 该实验中选择使用汞的优点有 。 A. 实验过程中没有污染 B. 生成的化合物加热分解又能得到汞和氧气 C. 在汞槽中起到液封的作用 D. 能将密闭装置内空气中的氧气几乎耗尽 图 5-9 [ 答案 ] [ 经典赏析 ] BCD [ 解析 ][ 经典赏析 ] 汞蒸气有毒 , 该实验过程中可能会造成污染 ,A 错误 ; 反应生成的氧化汞受热分解生成汞和氧气 ,B 正确 ; 在汞槽中加入一定量的汞 , 可起到液封的作用 ,C 正确 ; 汞能与氧气反应 , 且能将密闭装置内空气中的氧气几乎耗尽 ,D 正确。 [ 实验回顾 ] 实验室常用红磷燃烧的方法测定空气中氧气的含量 ( 装置如图乙 ), 写出红磷燃烧的化学方程式 : 。兴趣小组用该方法测出的氧气含量常常远低于 21% 。 [ 提出问题 ] 用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量 ? [ 进行猜想 ] (1) 装置漏气 ; (2) , 装置内氧气有剩余 …… 图 5-9 [ 答案 ] [ 实验回顾 ] [ 进行猜想 ] 红磷的量不足 [ 解析 ] [ 实验回顾 ] 红磷与氧气在点燃的条件下反应生成五氧化二磷。 [ 进行猜想 ] 红磷的量不足 , 会导致瓶内氧气未消耗完 , 使测量结果偏小。 [ 实验与交流 ] 在老师的指导下 , 小明分别用过量的红磷和白磷进行该实验 , 用测氧气浓度的传感器测得反应后装置内氧气浓度分别为 8.85% 和 3.21% 。请从燃烧条件的角度回答产生上述结果的主要原因 : 。 图 5-9 [ 答案 ] [ 实验与交流 ] 白磷的着火点比红磷的着火点低 [ 解析 ] [ 实验与交流 ] 白磷的着火点比红磷的着火点低 , 白磷与氧气反应更充分 , 消耗的氧气更多。 [ 实验探究 1] 小明根据铁生锈的原理 , 探究用铁能否准确测定空气中氧气的含量。于是进行了实验 ( 装置如图丙 ) 。通过 7 天测得的数据计算出空气中氧气的含量为 19.13% 。 [ 交流与反思 ] 与用红磷燃烧的方法相比 , 用铁丝生锈的方法测定的主要优点及原因 : ______________________________________ 。 图 5-9 [ 答案 ] [ 交流与反思 ] 铁生锈使装置内残留的氧气更少 , 实验结果更准确 [ 解析 ] [ 交流与反思 ] 铁生锈使装置内残留的氧气更少 , 实验结果更准确。 [ 实验探究 2] 为了加快反应速率 , 小明通过查阅资料 , 利用铁粉、炭粉、氯化钠等物质又进行了实验 ( 装置如图丁 ) 。 8 分钟后测得的数据如下表 : 计算出空气中氧气含量为 ( 计算结果保留到 0.1%) 。 图 5-9 实验前的体积 实验后的体积 集气瓶内空气 烧杯内蒸馏水 烧杯内 剩余 蒸馏水 131 mL 90.0 mL 63.6 mL [ 答案 ] [ 实验探究 2]20.2% [ 结论与反思 ] 通过上述实验探究 , 选择 ( 填 物质名称 ) 进行实验 , 可较为快速地完成实验 并减小实验误差。 [ 拓展延伸 ] 铜也能与空气中氧气、水、二氧 化碳反应而锈蚀 , 生成铜绿 [ 铜绿的主要成分 为 Cu 2 (OH) 2 CO 3 ] 。若将图丙装置中的细铁 丝换成足量的铜丝进行实验 , 请判断能否比较 准确地测定空气中氧气的含量 , 并说明理由 : 。 图 5-9 [ 答案 ] [ 结论与反思 ] 铁粉、炭粉、氯化钠和蒸馏水 ( 或白磷 ) [ 拓展延伸 ] 不能 , 因为空气中二氧化碳含量只有约 0.03%, 铜不能将装置内的氧气几乎耗尽 [ 解析 ] [ 结论与反思 ] 根据前面的分析可知 : 使用铁粉、炭粉、氯化钠和蒸馏水或者使用白磷进行实验 , 可较为快速地完成实验并减小实验误差。 [ 拓展延伸 ] 空气中二氧化碳含量约为 0.03%, 铜不能将装置内的氧气几乎耗尽 , 因此用铜丝进行实验 , 不能比较准确地测定空气中氧气的含量。 考向四 氧气的实验室制法 ( 6 年 4 考) 图 5-10 9. 如图 5-10 是实验室制取气体的装置。 (1) 仪器 a 的名称是 。 (2) 实验室用过氧化氢制取氧气 , 其反应的化学方程式是 , 若从控制反应速率的角度考虑 , 应选择的发生装置是 ( 填序号 ) 。 [ 答案 ] (1) 分液漏斗 (2)2H 2 O 2 2H 2 O+O 2 ↑ B 9. 如图 5-10 是实验室制取气体的装置。 (3) 实验室若用氯酸钾和二氧化锰 ( 作催化剂 ) 制 取氧气 , 可选择 C 作发生装置 , 其反应的化学方程式是 。 (4)D 、 E 、 F 、 G 都是实验室中气体的收集装置 , 其中不能用来收集氧气的是 ( 填序号 ) 。 图 5-10 [ 答案 ] (3)2KClO 3 2KCl+3O 2 ↑ (4)D (1) 用来制取氧气的物质 , 都含有 。 (2) 用过氧化氢制取氧气的优点是 。 (3) 使用分液漏斗代替长颈漏斗的优点是 。 (4) 若选用 C 装置在试管口放一团棉花制取氧气 , 请写出该反应的化学方程式 : 。加热时 , 试管口略向下倾斜的目的是 。 (5) 加热高锰酸钾制取氧气时 , 试管口放一团棉花的作用是 。 · 拓展延伸 · 氧元素 不用加热 , 操作简便 ( 合理即可 ) 可以控制反应速率 防止冷凝水回流导致试管炸裂 防止高锰酸钾粉末进入导管 (6) 选用 C 、 F 装置制取氧气 , 当 开始收集氧气 , 结束时应该先移出导管再熄灭酒精灯 , 目的是 。 (7) 不同收集方法的优缺点是 ________________________________________________ ___________________________________________________________________________ 。 导管口有连续、均匀的气泡冒出时 防止水倒吸使试管炸裂 用排水法收集的氧气比较纯净 , 且不需验满 , 但制取的氧气中含有水分 , 做有关实验时需用浓硫酸干燥 ; 用向上排空气法收集氧气操作简便 , 但相对不纯 , 且需要验满 10. [2017· 宿迁 ] 下列说法不正确的是 ( ) A. 空气中 N 2 的体积分数约为 78% B.O 2 的化学性质比较活泼 , 具有可燃性 C.CO 2 是绿色植物光合作用的原料之一 D. 稀有气体化学性质稳定 , 可用作保护气 [ 答案 ] B [ 解析 ] 空气中氮气约占空气体积的 78%;O 2 的化学性质比较活泼 , 具有助燃性 , 没有可燃性 ;CO 2 是绿色植物光合作用的原料之一 ; 稀有气体化学性质稳定 , 可用作保护气。 [ 答案 ] B [ 解析 ] 催化剂能改变化学反应速率 , 可以加快反应速率 , 也能减慢反应速率 ; 溶液是一种或几种物质分散在另一种物质中形成的均一、稳定的混合物 ; 由分子构成的物质 , 分子是保持物质化学性质的最小粒子 , 由原子直接构成的物质 , 原子是保持物质化学性质的最小粒子 ; 空气中氧气的体积分数约为 21%, 不是质量分数。 11. [2019· 宿迁 ] 下列说法中正确的是 ( ) A. 催化剂只能加快反应速率 B. 溶液一定是混合物 C. 分子是保持物质性质的最小粒子 D. 空气中氧气的质量分数约为 21% 12. [2015· 宿迁 ] 结合下列实验装置图回答问题。 (1) 实验室常用 H 2 O 2 在二氧化锰催化作用下制取 O 2 , 选用的发生装置是 ________ ( 填序号 ), 反应的化学方程式 : 。 (2) 装置 C 是探究 FeCl 3 和 CuSO 4 对 H 2 O 2 分解效果的实验 , 可通过观察 ( 现象 ), 判断两者的催化效果。 B 图 5-11 产生气体的速率快慢 (3) 要证明 CO 2 不支持燃烧 , 密度比空气大的性质 , 你认为用 ( 填 “D” 或 “E”) 装置 , 操作方法效果更好。 图 5-11 D查看更多