- 2021-11-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
组成燃料的主要元素―碳教案1
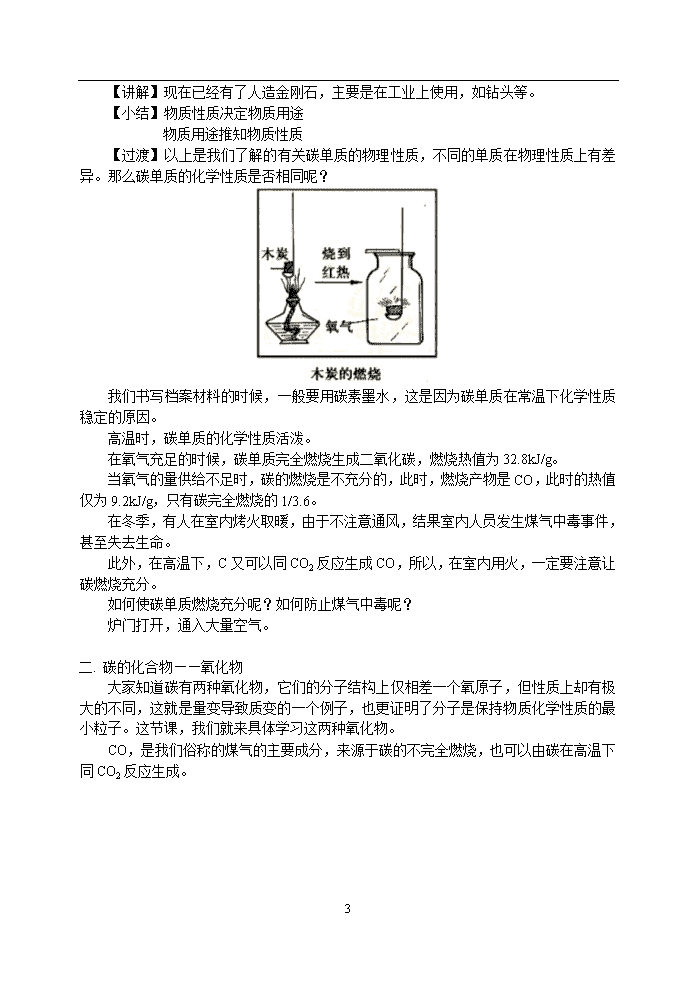
5.2 组成燃料的主要元素——碳 一. 教学内容: 5.2 组成燃料的主要元素——碳 1、了解金刚石与石墨,碳单质的物理性质及主要用途 2、知道一种元素可以因结构不同而能组成几种不同的单质 3、认识碳的燃烧及其产物 4、了解CO和CO2的性质、实验室制法及CO2的用途 二. 教学重点: C、CO和CO2的性质及CO2的实验室制法 三. 教学难点: C、CO2的性质的探究过程 [教学程序] 5.2 组成燃料的主要元素----碳 一. 碳单质 【引言】大家已经学过氧和氢两种元素,今天再来学习一种元素——碳,C、H、O这三种元素与人类的关系非常密切,是构成生命的基本元素。目前已知的1000多万种化合物中,绝大多数都是含碳化合物,碳是为人类提供能量的燃料的主要元素。今天,我们来认识一下碳的几种单质。 【实验】 用玻璃刀切割玻璃 用石墨做导电实验 用铅笔写字 【讨论】通过以上实验现象,体现了碳单质的哪些性质呢? 1. 金刚石的硬度居天然物质之冠,可制成玻璃刀、钻头或装饰品等。 2. 9 石墨硬度很小,有滑腻感,可制成铅笔芯;能够导电、熔点高,可做干电池和电炉的电极、坩埚等。 3. 无定形碳具有较强的吸附能力,作防毒面具中的滤芯。 【思考】这些物质在物理性质上具有这么大的差异,是不是由同种元素组成的呢? 【讲解】实验证明,金刚石和石墨都能在氧气中燃烧,而且都生成同一种物质,这种物质能够使澄清的石灰水变浑浊。 它们都是由碳元素组成的单质。 【思考】既然这些物质是同种元素组成的单质,为什么物理性质有这么大的差异呢? 【讲解】虽然构成这些单质的原子结构是相同的,但是,其排列方式是不同的。所以产生了不相同的物理性质。 近年来,除了我们常见的金刚石、石墨这些碳单质以外,科学家们还合成了C60、C50、C70等,近期又合成了碳纳米管,现正对此进行开发和利用。 【思考】既然金刚石、石墨都是由同种元素组成的单质,能不能利用外界力量将它们的结构改变,将石墨变成金刚石呢? 9 【讲解】现在已经有了人造金刚石,主要是在工业上使用,如钻头等。 【小结】物质性质决定物质用途 物质用途推知物质性质 【过渡】以上是我们了解的有关碳单质的物理性质,不同的单质在物理性质上有差异。那么碳单质的化学性质是否相同呢? 我们书写档案材料的时候,一般要用碳素墨水,这是因为碳单质在常温下化学性质稳定的原因。 高温时,碳单质的化学性质活泼。 在氧气充足的时候,碳单质完全燃烧生成二氧化碳,燃烧热值为32.8kJ/g。 当氧气的量供给不足时,碳的燃烧是不充分的,此时,燃烧产物是CO,此时的热值仅为9.2kJ/g,只有碳完全燃烧的1/3.6。 在冬季,有人在室内烤火取暖,由于不注意通风,结果室内人员发生煤气中毒事件,甚至失去生命。 此外,在高温下,C又可以同CO2反应生成CO,所以,在室内用火,一定要注意让碳燃烧充分。 如何使碳单质燃烧充分呢?如何防止煤气中毒呢? 炉门打开,通入大量空气。 二. 碳的化合物——氧化物 大家知道碳有两种氧化物,它们的分子结构上仅相差一个氧原子,但性质上却有极大的不同,这就是量变导致质变的一个例子,也更证明了分子是保持物质化学性质的最小粒子。这节课,我们就来具体学习这两种氧化物。 CO,是我们俗称的煤气的主要成分,来源于碳的不完全燃烧,也可以由碳在高温下同CO2反应生成。 9 CO是无色、无味、难溶于水的气体,可以燃烧,燃烧的产物是CO2,主要特性是具有毒性,使用时要注意防止煤气中毒。 CO中毒的原因是它与人体的血红蛋白结合,使血红蛋白失去同氧气结合的能力。 CO2与CO仅相差一个氧原子,它具有什么样的性质呢? CO2的性质: (一)二氧化碳的物理性质 二氧化碳是无色、无味的气体 固态时被称为“干冰”,有升华的特点 通过饮用啤酒、汽水及碳酸饮料时的感性知识,二氧化碳在水中的溶解性应该是怎样的? 二氧化碳能溶于水,1体积的水约能溶解1体积的CO2 【实验】CO2熄灭蜡烛火焰的实验 【提问】该现象说明了什么? (二)二氧化碳的化学性质: 1. 通常CO2不能燃烧,也不支持燃烧,不供给呼吸 【实验】向盛有紫色石蕊试液的试管中加几滴盐酸 说明:紫色石蕊试液遇酸变成红色 9 【实验】向滴有紫色石蕊试液的水中通入二氧化碳 【提问】产生该现象的原因是什么? 2. 二氧化碳跟水反应生成碳酸 CO2+H2O=H2CO3 【实验】将上述变红的溶液加热 【提问】红色溶液为何变成紫色? 说明:碳酸很不稳定,易分解成水和二氧化碳,加热时分解更快. H2CO3=H2O+CO2 【实验】 CO2跟石灰水[主要成分是Ca(OH)2]反应,生成一种难溶于水的物质――碳酸钙。CO2+Ca(OH)2=CaCO3↓+H2O 说明:H2CO3和CaCO3中的原子团“CO3”叫碳酸根,化合价为“-2”。 同时,可利用石灰水变浑浊检验二氧化碳的存在 二氧化碳的用途: 9 三. 二氧化碳的实验室制法 1. 药品及反应原理 选择依据: 反应速率适中;原料易得价廉;操作简便安全;产物纯净易分离;过程节能环保…… 药品:石灰石(或大理石)和稀盐酸 原理:CaCO3+2HCl=CaCl2+H2O+CO2↑ 2. 装置的确定 9 3. 气体的验满 点燃的木条放在瓶口 【模拟试题】(答题时间:50分钟) 一、填空题: 1、二氧化碳用于灭火是因为它 。 2、在O2、H2、CO、CO2等气体中: A、有毒且有还原性的是 ; B、只能用向上排空气法收集的是 ;可以用排水法收集的是 ; C、将有可能成为一种新型燃料的是 ; D、水煤气(管道煤气)的主要成分是 ; E、可用作火箭或导弹的高能燃料的是 ,用作助燃剂的是 ; F、盛放过石灰水的容器内壁,往往会出现一层白色物质,这种物质叫______,其化学式是 ,要除去这层物质,可先加 溶解,再加_____ 冲洗。 3、盛有石灰水的试剂瓶因密封不好,常含有 杂质,可用 的方法除去。 4、光合作用:水+二氧化碳淀粉+氧气,由此可知,淀粉中一定含有________元素,可能含有 元素。 二、选择题: 5、具有人工降雨、灭火、致冷剂、制饮料等用途的物质是( ) A. 烧碱 B. 干冰 C. 盐酸 D. 生石灰 6、某物质在空气中燃烧,产物之一为二氧化碳,则该物质是( ) A. 一定是碳的某种单质 B. 一定是一氧化碳 C. 一定是乙醇 D. 一定含有碳元素 7、一些国家正在试用碳酸水浇灌某些植物,这样做不能起到的作用是( ) A. 改良碱性土壤 B. 改良酸性土壤 C. 促进植物的光合作用 D. 促进农作物增产增收 8、北约曾用“石墨” 9 炸弹使南联盟的高压输电线路短路,这是由于石墨的什么性质决定的?( ) A. 可燃性 B. 还原性 C. 导电性 D. 常温下的稳定性 9、为减少实验对环境的污染,防止实验人员中毒,下列气体的制取要在通风橱中进行的是 ( ) A. O2 B. CH4 C. CO2 D. CO 10、下列说法中在科学上没有错误的是( ) A. 吸带过滤嘴的香烟,对人体无害 B. 纯天然物质配成的饮料不含任何化学物质 C. 到小煤窑里挖煤用火把照明 D. 保护环境就是保护人类自己 11、下列物质中硬度最大的是( ) A. 石墨 B. 铁 C. 金刚石 D. 木炭 12、我国的黑白山水画用的是墨汁,主要成分是炭黑的微粒,用这种墨汁画的国画千百年都不易变色,这是因为墨汁中的碳( ) A. 具有吸附性 B. 常温下化学性质稳定 C. 具有还原性 D. 具有氧化性 13、用玻璃管向盛有紫色石蕊试液的试管中吹气,过一会儿再给试管加热,试管里溶液颜色的变化情况是( ) A. 紫色→红色→紫色 B. 紫色→蓝色→红色 C. 红色→紫色→红色 D. 紫色→红色→蓝色 14、由碳和氧两种元素组成的气体,碳与氧两种元素的质量比为3∶5,该气体( ) A. 属于混合物 B. 属于纯净物 C. 属于单质 D. 无法确定 三、情境分析题: 15、物质的某些性质可能有利于人类,也可能不利于人类,请填写下表: 物质名称 有利的一面 不利的一面 氧气 二氧化碳 16、自然界中常发生下列变化:①CaCO3+H2O+CO2=Ca(HCO3)2②Ca(HCO3)2受热或遇压强突然变小时,又分解为Ca(HCO3)=CaCO3+H2O+CO2↑,如此反复就形成了石灰岩溶洞里奇特的钟乳石、石笋、石柱等景观。 ⑴①中发生的反应属 反应。(填“分解”或“化合”) ⑵②石灰岩溶洞里的钟乳石、石笋每年大约增加0.1mm,若要形成1m高的石笋约需______年。你作为一名游人,对这一结果有何感想 。 四、实验探究题: 17、某同学利用一支底部有破洞的试管和一个广口瓶组装成制取二氧化碳的发生装置(如图所示),在铜网上应放 ,广口瓶中应盛有 。 9 五、计算题: 18、实验室用25g含碳酸钙80%的石灰石与足量的稀盐酸完全反应后可制得二氧化碳的质量是多少克? 【试题答案】 一、填空题: 1、既不燃烧,也不支持燃烧,密度比空气大 2、A、CO B、CO2 O2、H2 C、H2 O2 D、H2、CO E、H2、O2 F、碳酸钙 CaCO3 盐酸 水 3、碳酸钙 过滤 4、氢、碳 氧 二、选择题: 5、B 6、D 7、B 8、C 9、D 10、D 11、C 12、B 13、A 14、A 三、情境分析题: 15、氧气:供给呼吸、急救病人 使金属腐蚀 二氧化碳:人工降雨、光合作用 温室效应 16、⑴化合 ⑵10000 自然界各种景观都需要漫长的过程才能形成,所以要爱护环境,保持生态平衡,做文明市民。 四、实验探究题: 17、碳酸钙 盐酸 五、计算题: 18、8.8g 9查看更多