- 2021-10-27 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
第5节 物质的溶解(第4课时)
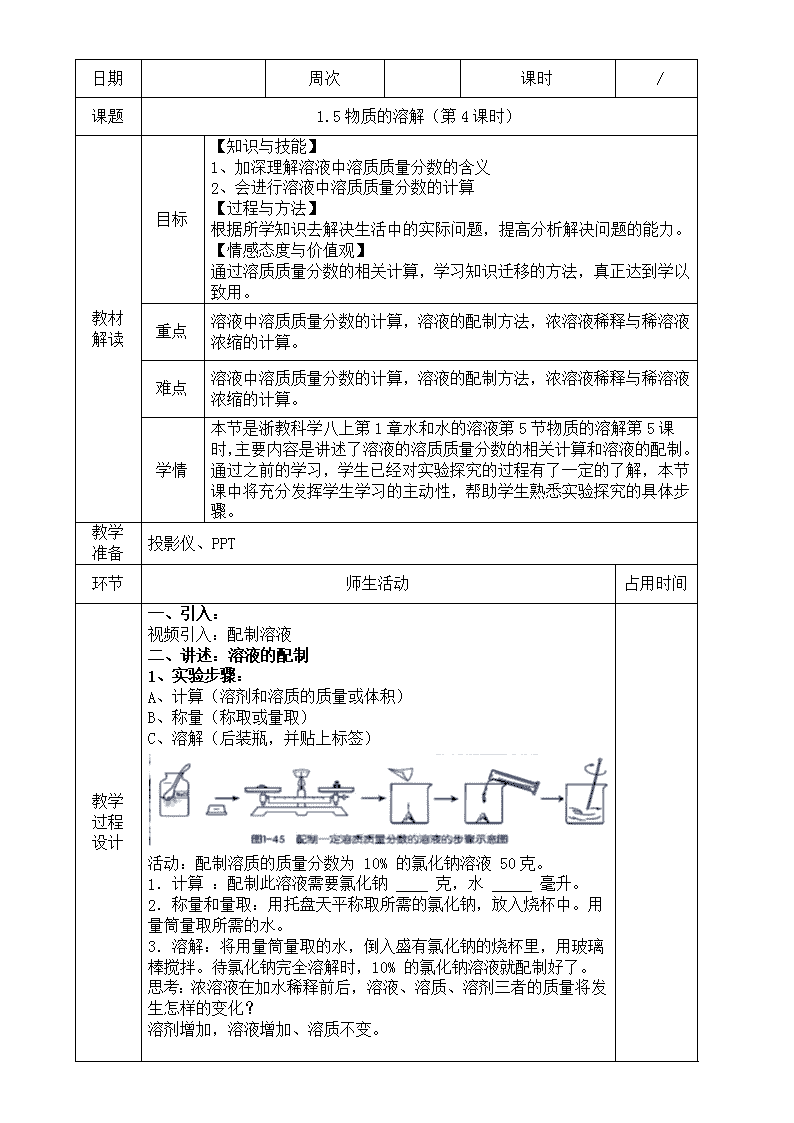
日期 周次 课时 / 课题 1.5 物质的溶解(第 4 课时) 教材 解读 目标 【知识与技能】 1、加深理解溶液中溶质质量分数的含义 2、会进行溶液中溶质质量分数的计算 【过程与方法】 根据所学知识去解决生活中的实际问题,提高分析解决问题的能力。 【情感态度与价值观】 通过溶质质量分数的相关计算,学习知识迁移的方法,真正达到学以 致用。 重点 溶液中溶质质量分数的计算,溶液的配制方法,浓溶液稀释与稀溶液 浓缩的计算。 难点 溶液中溶质质量分数的计算,溶液的配制方法,浓溶液稀释与稀溶液 浓缩的计算。 学情 本节是浙教科学八上第 1 章水和水的溶液第 5 节物质的溶解第 5 课时, 主要内容是讲述了溶液的溶质质量分数的相关计算和溶液的配制。通 过之前的学习,学生已经对实验探究的过程有了一定的了解,本节课 中将充分发挥学生学习的主动性,帮助学生熟悉实验探究的具体步 骤。 教学 准备 投影仪、PPT 环节 师生活动 占用时间 教学 过程 设计 一、引入: 视频引入:配制溶液 二、讲述:溶液的配制 1、实验步骤: A、计算(溶剂和溶质的质量或体积) B、称量(称取或量取) C、溶解(后装瓶,并贴上标签) 活动:配制溶质的质量分数为 10% 的氯化钠溶液 50 克。 1.计算 :配制此溶液需要氯化钠 ____ 克,水 _____ 毫升。 2.称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。用 量筒量取所需的水。 3.溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯里,用玻璃 棒搅拌。待氯化钠完全溶解时,10% 的氯化钠溶液就配制好了。 思考:浓溶液在加水稀释前后,溶液、溶质、溶剂三者的质量将发 生怎样的变化? 溶剂增加,溶液增加、溶质不变。 思考:将浓溶液稀释配制成稀溶液时,所需加水的量该如何计算? 溶质的质量在稀释前后不变。 2、溶液稀释或浓缩的计算: 例 1:把 50g 98%的浓硫酸稀释成 20%的硫酸,需要水多少毫升? 练习 1:实验室需要质量分数为 15%的氯化钠溶液,现要配制 100g 这种溶液,请问: 练习 2:小明从试剂商店购得一瓶质量分数为 30%的双氧水,配制 120g 5%的双氧水,全部用于制氧气。请你计算一下,小明从商店 买来的双氧水的净含量为多少克?20 克 3.溶液质量分数与溶液密度关系 质量分数不同的溶液,溶液的密度也不同。生产上常把物质溶液的 密度和其相对应的溶质的质量分数列成对照表。 思考:根据表中的数据,你能得出何结论? 溶液的质量分数越大,溶液的密度也越大。 例题 2: 配制 1000 毫升溶质的质量分数为 10%的稀硫酸,需要溶 质的质量分数为 98%的浓硫酸多少毫升? 稀释浓硫酸的正确方法:浓硫酸沿着器壁倒入盛有水中的容器中, 并用玻璃棒不断搅拌。 三、课堂小结: 引导学生自主小结,并逐步完善和形成概念图。 当堂 检测 1. 实验室需配制 10%的盐酸 500 克,需要 38%的盐酸多少毫升 ?需要加水多 少毫升?并说说具体的配制过程。(已知 10%盐酸的密度是 1.047 克/厘米 3, 38%盐酸的密度是 1.19 克/厘米 3)115.7 毫升 2.白酒的“度”是指白酒中酒精的含量,如 53°的白酒中,酒精和水的体积之 比为 53:47.小明在家中进行实验时需要溶质质量分数为 20%的酒精,家中找 不到,也没有纯酒精,他找来一瓶 45°白酒,准备用来配制所需要的酒精溶 液.已知酒精的密度是ρ=0.8g/cm3.请计算 (1)45°白酒中的溶质的质量分数为多少?(结果保留到 1%) (2)欲配制 50g 溶质质量分数为 20%的酒精,需要这种白酒多少克? 3.如图是某同学配制一定质量的 0.9%生理盐水的全过程: 培优 扶差 作业 1.作业本 1.5 物质的溶解(第 4 课时) 板书 设计 1.5 物质的溶解(第 5 课时) 教学 反思查看更多