- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
内蒙古赤峰市2019-2020学年高二下学期期末联考化学(B卷)试题 Word版含答案
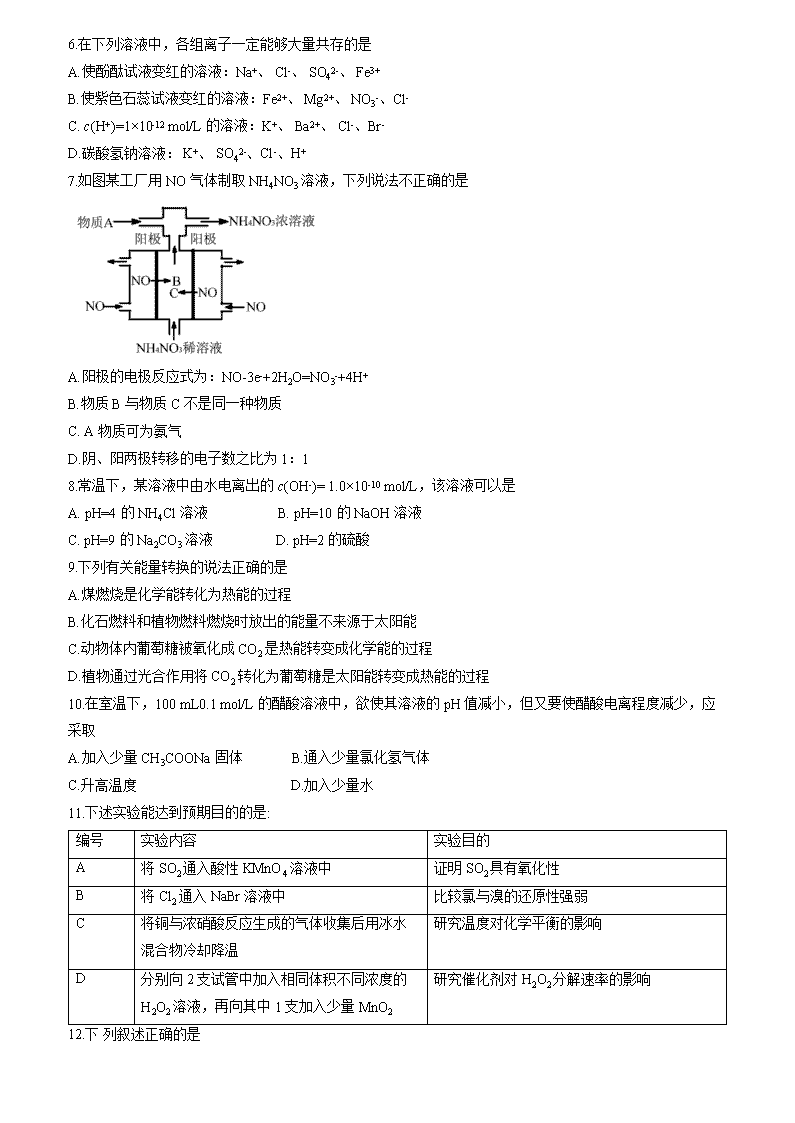
内蒙古赤峰市2019-2020学年高二下学期期末联考化学试题(B卷) 注意事项: 1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。考试时间90分钟,满分100分。答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答第I卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号.框涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号框。写在本试卷上无效。 3.回答第II卷时,将答案写在答题卡上。写在本试卷.上无效。 4.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na -23 Al-27 第I卷 选择题 (共45分) 一、选择题(本题共15小题,每小题3分,满分45分,在每小题给出的四个选项中,只有一项是符合题目要求的) 1.2020 年春季爆发了新型冠状病毒疫情,该病毒具有极强的传染性,杀菌消毒,做好个人防护是防止疫情蔓延的重要措施。下列有关说法中错误的是 A.医用酒精消毒液中乙醇的体积分数为75% B.84消毒液与酒精混用杀菌消毒效果更好 C.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料 D.二氧化氯泡腾片可用于水处理 2.下列叙述不正确的是 A.使用催化剂不能降低化学反应的反应热(△H) B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度有关 C.原电池中发生的反应达到平衡时,该电池仍有电流产生 D.在同浓度的盐酸中,ZnS 可溶而CuS不溶,说明CuS的溶解度比ZnS的小 3.对于合成氨反应,达到平衡后,以下分析正确的是 A.升高温度,对正、逆反应的反应速率都有影响 B.增大压强,对正反应的反应速率影响更大 C.减小反应物浓度,平衡正向移动 D.加入催化剂,平衡不移动 4.下列事实不能用勒夏特列原理解释的是 A.开启啤酒瓶后,瓶中马上泛起大量泡沫 B.由H2(g)、I2(g)、HI(g)组成的平衡体系,加压后颜色加深 C.实验室中常用排饱和食盐水的方法收集氯气 D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 5.“ 下列离子方程式中,属于水解反应的是 A. HCOOH+H2OHCOO- +H3O+ B. CO2+H2OHCO3- +H+ C. CO32-+ H2OHCO3-+OH- D.HS-+H2OS2-+H3O+ 6.在下列溶液中,各组离子一定能够大量共存的是 A.使酚酞试液变红的溶液:Na+、 Cl-、 SO42-、 Fe3+ B.使紫色石蕊试液变红的溶液:Fe2+、 Mg2+、 NO3-、Cl- C. c(H+)=1×10-12 mol/L的溶液:K+、 Ba2+、 Cl-、Br- D.碳酸氢钠溶液: K+、 SO42-、Cl-、H+ 7.如图某工厂用NO气体制取NH4NO3溶液,下列说法不正确的是 A.阳极的电极反应式为:NO-3e-+2H2O=NO3-+4H+ B.物质B与物质C不是同一种物质 C. A物质可为氨气 D.阴、阳两极转移的电子数之比为1:1 8.常温下,某溶液中由水电离出的c(OH-)= 1.0×10-10 mol/L,该溶液可以是 A. pH=4的NH4Cl溶液 B. pH=10 的NaOH溶液 C. pH=9的Na2CO3溶液 D. pH=2 的硫酸 9.下列有关能量转换的说法正确的是 A.煤燃烧是化学能转化为热能的过程 B.化石燃料和植物燃料燃烧时放出的能量不来源于太阳能 C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 10.在室温下,100 mL0.1 mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取 A.加入少量CH3COONa固体 B.通入少量氯化氢气体 C.升高温度 D.加入少量水 11.下述实验能达到预期目的的是: 编号 实验内容 实验目的 A 将SO2通入酸性KMnO4溶液中 证明SO2具有氧化性 B 将Cl2通入NaBr溶液中 比较氯与溴的还原性强弱 C 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 研究温度对化学平衡的影响 D 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 研究催化剂对H2O2分解速率的影响 12.下 列叙述正确的是 A.95℃时,纯水的pH<7,说明加热可导致水呈酸性 B. pH=3的醋酸溶液,稀释至10 倍后pH>4 C. 25℃时, 0. 2 mol/L的盐酸,与等体积水混合后pH=1 D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 13.在一个容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)=2C(g)。若最初加入的A、B都是4 mol,A的平均反应速率为0.12mol/ (L·s),10 s后容器中B的物质的量是 A.3.6 mol B.3.2 mol C.2.8 mol D.1.6 mol 14.钢铁发生吸氧腐蚀时,正极上发生的电极反应是 A. 2H++2e-= H2↑ B. Fe2++2e- =Fe C. 2H2O+O2+4e-=4OH- D. Fe3++e- = Fe2+ 15.用石墨作电极电解CuCl2溶液,当通电一段时间后,溶液仍呈蓝色时,收集到2.24 L气体(标准状况)。下列有关说法正确的是 A.阳极生成的铜为5.6 g B.电解过程中共转移0.2 mol电子 C.电解得到的Cu的物质的量为0.5 mol D. 电解后溶液呈碱性 第II卷 非选择题 (共55分) 二、必答题(本题包括3小题,共25分) 16. (14分)按要求填空。 (1) Na2CO3溶液中滴入酚酞试液呈红色,原因是(用离子方程式表示)_______________;加热后颜色变深,原因________________________________。 (2) FeCl3具有净水作用的原理(用离子方程式表示)__________________________。 (3)将NaHCO3溶液与AlCl3溶液混合(写出反应的离子方程式)___________________________。 (4)已知25℃时,Ksp[Mg(OH)2]=1.6×10-11。向0.01 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的c(OH-)为________mol/L; (5)常温时,Fe(OH)3的溶度积常数Ksp=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5 mol/L],则溶液的pH应大于______________。 (6) 25℃时,在2.0×10-3 mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液 pH的关系如下图。则25℃时,HF电离平衡常数为K(HF)=________________。 17. (5分)由Cu2+、Cl-、 Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。 (1)欲使铁制品表面镀铜,应以________为阳极,电解质溶液为________; (2)以铂作阳极电解_______溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为_________________________________> 18. (6分)某化学反应3A2B+D在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度c随时间t的变化情况如下表: 根据上述数据,完成下列填空: (1)在实验1,反应在10 min~20 min内反应物A的平均速率为____________; (2)在实验2,A的初始浓度c2____________mol/L,反应经_____min就达到平衡; (3)设实验3的反应速率为v3, 实验1的反应速率为v1,则v3__ _vl(填<、>或=)v1,且c3____2.0 mol/L(填填<、>或=); (4)比较实验4和实验1,可推测正反应是___________反应(填吸热或放热)。 三、选考题:(共30 分。请考生从24和25题中任选一题作答。如果多做,则按所做的第一题计分)。 19. [化学-选修3:物质结构与性质] (30分) 19 (A) (20分) 已知Al、Mg、Na为第三周期元素,其原子的第- -至第四电离能如下表: (1)则Al、Mg、Na的电负性从大到小的顺序为_____________。 (2) C、N、O、H是周期表中前10号元素,它们的原子半径依次减小,H能分别与C、N、O形成电子总数相等的分子CH4、NH3、H2O。 ①在CH4、NH3、H2O分子中,C、N、O三原子都采取_______杂化; ②CH4是含有__________键(填“极性”或“非极性”)的_______分子(填“极性”或“非极性”); ③NH3是一种易液化的气体,请简述其易液化的原因______________________。 ④H2O分子的VSEPR模型的空间构型为__________;H2O分子的空间构型为____________。 (3) K、Cr、 Cu三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。 ①K元素组成的单质的晶体堆积模型为__________(填代号); a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积 ②Cr元素在其化合物中最高化合价为__________; ③Cu2+离子的核外电子排布式为______________; 19(B)(10分)氮化硼(BN)是-种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3 和BN,如下图所示: 请回答下列问题: (1) 在BF3分子中,F-B-F的键角是______,B原子的杂化轨道类型为_________,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_________________。 (2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_______(填“极性键”或“非极性键”),层间作用 力为__________________。 20. [化学-选修5:有机化学基础] (30分) 20 (A) (20 分)已知(X代表卤素原子,R代表烃基) 利用上述信息,按以下步骤从合成H 。 (部分试剂和反应条件已略去) 请回答下列问题: (1)分别写出下列物质的结构简式: B_____________,D_______________,E_____________; (2)反应①~⑦中,属于消去反应的是_____________ (填反应数字代号,下同),属于加成反应的是_______________, 属于取代反应的是_____________; (3)反应④的条件为______________, 反应⑦的条件为______________; (4)如果不考虑⑥、⑦反应,对于反应⑤,得到的 E可能的结构简式为______________。 20 (B) (10 分)有机物A(C4H10O)可用作增塑剂、溶剂等。A可以发生如下转化。 已知:R1-CH=CH- R2 R1-CHO+ R2-CHO (1)按官能团分类,A属于_________。 (2) A→B的反应类型是_________。 (3) A→C的转化中Na的作用是_________。 (4)写出A- +D的化学方程式:_________。 (5) F的结构简式是________________________。 [277102]-内蒙古赤峰市2019-2020学年高二下学期期末联考化学试题(B卷)参考答案 1-5:BCCBC 6-10:CCBAB 11-15:CCBCB 二、必做题:(25 分) 16. (14分,每空2分) (1) CO32-+H2OHCO3-+OH-,随温度升高,水解平衡右移,c(OH-)增大,碱性增强,故溶液的红色加深 (2) Fe3++ 3H2OFe(OH)3(胶体)+3H+ (3) Al3++3HCO3-=Al(OH)3↓+ 3CO2↑ (4) 4×10-5 (5) 3 (6) 4×10-4 17. (5分,每空1分) (1)铜(1分);硫酸铜或氯化铜溶液(1分) (2)NaCl (1 分),2NaCl+2H2O2NaOH+H2↑+Cl2↑ (2分) 18. (6分, 每空1分) (1) 0.03 mol/ (Lmin); (2) 2.0,20; (3) >; (4) 放热。 三、选做题(30分) 19、[化学- -选修 3:物质结构与性质](30分) 19(A).(20分) (1) Al>Mg>Na (2分) (2)①sp3(2分) ②极性键(2分),非极性键(2分) ③分子间存在氢键(2分) ④四面体结构(2分),V 形(2分) (3) ①b(2分);②+6(2分);③1s22s2p63s23p63d9或[Ar]3d9 (2分) 19(B).(10分) (1) 120°(2分), sp2(2分);正四面体(2分) (2)共价键(或极性共价键)(2 分);分 子间作用力(2分) 20、[化学-选修5:有机化学基础] (30 分) 20(A).(20分) (1) (1分); (1分); (1分); (1分) (2)②④(2分);①③⑤⑥(2分);⑦(2分) (3)NaOH 的醇溶液、加热(2 分);NaOH水溶液、加热(2 分); (2分) (4) (2分)、 (2分)、(2分) 20(B).(10分) (1)醇(2分) (2) 取代反应(2分) (3)还原剂(2 分) (4) (2分) ; (5) (2分)查看更多