2017-2018学年江苏省启东中学高二上学期期中考试化学(选修)试题 解析版
江苏省启东中学2017-2018学年高二上学期期中考试
化学(选修)试题
(测试时间100分钟,满分120分)
选 择 题 ( 共 40 分 )
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1. 下列热化学方程式正确的是(△H的绝对值均正确)
A. S(s)+O2(g)= SO2(g);△H=-269.8kJ/mol(反应热)
B. NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C. C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
D. 2NO2 = 2NO + O2;△H = +116.2kJ/mol(反应热)
【答案】A
【解析】A、硫的燃烧是放热反应,因此△H<0,热化学反应方程式应体现物质的状态,故A正确;B、中和热是放热反应,即△H=-57.3kJ·mol-1,故B错误;C、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H2O应是液态,故C错误;D、没有体现出物质的状态,故D错误。
2. 将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A. 4 s内,υ(B)=0.075 mol/(L ·s)
B. 当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应达到平衡状态
C. 达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D. 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
【答案】A
【解析】2A(g) + B(g)2C(g)
初n: 4 mol 2 mol 0
△n: 1.2 mol 0.6 mol 1.2 mol
4s时n: 2.8mol 1.4 mol 1.2mol
B:三者浓度符合系数比,只是一个特例,与反应是否为平衡状态无关;C:升温平衡左移,C的浓度减少;D:缩小容器体积,相当于加压,平衡右移,则A的转化率增大。
3. 下列说法正确的是
A. 向蒸馏水中滴加浓H2SO4时,KW不变
B. 常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C. Na2CO3水解的离子方程式为:CO32- + 2H2OH2CO3 + 2OH-
D. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
【答案】B
【解析】试题分析:A项向蒸馏水中滴加浓H2SO4时,溶液的温度升高,KW增大,错误;B项常温下,0.005mol·L-1Ba(OH)2溶液的c(OH-)=0.01mol·L-1,pH=12,正确;C项Na2CO3水解的离子方程式应该为:CO32-+ H2OHCO3-+OH-,错误;D项在CH3COONH4溶液中CH3COO-、NH4+均水解,且水解的程度相当,溶液显中性,但水的电离程度增大,错误。
考点:考查电解质溶液原理。
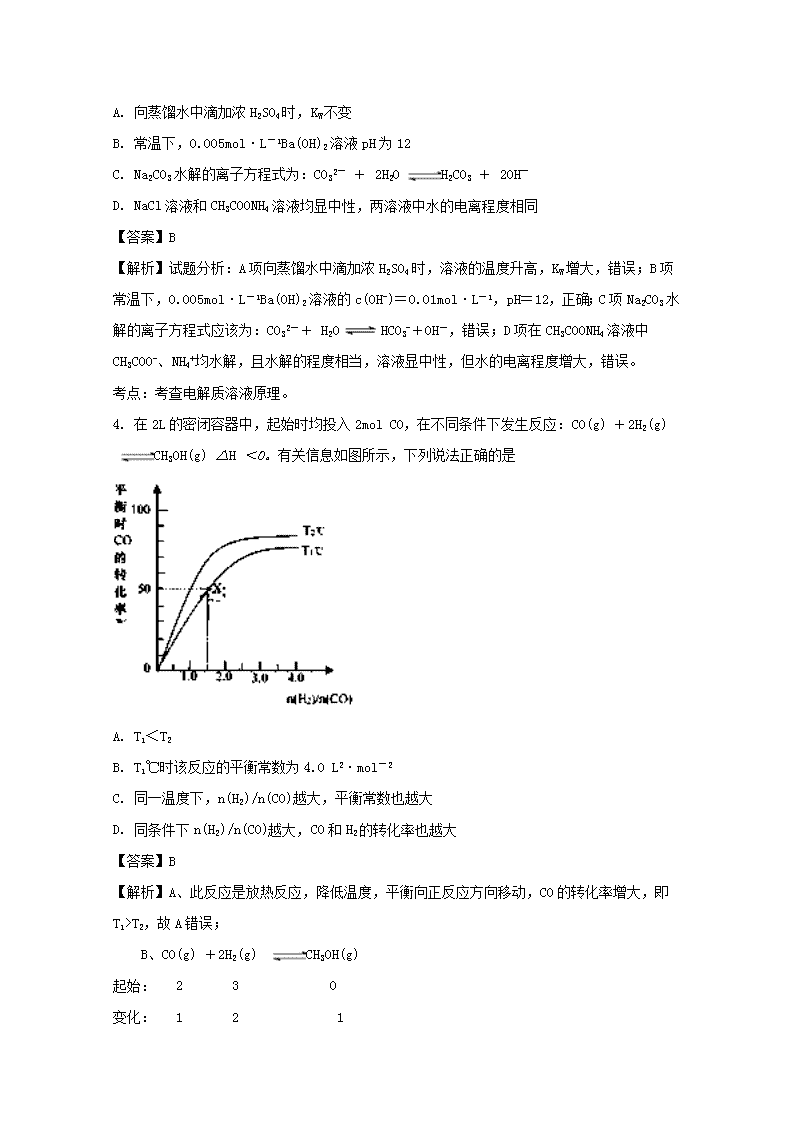
4. 在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g) +2H2(g) CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
A. T1<T2
B. T1℃时该反应的平衡常数为4.0 L2·mol-2
C. 同一温度下,n(H2)/n(CO)越大,平衡常数也越大
D. 同条件下n(H2)/n(CO)越大,CO和H2的转化率也越大
【答案】B
【解析】A、此反应是放热反应,降低温度,平衡向正反应方向移动,CO的转化率增大,即T1>T2,故A错误;
B、CO(g) +2H2(g) CH3OH(g)
起始: 2 3 0
变化: 1 2 1
..................
5. 下列说法正确的是
A. 任何中和反应生成1 mol H2O,能量变化均相同
B. 同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同
C. 已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1, 则a>b
D. 已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石)△H= + 1.5 kJ·mol-1。
【答案】D
【解析】浓酸、弱酸等发生酸碱中和时中和热不同;生成液态水放出更多,故-b<-a,即b>a。反应热大小与条件无关,D项利用盖斯定律可求算。
6. 下列各组离子在指定环境中一定能大量共存的是
A. 碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-
B. 较多Fe3+的溶液中:Na+、SCN-、SO42-、K+
C. 常温下由水电离出的c(H+)·c(OH-)=10-24溶液中:Cl-、CO32-、NH4+、F-
D. 在能使pH试纸变深蓝色的溶液中:Na+ 、S2- 、CO32-、NO3-
【答案】D
【解析】A、HCO3-与Al3+发生双水解反应,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,因此不能 这些离子在碳酸氢钠溶液中不能大量共存,故A错误;B、Fe3+和SCN-发生络合反应,因此不能大量共存,故B错误;C、常温下,水电离出c(H+)×c(OH-)=10-24,说明此溶液中溶质对水的电离产生抑制,即此溶质可能是酸,也可能是碱,在酸中H+和CO32-不能大量共存,产生CO2气体,H+与F-不能大量共存,生成弱电解质HF,在碱中,NH4+和OH-不能大量共存,生成NH3·H2O,因此这些离子不能大量共存,故C错误;D、能使pH试纸变深蓝色,说明此溶液为强碱,这些离子在碱中能够大量共存,故D正确。
7. 下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红;
②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A. ①②③④ B. ②③④ C. ③④ D. ②④
【答案】C
【解析】试题分析:①只能说明溶液呈碱性,不能说明一水合氨是强碱还是弱碱,故错误;②只能说明溶液中离子浓度很小,不能说明电解质的强弱,故错误;③说明氯化铵是强酸弱碱盐,故一水合氨是弱碱;④能说明氨水中还有未电离的一水合氨,故是弱碱;故选C。
考点:弱电解质的电离和盐的水解
8. 下列有关反应热的说法正确的是
A. 在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量
B. 甲烷标准燃烧热△H=-890kJ/mol,则:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
C. 已知常温常压下HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol,则有H2SO4+Ba(OH)2=BaSO4+2H2O △H=-114.6kJ/mol
D. 已知S(s)+O2(g) =SO2(g) △H=-Q1kJ/mol,S(g)+O2(g) =SO2(g) △H=-Q2kJ/mol,则Q1
c(Na+)>C(OH-)>C(H+)
D. 加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
【答案】A
【解析】试题分析:pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,CH3COOH过量,溶液显酸性,故A项有可能。等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合后生成CH3COONa水解显碱性,B项不可能。C选项不符合电荷守恒,故不可能。加入适量氨水后的溶液中电荷守恒关系为:c(Na+)+c(NH)+c(H+)=c(OH-)+c(CH3COO-)因为此时溶液酸碱性未知,故不能判断c(H+)与c(OH-)的相对大小,即不能判断c(CH3COO-)与c(Na+)和c(NH4+)之和的大小关系。
考点:离子浓度大小比较
14. 常温下,0.1mol·L-1NH4HCO3溶液的pH=7.8,该溶液中微粒浓度间关系正确的是
A. c(OH-)>c(H+)
B. c(HCO3-)>c(NH4+)
C. c(NH4+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-)
D. c(H2CO3) + c(H+) = c(CO32-) + 2c(NH3·H2O) + c(OH-)
【答案】AC
【解析】A、溶液的pH=7.8,说明溶液显碱性,即c(OH-)>c(H+),故A正确;B、NH4HCO3属于弱酸弱碱盐,溶液显碱性,说明HCO3-的水解程度大于NH4+的水解程度,即c(NH4+>c(HCO3-),故B错误;C、依据电荷守恒,故C正确;D、电荷守恒:c(NH4+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-),物料守恒:c(NH3·H2O)+c(NH4+)=c(HCO3-)+c(H2CO3)+c(CO32-),两式相减得到:c(NH3·H2O)+c(CO32-)+c(OH-)=c(H2CO3)+c(H+),故D错误。
点睛:离子浓度大小比较,是选修四的重点和难点,(1)注意两大理论,①电离理论,弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,②水解理论,弱离子水解程度是微弱,多元弱酸根离子的水解是分步进行的,其主要是第一步水解为主;(2)注意三个守恒,①电荷守恒,注重溶液呈电中性,特别是系数,带有多少电荷,系数为几;②物料守恒,注重溶液中某元素的原子守恒;③质子守恒,注重分子或离子得失H+数目,一般是通过电荷守恒、物料守恒相加减得到。
15. 一定温度时,1L密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ/mol,数据:
反应时间/min
n(SO2)/mol
n(O2)/mol
0
2
1
5
1.2
10
0.4
15
0.8
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L−1 min−1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.1molO2时,v (正)> v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
【答案】AD
【解析】根据表格数据,完成表格其余空格,
反应时间/min
n(SO2)/mol
n(O2)/mol
0
2
1
5
1.2
0.6
10
0.8
0.4
15
0.8
0.4
A、根据化学反应速率的数学表达式,前5min的平均速率v(SO2)=(2-1.2)/(5×1)mol/(L·min)=0.16 mol/(L·min),故A说法错误;B、此温度下的化学平衡常数,K= ,达到平衡时c(SO3)=1.2mol·L-1,c(SO2)=0.8mol·L-1,c(O2)=0.4mol·L-1,代数数值,求的K=5.625,达到平衡后再充入0.2molSO2和0.1molO2,此时浓度商Qc=2.88v(逆),故B说法正确;C、其他条件保持不变,起始时充入2molSO3,建立平衡后,与原平衡为等效平衡,即SO3的转化率为40%,则达到平衡吸收的热量为196×2×40%/2kJ=78.4kJ,故C说法正确;D、如果为恒压条件,充入1.5molSO3,与原平衡为等效平衡,SO3的转化率为40%,如果为恒容状态,则不与原平衡为等效平衡,SO3的转化率不等于40%,应小于40%,故D错误。
非 选 择 题 (共 80 分 )
16. (1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________。
②假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
【答案】 (1). 1.88×10-4 mol/(L·s) (2). C、D (3). -41.8 (4). b (5). 8/3 (6). <
NO2(g)+SO2(g)SO3(g)+NO(g)
起始: 1 2 0 0
变化: x x x x
平衡: 1-x 2-x x x,根据信息,测的上述反应平衡时NO2和SO2的体积比为1:6,相同条件下,体积比等于物质的量之比,即(1-x):(2-x) =1:6,解得x=4/5,平衡常数K= ,代入数值,解得K=8/3;(3)考查勒夏特列原理,等压下,温度越高,CO的转化率降低,根据勒夏特列原理,升高温度,平衡向逆反应方向移动,即△H<0。
点睛:化学平衡状态的判定是化学平衡中常见的问题,一般采用“两审、两标志”;(1
)一审题干条件,是恒温恒容还是恒温恒压,二审:①全部是气体参与的等体积反应还是非等体积反应,②有固体或液体参与的等体积反应还是非等体积反应;(2)两标志:①本质标志,v正=v逆,对应某一可逆反应来说,正反应消耗掉某反应物的速率等于逆反应生成物该反应物的速率,即用不同物质的反应速率表示,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比;②等价标志,a、全部是气体参加的非等体积反应,体系的压强、平均相对分子质量不再随时间而变化;b、体系中各组分的物质的量浓度、体积分数、物质的量分数保持不变;c、对同一物质而言,断裂的化学键的物质的量与形成的化学键物质的量相等;d、气体颜色,当组分中存在有颜色的气体时,气体颜色不变,说明反应达到平衡。
17. 已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水_____(填“吸收”或“放出”)的能量是________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________;
(3)在2L的密闭容器中,合成甲醇反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
(A、B曲线分别对应T1、T2)
①T1_____T2(填“>”或“ <”)。
②该反应为_____热反应。
③该反应在T1时的平衡常数比T2时的____(填“大”或“小”)。
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)_____。
⑤在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________。
【答案】 (1). 吸收 (2). 2858 (3). CH3OH(l) +O2(g)=CO(g)+2 H2O(l) △H=-443.5kJ·mol-1 (4). < (5). 放 (6). 大 (7). 增大 (8). 1-a/2
【解析】(1)本题考查考查反应热,水的分解是吸热反应,因此分解10mol水需要吸收能量,根据信息氢气的燃烧热,消耗1molH2,即生成生成1mol水时放出的热量为285.8kJ
,因此分解10molH2O时吸收的能量是10×285.8kJ=2858kJ;(2)考查热化学反应方程式的书写,①CO燃烧热的热化学反应方程式:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1,②CH3OH燃烧热的热化学反应方程式:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1, 甲醇不完全燃烧生成液态水的化学反应方程式为:CH3OH+O2=CO+2H2O,②-①得出△H=(-726.5+283.0)kJ·mol-1=-443.5kJ·mol-1,CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443.5kJ·mol-1;(3)考查勒夏特列原理、化学平衡的计算,①T2先达到平衡平衡,说明T2温度下的反应速率快,即T2>T1;②根据图像,温度越高,甲醇的物质的量越低,根据勒夏特列原理,正反应是放热反应;③此反应是放热反应,且T2>T1,因此T1的平衡常数比T2的平衡常数大;④T1到T2甲醇的物质的量降低,升高温度,平衡向逆反应方向进行,氢气的量增大,此比值增大; ⑤根据CO2(g)+3H2(g)CH3OH(g)+H2O(g),反应后气体物质的量减少2mol,因此消耗1×amolCO2,物质的量减少2amol,即反应后气体物质的量为(4-2a)mol,同条件下,压强之比等于物质的量之比,即(4-2a):4=(2-a)/2。
点睛:勒夏特列原理是化学平衡移动考查中的重点,要熟悉勒夏特列原理的定义:改变某一因素,平衡影响这一因素的方向进行移动,如本题的(3)中的②,T2先达到平衡,说明T2>T1,根据图像,温度升高,甲醇的物质的量降低,说明升高温度,平衡向消耗甲醇的方向移动,即正反应是放热反应。
18. (1)某温度(t℃)时,水的离子积为KW=1.0×10﹣13mol2•L﹣2,则该温度(填“大于”、“小于”或“等于”)_____25℃,其理由是________________________________。
(2)若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计). 若所得混合液为中性,则a:b=_____;此溶液中各种离子的浓度由大到小排列顺序是_________________。
(3)FeCl3的水溶液呈酸性的原因是(用离子方程式表示):______________。
(4)实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以__ (填“促进”、“抑制”)其水解。
(5)把氯化铝溶液蒸干并灼烧固体产物是______。
【答案】 (1). 大于 (2). 水的电离是吸热过程,升高温度促进水电离,则水的离子积常数增大,某温度(T℃)时,水的离子积常数Kw=1×10-13>10-14,则该温度大于25℃ (3). a:b=10:1 (4). c(Na+)>c(SO4 2-)>c(H+)=c(OH-) (5). Fe3++3H2OFe(OH)3+3H+ (6). 抑制 (7). Al2O3
【解析】(1)本题考查水的离子积,常温下水的离子积为10-14
,水水的离子积只受温度的影响,的电离是吸热过程,温度升高,促进水的电离,水的离子积增大,即该温度大于25℃;(2)考查离子浓度大小的比较、溶液的酸碱性的判断,此温度水的离子积为10-13,因此NaOH中c(OH-)=10-13/10-11mol·L-1=10-2mol·L-1,此温度下溶液显中性,说明NaOH中n(OH-)等于硫酸中n(H+),a×10-2=b×10-1,解得a:b=10:1,氢氧化钠和硫酸都是强电解质,溶液显中性,溶质为Na2SO4,因此离子浓度大小顺序是c(Na+)>c(SO42-)>c(H+)=c(OH-);(3)考查盐类水解原理的应用,FeCl3属于强酸弱碱盐,Fe3+发生水解,即Fe3++3H2O Fe(OH)3+3H+;(4)考查影响盐类水解因素,根据(3),加入盐酸H+浓度增大,平衡向逆反应方向进行,即溶于较浓的盐酸中目的是抑制Fe3+的水解;(5)考查盐类水解原理的应用,AlCl3的水解:AlCl3+3H2O Al(OH)3+3HCl,盐类水解是吸热反应,升高温度,促进水解,HCl易挥发,蒸干得到Al(OH)3,因为氢氧化铝不稳定,受热易分解,因此灼烧得到固体产物是氧化铝。
19. 常温下,将某一元碱BOH和HCl溶液等体积混合,两溶液浓度和混合溶液pH如下表:
实验编号
HCl的物质的量浓度(mol·L-1)
BOH的物质的量浓度(mol·L-1)
混合溶液pH
①
0.1
0.1
pH=5
②
c
0.2
pH=7
③
0.1
0.2
pH>7
请回答:
(1)从第①组情况分析,BOH是___(选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的c(OH—)=____mol·L-1。
(2)第②组情况表明,c____0.2。该混合液中离子浓度c(B+)____c(Cl-)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中(选填“<”、“>”或“=”)。
甲:BOH的电离程度____BCl的水解程度。
乙:c(B+)-2 c (OH—)____c(BOH)-2 c(H+)。
【答案】 (1). 弱碱 (2). 1×10—5 (3). < (4). = (5). > (6). =
【解析】试题分析:(1)①中酸和碱恰好完全反应生成盐,盐溶液水解显酸性,故为强酸弱碱盐,所以BOH为弱碱,盐的水解促进了水的电离,盐溶液中的氢离子均是水电离出的,c(H+)=10-5mol/L,故由水电离出的氢离子等于由水电离出的氢氧根离子,故由水电离出的c(OH—)=10-5mol/L;(2)恰好完全反应时溶液显酸性,现溶液显中性,说明碱过量,故酸的浓度小于0.2mol/L;根据电荷守恒c(B+)+c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-),故c(B+)=c(Cl—);(3)反应后溶液中BOH和BCl的浓度相等,溶液显碱性,说明碱的电离程度大于盐的水解程度;溶液中存在电荷守恒C(H+)+C(B+)=C(OH-)+C(Cl-),根据物料守恒得c(B+)+c(BOH)=2C(Cl-),将电荷守恒关系式两边同时乘以2,用c(B+)-2c (OH-)将2c(Cl-)替换得c(B+)-2c (OH-)=c(BOH)-2c(H+)。
考点:酸碱混合时的判断、离子浓度的比较、pH的判断、盐的水解等知识。
20. 氯气溶于水,Cl2约有三分之一与水反应生成盐酸与次氯酸。请回答下列问题:
(1)该可逆反应的离子方程式为__________________。
(2)氯气____溶于饱和食盐水,其原因是增大了上述平衡中的_____浓度,平衡向___反应方向移动。
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______反应方向移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向_______反应方向移动。
【答案】 (1). Cl2+H2OH++Cl-+HClO (2). 难或不 (3). Cl- (4). 逆 (5). 正 (6). 增大 (7). 正
【解析】(1)本题考查氯气与水的反应,氯气与水反应的离子方程式为Cl2+H2O H++Cl-+HClO;(2)考查影响化学平衡的因素,Cl2+H2O H++Cl-+HclO,加入饱和食盐水,增加c(Cl-),平衡向逆反应方向移动,因此氯气难溶于饱和食盐水;(3)考查影响化学平衡移动的因素,加入氢氧化钠溶液,OH-+H+=H2O,消耗H+,平衡向正反应方向移动;(4)考查影响化学平衡移动的因素,增大压强,平衡向体积减小的方向进行,即增大压强,平衡向正反应方向移动,氯气在水中的溶解度将增大。
21. 下图中A、B、C、D分别为AlCl3、NaOH、NH4HSO4、Na2CO3溶液,实验过程和记录如下图所示(无关物质已经略去):
请回答:
(1)W的溶液加热蒸干并灼烧最后所得固体为__________。
(2)D溶液pH___(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)_______。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是_________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者_____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是____。
【答案】 (1). NaAlO2 (2). 大于 (3). CO32-+H2OHCO3-+OH- (4). NaOH>Na2CO3>AlCl3>NH4HSO4 (5). > (6). c(Na+)> c (SO42-)> c (NH4+)> c (H+) =C(OH-)
【解析】本题考查盐类水解、离子浓度大小顺序,A和B按1:3混合,发生Al3++3OH-=Al(OH)3↓,即X为氢氧化铝沉淀,再加入B溶液,按1:1混合,发生Al(OH)3+OH-=AlO2-+2H2O,即W的溶液为NaAlO2,B和C,B过量且加热,发生NH4++OH-NH3↑+H2O,C和D按2:1混合,发生2H++CO32-=CO2↑+H2O,即Z为CO2,(1)根据上述分析,W为NaAlO2,AlO2-+2H2OAl(OH)3+OH-,盐类水解属于吸热反应,升高温度,促进水解,但NaOH属于难挥发性碱,因此加热蒸干并灼烧最后得到固体是NaAlO2;(2)D为Na2CO3,碳酸钠属于强碱弱酸盐,CO32-发生水解,存在CO32-+H2OHCO3-+OH-,造成溶液中c(OH-)>c(H+),溶液显碱性,即pH>7;(3)AlCl3、NH4HSO4溶液显酸性,AlCl3溶液显碱性是因为是Al3+水解造成,NH4HSO4溶液显酸性,发生NH4HSO4=NH4++H++SO42-,相同浓度时,NH4HSO4中c(H+)大于AlCl3溶液中c(H+),即pH大小顺序是c(NH4HSO4)c(Na2CO3),因此pH由大到小顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;(4)NH4Cl溶液中存在:NH4++H2O NH3·H2O+H+,NH4HSO4相当于在NH4Cl溶液中加入H+,抑制NH4+
水解,因此NH4HSO4溶液中c(NH4+)大于NH4Cl溶液中c(NH4+);(5)NaOH和NH4HSO4混合,OH-先中和HSO4-中H+,当两者恰好完全反应,溶质为Na2SO4和(NH4)2SO4,溶液显酸性,根据题意,溶液为中性,因此继续滴加NaOH,发生NH4++OH=NH3·H2O,当pH=7时,溶质为Na2SO4、(NH4)2SO4、NH3·H2O,因此离子浓度大小顺序是:c(Na+)> c (SO42-)> c (NH4+)> c (H+) =c(OH-)。
点睛:离子浓度大小比较是本题的难点,以(5)为例进行分析,NH4HSO4=NH4++H++SO42-,滴加氢氧化钠溶液,先发生H++OH-=H2O,当把H+全部中和时,Na+的物质的量等于SO42-的物质的量,此时溶质为Na2SO4和(NH4)2SO4,硫酸铵的水溶液显酸性,但题目中要求溶液显酸性,因此继续滴加NaOH,发生NH4++OH-=NH3·H2O,直到溶液显中性,因此c(Na+)>c(SO42-),因为NH4+发生水解,因此c(SO42-)>c(NH4+),溶液显中性,c(H+)=c(OH-),水解的程度微弱,因此离子浓度大小顺序是c(Na+)> c (SO42-)> c (NH4+)> c (H+) =c(OH-)。