2018届二轮复习盐类的水解和沉淀溶解平衡课件(89张)(全国通用)
专题十二
盐类的水解和沉淀溶解平衡
盐类的水解是历年高考的考查热点
,
而沉淀溶解平衡则是实施新课标以来的新增考点
,
几乎每年必考
,
而且难度一般在中等偏上的水平
,
是许多考生的失分点。在复习本专题时
,
有以下几点心得
:
(1)
要运用化学平衡移动原理分析盐类水解的应用
,
如纯碱去污、泡沫灭火器的灭火原理、明矾净水、胶体的制备、物质除杂等。
(2)
注意理解盐类水解的实质及影响因素
,
抓住盐类水解一般程度较小这一特点
,
结合电荷守恒、物料守恒、质子守恒的关系
,
分析、判断溶液中离子浓度的大小关系。
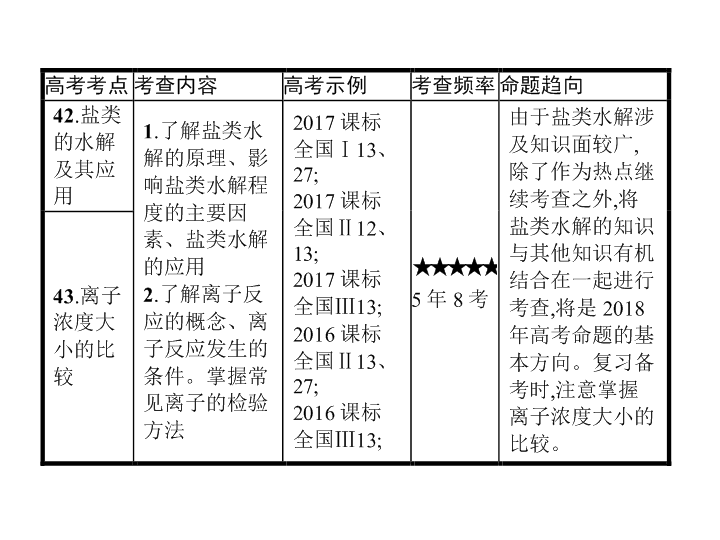
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
1
.(2009
课标全国
Ⅱ
,10)
现有等浓度的下列溶液
:
①
醋酸
,
②
苯酚
,
③
苯酚钠
,
④
碳酸
,
⑤
碳酸钠
,
⑥
碳酸氢钠。按溶液
pH
由小到大排列正确的是
(
)
A.
④①②⑤⑥③
B.
④①②⑥⑤③
C.
①④②⑥③⑤
D.
①④②③⑥⑤
【答案】
C
此题应按照强酸
—
弱酸
—
水解显酸性的盐
—
中性的盐
—
水解显碱性的盐
—
弱碱
—
强碱的顺序将各物质进行排列
;
由于酸性
:
碳酸
>
苯酚
>
碳酸氢钠
,
则有碱性
:
碳酸氢钠溶液
<
苯酚钠溶液
<
碳酸钠溶液
,
由以上分析可推知答案。
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
2
.(2015
天津
,5)
室温下
,
将
0.05 mol Na
2
CO
3
固体溶于水配成
100 mL
溶液
,
向溶液中加入下列物质
,
有关结论正确的是
(
)
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
【答案】
B
0.05
mol
的
Na
2
CO
3
中加入
50
mL
1
mol·L
-1
H
2
SO
4
溶
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
3
.(2014
福建
,10)
下列关于
0.10 mol·L
-1
NaHCO
3
溶液的说法正确的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.
盐类水解及其规律
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.
表示方法
——
水解离子方程式
(1)
一般来说
,
盐类水解的程度不大
,
应该用可逆号
“ ”
表示。盐类水解一般不会产生沉淀和气体
,
所以不用符号
“↓”
和
“↑”
表示水解产物。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
(3)
多元弱碱阳离子的水解简化成一步完成
,
如
FeCl
3
水解
:
总之
,
水解离子方程式的书写规律为
:
谁弱写谁
,
都弱都写
;
阳离子水解生成
弱
碱
,
阴离子水解生成
弱
酸。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
3
.
影响盐类水解的因素
(1)
内因
:
生成的弱酸或弱碱越弱
,
其对应离子的水解程度
越大
,
溶液的碱性或酸性
越强
。
(2)
外因
:
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
4
.
盐类水解的应用
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
5
.
盐溶液蒸干、灼烧时所得产物的判断
(1)
盐水解生成难挥发性酸时
,
蒸干后一般得原物质
,
如
(2)
盐水解生成易挥发性酸时
,
蒸干灼烧后一般得对应的氧化物
,
如
(3)
酸根阴离子易水解的强碱盐
,
如
Na
2
CO
3
溶液等蒸干后可得到原溶质。
(4)
考虑盐受热时是否分解。
(5)
还原性盐在蒸干过程中会被
O
2
氧化。例如
Na
2
SO
3
(aq) Na
2
SO
4
(s)
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【疑难辨析】
(1)
水解平衡右移
,
盐的水解程度不一定增大。如加水稀释时
,
水解平衡右移
,
水解程度增大
,
但增大盐的浓度
,
平衡也右移
,
水解程度却是减小。
(2)AlCl
3
溶液和
Al
2
(SO
4
)
3
溶液加热、蒸发、浓缩、结晶、灼烧
,
所得固体的成分类型不同。
AlCl
3
与
Al
2
(SO
4
)
3
的水解方程式分别为
2Al(OH)
3
+3H
2
SO
4
,
加热促进水解
,
由于盐酸为挥发性酸
,
硫酸为难挥发性酸
,
故前者最终产物为
Al
2
O
3
,
后者最终产物为
Al
2
(SO
4
)
3
。
(3)
为了增大产生
CO
2
的速率
,
泡沫灭火器中常使用的是
NaHCO
3
溶液和
Al
2
(SO
4
)
3
溶液
,
而不是
Na
2
CO
3
溶液和
Al
2
(SO
4
)
3
溶液。
(4)
配制
FeCl
2
溶液要加入铁粉
,
配制
FeCl
3
溶液要加入盐酸
,
二者原理不同。加入
Fe
粉是为了防止
Fe
2+
被氧化
,
加入盐酸是为了抑制
Fe
3+
的水解。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
典例导引
(2017
河南开封模拟
)25
℃
时
,0.1 mol·L
-1
下列溶液的
pH
如表所示
,
有关比较错误的是
(
)
A.
酸的强度
:HF>H
2
CO
3
B.
水的电离程度
:
①
=
②
C.
溶液中离子的总浓度
:
①
>
②
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
B
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
高招
理解盐类水解规律及其拓展应用
(1)“
谁弱谁水解
,
越弱越水解
”
。如酸性
:HCN
CH
3
COONa
。
(2)
强酸的酸式盐只电离
,
不水解
,
溶液显酸性。
(3)
弱酸的酸式盐溶液的酸碱性
,
取决于酸式酸根离子的电离程度和水解程度的相对大小。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
(4)
由于多元弱酸的逐级电离常数依次减小
,
故多元弱酸正盐的水解程度大于相应的酸式盐。如相同物质的量浓度的
Na
2
CO
3
溶液比
NaHCO
3
溶液碱性强。
(5)
一般来说
,
水解程度
:
相互促进水解的盐
>
单独水解的盐
>
水解相互抑制的盐。如相同物质的量浓度的盐溶液
,
水解程度
:(NH
4
)
2
CO
3
>(NH
4
)
2
SO
4
>(NH
4
)
2
Fe(SO
4
)
2
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.(2017
湖南百所重点中学诊断
)
下列有关电解质溶液的说法不正确的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
D
在一定条件下
,Na
2
CO
3
溶液中存在水解平衡
:
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(2017
江苏盐城一模
)
下列说法错误的是
(
)
A.
实验室配制
FeCl
3
溶液时
,
需将
FeCl
3
(s)
溶解在较浓盐酸中
,
然后加水稀释
B.0.1 mol·L
-1
Na
2
CO
3
溶液中
c
(OH
-
)
是
0.1 mol·L
-1
NaHCO
3
溶液中
c
(OH
-
)
的
2
倍
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
B
氯化铁水解显酸性
,
将氯化铁溶解在盐酸中
,
能抑制其
体
NaOH,NaOH
中和乙酸
,
导致乙酸浓度降低
,
平衡右移
,
故乙酸甲酯的水解转化率增大
,D
正确。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
3
.(2017
江西南昌模拟
)
在一定条件下
,Na
2
CO
3
溶液中存在水解平衡
:
B.
升高温度
,
溶液
pH
减小
C.
稀释溶液
,
溶液中所有离子浓度都减小
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
>
c
(H
+
),
故
A
正确
;
水解反应是吸热反应
,
升温可以促进水解平衡正向移动
,
氢氧根离子浓度增大
,
氢离子浓度减小
,
溶液
pH
增大
,
故
B
错误
;
稀释溶液
,
水的离子积常数不变
,
溶液中氢氧根离子浓度减小
,
氢离子浓度增大
,
故
C
错误
;
加入的
Ba(OH)
2
固体溶解后
,
钡离子和碳酸根离子结合生成碳酸钡沉淀
,
溶液中碳酸根离子浓度减小
,
故
D
错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
离子浓度大小的比较
1
.(2014
课标全国
Ⅱ
,11)
一定温度下
,
下列溶液的离子浓度关系式正确的是
(
)
A.pH=5
的
H
2
S
溶液中
,
c
(H
+
)=
c
(HS
-
)=1×10
-5
mol·L
-1
B.
将
pH=
a
的氨水稀释
10
倍后
,
其
pH=
b
,
则
a
=
b
+1
C.pH=2
的
H
2
C
2
O
4
溶液与
pH=12
的
NaOH
溶液以任意比例混合
:
c
(Na
+
)+
c
(H
+
)=
c
(OH
-
)+
D.pH
相同的
①
CH
3
COONa
②
NaHCO
3
③
NaClO
三种溶液中的
c
(Na
+
):
①
>
②
>
③
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
D
H
2
S
在水溶液中存在两步电离
,
c
(H
+
)=1×10
-5
mol·L
-1
>
c
(HS
-
),A
项错误
;
一水合氨是弱电解质
,
加水稀释时其电离平衡正向移动
,
c
(OH
-
)
减小程度小于
10
倍
,
即
a<
(
b
+1),B
项错误
;
根据电荷守
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(2015
安徽
,13)25
℃
时
,
在
10 mL
浓度均为
0.1 mol·L
-1
的
NaOH
和
NH
3
·H
2
O
混合溶液中滴加
0.1 mol·L
-1
盐酸
,
下列有关溶液中粒子浓度关系正确的是
(
)
A.
未加盐酸时
:
c
(OH
-
)>
c
(Na
+
)=
c
(NH
3
·H
2
O)
C.
加入盐酸至溶液
pH=7
时
:
c
(Cl
-
)=
c
(Na
+
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.“
一个比较
”
比较同浓度的弱酸
(
或弱碱
)
的电离能力与对应的强碱弱酸盐
(
或强酸弱碱盐
)
的水解能力。
(1)
如果是
电离能力大于水解能力
,
如
CH
3
COOH
的电离程度大于
CH
3
COO
-
水解的程度
,
则等浓度的
CH
3
COOH
与
CH
3
COONa
溶液等体积混合后
溶液显酸性
。
(2)
如果是
水解能力大于电离能力
,
如
HClO
的电离程度小于
ClO
-
水解的程度
,
则等浓度的
HClO
与
NaClO
溶液等体积混合后
溶液显碱性
。
(3)
酸式盐溶液的酸碱性主要取决于酸式酸根离子电离能力和水解能力的相对强弱
。如
NaHCO
3
溶液显碱性
;NaHSO
3
溶液显酸性。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.“
三个守恒
”
(1)
电荷守恒
电荷守恒是指溶液必须保持电中性
,
即溶液中所有阳离子的正电荷总浓度等于所有阴离子的负电荷总浓度
。如
NaHCO
3
溶液中
:
(2)
物料守恒
物料守恒也就是原子守恒
,
变化前后某种元素的原子个数守恒。如
0.1 mol·L
-1
NaHCO
3
溶液中
:
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
(3)
质子守恒
指由水电离产生的
c
(H
+
)
和
c
(OH
-
)
始终相等
,
溶液中
由水电离产生的
H
+
或
OH
-
虽会被其他离子结合
,
以不同形式存在
,
但其总量始终相等
。
同理可知
,
在
Na
2
S
溶液中
,
c
(OH
-
)=
c
(H
+
)+
c
(HS
-
)+2
c
(H
2
S)
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
典例导引
(2017
湖南怀化质检
)
在
25
℃
时
,
将
0.2 mol CH
3
COONa
晶体和
0.1 mol HCl
气体同时溶于水中制得
1 L
溶液
,
若此溶液中
c
(CH
3
COO
-
)>
c
(Cl
-
),
则下列判断不正确的是
(
)
A.
该溶液的
pH
小于
7
B.
c
(CH
3
COOH)+
c
(CH
3
COO
-
)=0.20 mol·L
-1
C.
c
(CH
3
COOH)<
c
(CH
3
COO
-
)
D.
c
(CH
3
COO
-
)+
c
(OH
-
)=0.10 mol·L
-1
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【解析】
反应后溶液中溶质为
NaCl
、
CH
3
COONa
、
CH
3
COOH,
三者物质的量相等。由于溶液中
c
(CH
3
COO
-
)>
c
(Cl
-
),
故醋酸的电离程度大于
CH
3
COO
-
水解程度
,
即溶液
pH<7,A
项正确
;
根据物料守恒
,
c
(CH
3
COO
-
)+
c
(CH
3
COOH)=0.2
mol·L
-1
,B
项正确
;NaCl
、
CH
3
COONa
、
CH
3
COOH
三者物质的量相等
,
且醋酸的电离程度大于
CH
3
COO
-
水解程度
,
因此
c
(CH
3
COO
-
)>
c
(CH
3
COOH),C
项正确
;
根据电荷守恒
,
即
c
(Na
+
)+
c
(H
+
)=
c
(CH
3
COO
-
)+
c
(OH
-
)+
c
(Cl
-
),
c
(CH
3
COO
-
)+
c
(OH
-
)
=
c
(Na
+
)+
c
(H
+
)-
c
(Cl
-
)=0.1
mol·L
-1
+
c
(H
+
),D
项错误。
【答案】
D
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
高招
比较离子浓度大小的方法
(1)
单一溶液中各离子浓度的比较
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
混合溶液中离子浓度的比较
,
要综合分析电离、水解等因素。如
0.1 mol·L
-1
NH
4
Cl
溶液和
0.1 mol·L
-1
氨水的混合溶液呈碱性
,
各离子浓度大小的顺序为
c
(
)>
c
(Cl
-
)>
c
(OH
-
)>
c
(H
+
)
。
(3)
酸、碱中和型离子浓度的关系
:
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
(4)
不同溶液中同一离子浓度的比较
该类情况要看溶液中其他离子对该离子的影响。如
25
℃
时
,
相同物质的量浓度的下列溶液中
:a.NH
4
Cl
、
b.CH
3
COONH
4
、
c.NH
4
HSO
4
、
d.(NH
4
)
2
SO
4
、
e.(NH
4
)
2
Fe(SO
4
)
2
,
c
( )
由大到小的顺序为
e>d>c>a>b
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.(2016
山东潍坊一模
)
常温下
,
取
0.2 mol·L
-1
HX
溶液与
0.2 mol·L
-1
NaOH
溶液等体积混合
(
忽略混合中溶液体积的变化
),
测得混合溶液的
pH=8,
则对混合溶液的下列说法
(
或关系式
)
正确的是
(
)
A.
c
(Na
+
)-
c
(X
-
)=9.9×10
-7
mol·L
-1
B.
c
(Na
+
)=
c
(X
-
)+
c
(HX)=0.2 mol·L
-1
C.
c
(OH
-
)-
c
(HX)=
c
(H
+
)=1.0×10
-6
mol·L
-1
D.
由水电离出的
c
(OH
-
)=1.0×10
-8
mol·L
-1
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
A
由电荷守恒知
c
(Na
+
)+
c
(H
+
)=
c
(X
-
)+
c
(OH
-
),
c
(Na
+
)-
c
(X
-
)=
c
(OH
-
)-
c
(H
+
)=1.0×10
-6
mol·L
-1
-1.0×10
-8
mol·L
-1
=9.9×10
-7
mol·L
-1
,A
正确
;0.2
mol·L
-1
HX
溶液与
0.2
mol·L
-1
NaOH
溶液等体积混合恰好完全反应生成
NaX,X
-
水解使溶液呈碱性
,
由物料守恒知
c
(Na
+
)=
c
(X
-
)+
c
(HX)=0.1
mol·L
-1
,B
错误
;
由质子守恒
,
c
(OH
-
)=
c
(H
+
)+
c
(HX),
则
c
(OH
-
)-
c
(HX)=
c
(H
+
)=1.0×10
-8
mol·L
-1
,C
错误
;
混合溶液为
NaX
溶液
,
水解时盐溶液中
c
(OH
-
)
即水电离出的
c
(OH
-
),
等于
1.0×10
-6
mol·L
-1
,D
错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(2017
黑龙江大庆二模
)25
℃
时
,
在
10 mL
浓度均为
0.1 mol·L
-1
的盐酸和醋酸混合溶液中滴加
0.1 mol·L
-1
NaOH
溶液
,
下列有关溶液中离子浓度关系正确的是
(
)
A.
未加
NaOH
溶液时
,
c
(H
+
)>
c
(Cl
-
)=
c
(CH
3
COOH)
B.
加入
10 mL NaOH
溶液时
:
c
(CH
3
COO
-
)+
c
(OH
-
)=
c
(H
+
)
C.
加入
NaOH
溶液至
pH=7
时
:
c
(Na
+
)=
c
(Cl
-
)
D.
加入
20 mL NaOH
溶液时
:
c
(Na
+
)=
c
(CH
3
COO
-
)+
c
(Cl
-
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
B
未加
NaOH
溶液时
,
混合溶液中
HCl
完全电离
,CH
3
COOH
仅部分电离
,
由于原浓度均为
0.1
mol·L
-1
,
所以
c
(H
+
)>
c
(Cl
-
)>
c
(CH
3
COOH),A
项错误
;
加入
10
mL
0.1
mol·L
-1
NaOH
溶液时
,HCl
恰好完全反应生成
0.001
mol
NaCl,
还存在
0.001
mol
CH
3
COOH,
根据电荷守恒得
c
(Na
+
)+
c
(H
+
)=
c
(Cl
-
)+
c
(CH
3
COO
-
)+
c
(OH
-
),
由于
c
(Na
+
)=
c
(Cl
-
),
所以
c
(H
+
)=
c
(CH
3
COO
-
)+
c
(OH
-
),B
项正确
;
加入
10
mL
NaOH
溶液时
,
得到
NaCl
与
CH
3
COOH
等物质的量的混合物
,
由于
CH
3
COOH
的电离使溶液呈酸性
,
所以需要再加部分
NaOH
溶液才可能呈中性
,
故
pH=7
时
c
(Na
+
)>
c
(Cl
-
),C
项错误
;
加入
20
mL
NaOH
溶液后
,
原溶液中两种酸都恰好完全反应
,
生成的
NaCl
、
CH
3
COONa
物质的量之比为
1
∶
1,CH
3
COONa
水解使溶液呈碱性
,
c
(OH
-
)>
c
(H
+
),
根据电荷守恒
c
(Na
+
)+
c
(H
+
)=
c
(Cl
-
)+
c
(CH
3
COO
-
)+
c
(OH
-
),
可知
c
(Na
+
)>
c
(Cl
-
)+
c
(CH
3
COO
-
),D
项错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
影响沉淀溶解平衡的因素
1
.(2014
课标全国
Ⅰ
,11)
溴酸银
(AgBrO
3
)
溶解度随温度变化的曲线如图所示
,
下列说法错误的是
(
)
A.
溴酸银的溶解是放热过程
B.
温度升高时溴酸银溶解速率加快
C.60
℃
时溴酸银的
K
sp
约等于
6×10
-4
D.
若硝酸钾中含有少量溴酸银
,
可用重结晶方法提纯
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
A
由图像可知随着温度的升高
,AgBrO
3
的溶解度逐渐增
即
AgBrO
3
的溶解是吸热过程
,A
项错误
;
温度升高
,
其溶解速率加快
,B
项正确
;60
℃
时
AgBrO
3
饱和溶液中
KNO
3
中混有
AgBrO
3
,
可采用降温重结晶的方法提纯
,D
项正确。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(
经典考题
)
下列电解质溶液的有关叙述正确的是
(
)
A.
同浓度、同体积的强酸与强碱溶液混合后
,
溶液的
pH=7
B.
在含有
BaSO
4
沉淀的溶液中加入
Na
2
SO
4
固体
,
c
(Ba
2+
)
增大
C.
含
1 mol KOH
的溶液与
1 mol CO
2
完全反应后
,
溶液中
D.
在
CH
3
COONa
溶液中加入适量
CH
3
COOH,
可使
c
(Na
+
)=
c
(CH
3
COO
-
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
D
若强酸为二元强酸
,
强碱为一元强碱
,
则混合后酸过量
,
错误
;
在醋酸钠溶液中
,
由于
CH
3
COO
-
水解
,
使
c
(CH
3
COO
-
)
比
c
(Na
+
)
小一些
,
加入适量醋酸后
,
醋酸能电离出一定量的
CH
3
COO
-
,
可能出现
c
(CH
3
COO
-
)=
c
(Na
+
),D
项正确。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
3
.[2015
福建
23(2)]25
℃
,
在
0.10 mol·L
-1
H
2
S
溶液中
,
通入
HCl
气体或加入
NaOH
固体以调节溶液
pH,
溶液
pH
与
c
(S
2-
)
关系如下图
(
忽略溶液体积的变化及
H
2
S
的挥发
)
。
(1)pH=13
时
,
溶液中的
c
(H
2
S)+
c
(HS
-
)=
mol·L
-1
。
(2)
某溶液含
0.020 mol·L
-1
Mn
2+
、
0.10 mol·L
-1
H
2
S,
当溶液
pH=
时
,Mn
2+
开始沉淀。
[
已知
:
K
sp
(MnS)=2.8×10
-13
]
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
(1)0.043
(2)5
【解析】
(1)
根据物料守恒
:
c
(S
2-
)+
c
(H
2
S)+
c
(HS
-
)=0.10
mol·L
-1
,
故
c
(H
2
S)+
c
(HS
-
)=0.10
mol·L
-1
-
c
(S
2-
)=0.10
mol·L
-1
-5.7×10
-2
mol·L
-1
=0.043
mol·L
-1
。
mol·L
-1
=1.4×10
-11
mol·L
-1
,
再对照图像找出
pH=5
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.
物质的溶解度
(1)
定义
:
在一定温度下
,
某固体物质在
100 g
溶剂中形成
饱和溶液
时
,
溶解的溶质质量为该物质在该温度下的溶解度
,
用
S
表示。
(2)
在
20
℃
时
,
物质的溶解度与溶解性的关系
:
(3)
固体物质溶解度的变化规律
:
绝大多数固体物质的溶解度随温度的升高而
增大
,
如
KNO
3
;
少数固体物质的溶解度随温度的改变变化不大
,
如
NaCl;
个别固体物质随温度的升高溶解度减小
,
如
Ca(OH)
2
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.
沉淀溶解平衡
(1)
定义
:
在一定温度下
,
当沉淀溶解速率和沉淀生成速率
相等
时
,
形成
饱和溶液
,
达到平衡状态
,
把这种平衡称之为沉淀溶解平衡。
(2)
沉淀溶解平衡的建立
:
(3)
特点
:(
适用勒夏特列原理
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
(4)
影响因素
:
内因
:
难溶电解质本身的
性质
——
决定因素。
外因
:
①
浓度
:
加水稀释
,
平衡向
沉淀溶解
的方向移动
;
②
温度
:
绝大多数难溶盐的溶解是
吸
热过程
,
升高温度
,
平衡向
沉淀溶解
的方向移动
;
③
同离子效应
:
向平衡体系中加入难溶物溶解产生的离子
,
平衡向
生成沉淀
的方向移动
;
④
其他
:
向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子
时
,
平衡向该
沉淀溶解
的方向移动。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
(2)
沉淀完全并不是指溶液中该离子浓度为
0,
通常认为残留在溶液中的离子浓度小于
1×10
-5
mol·L
-1
时
,
就达到完全沉淀。
(3)
长时间煮沸
Mg(HCO
3
)
2
溶液得到的产物是
Mg(OH)
2
而不是
MgCO
3
,
因为
Mg(OH)
2
比
MgCO
3
更难溶解。水垢的成分为
CaCO
3
和
Mg(OH)
2
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
典例导引
已知
:AgCl
、
AgBr
及
AgI
的
K
sp
依次为
1.6×10
-10
、
4.8×10
-13
和
1.6×10
-16
,
现将物质的量均为
1.5×10
-2
mol
的
NaI
、
NaBr
、
NaCl
和
4.0×10
-2
mol AgNO
3
混合配成
1.0 L
水溶液
,
达到平衡时
,
下列说法正确的是
(
)
A.
只生成
AgBr
及
AgI
两种沉淀
B.
溶液中
c
(I
-
)≈1.0×10
-9
mol·L
-1
C.
溶液中
c
(Br
-
)≈3.0×10
-5
mol·L
-1
D.
溶液中
c
(Ag
+
)≈3.2×10
-8
mol·L
-1
【解析】
物质的量均为
1.5×10
-2
mol
的
NaI
、
NaBr
、
NaCl
和
4.0×10
-2
mol
AgNO
3
混合配成
1.0
L
水溶液
,
K
sp
小的先转化为沉淀
,
则
1.5×10
-2
mol 1.5×10
-2
mol
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1.5×10
-2
mol
1.5×10
-2
mol
剩余硝酸银为
4.0×10
-2
mol-3.0×10
-2
mol=1.0×10
-2
mol,
则发生反应
NaCl+AgNO
3
AgCl↓+NaNO
3
,NaCl
过量
1.5×10
-2
mol-1.0×10
-2
mol=5×10
-3
mol,
结合
K
sp
(AgCl)
计算。
由上述分析可知
,
反应生成
AgI
、
AgBr
、
AgCl
三种沉淀
,A
错误
;
mol·L
-1
≈1.5×10
-5
mol·L
-1
,C
错误
;
由对选项
B
的分析可知
,
溶液中
c
(Ag
+
)≈3.2×10
-8
mol·L
-1
,D
正确。
【答案】
D
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
高招
运用沉淀溶解平衡解决的实际问题
1
.
沉淀的生成
加入沉淀剂
,
应用同离子效应
,
控制溶液的
pH,
生成沉淀。可利用生成沉淀来达到分离或除去溶液中某些离子的目的。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.
沉淀的溶解
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
3
.
沉淀的转化
(1)
实质
:
难溶电解质溶解平衡的移动。
(2)
特征
:
若难溶电解质类型相同
,
则
K
sp
较大的沉淀易转化为
K
sp
较小的沉淀
,
沉淀的溶解度差别越大
,
越容易转化。
(3)
应用
:
①
锅炉除垢。将
CaSO
4
转化为
CaCO
3
,
离子方程式为
②
矿物转化。
CuSO
4
溶液遇
ZnS(
闪锌矿
)
转化为
CuS(
铜蓝
)
的离子方程式为
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.(2017
广东湛江一模
)20
℃
时
,PbCl
2
(s)
在不同浓度盐酸中的最大溶解量
(
单位
:g·L
-1
)
如图所示。下列叙述正确的是
(
)
A.
盐酸浓度越大
,
K
sp
(PbCl
2
)
越大
B.PbCl
2
能与一定浓度的盐酸反应
C.X
、
Y
两点对应的溶液中
c
(Pb
2+
)
相等
D.
往含
Pb
2+
的溶液中加入过量浓盐酸
,
可将
Pb
2+
完全转化为
PbCl
2
(s)
【答案】
B
K
sp
(PbCl
2
)
只受温度的影响
,
温度不变
,
则
K
sp
(PbCl
2
)
不变
,A
错误
;
c
(HCl)
大于
1
mol·L
-1
时
,
可
发生络合反应而促进溶解
,B
正确
;
X
、
Y
两点对应的溶液中的溶质不同
,
则
c
(Pb
2+
)
不相等
,C
错误
;
往含
Pb
2+
的溶液中加入过量浓盐酸
,
发生络合反应
,
产物不是
PbCl
2
,D
错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(2016
安徽淮南二模
)
含
Cd
2+
的废水可通过如下反应转化为
CdS,
以消除镉对环境的污染
:Cd
2+
(aq)+H
2
S(g) CdS(s)+2H
+
(aq)
Δ
H
<0
该反应达到平衡后
,
改变横坐标表示的条件
,
下列示意图正确的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
B
正反应放热
,
升温
K
减小
,A
错误
;
达到平衡后增大
H
2
S
的压强
,
平衡向正反应方向移动
,Cd
2+
的转化率增大
,B
正确
;
c
(H
+
)
增大
,
平衡左移
,
c
(Cd
2+
)
增大
,C
错误
;
升温平衡向逆反应方向移动
,Cd
2+
的转化率减小
,D
错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
3
.(2017
河南安阳二模
)
硫酸锶
(SrSO
4
)
可用于烟火和陶瓷工业
,
该物质是矿物天青石的主要成分
,
可由
Na
2
SO
4
溶液加入锶盐溶液沉淀而得。如图是硫酸锶的溶解曲线
,
下列说法正确的是
(
)
A.
图像中
a
、
c
两点的溶度积
:
K
sp
(a)<
K
sp
(c)
B.363 K
时的溶度积
K
sp
(SrSO
4
)=1.0×10
-3.20
C.SrSO
4
的溶解度随温度升高而增大
D.313 K
时
,b
点为饱和溶液
,d
点为不饱和溶液
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
B
溶度积只受温度影响
,
温度不变
,
则溶度积不变
,
即
液
,D
项错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
溶度积常数及应用
1
.(2017
课标全国
Ⅲ
,13)
在湿法炼锌的电解循环溶液中
,
较高浓度的
Cl
-
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入
Cu
和
CuSO
4
,
生成
CuCl
沉淀从而除去
Cl
-
。根据溶液中平衡时相关离子浓度的关系图
,
下列说法错误的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
A.
K
sp
(CuCl)
的数量级为
10
-7
C.
加入
Cu
越多
,Cu
+
浓度越高
,
除
Cl
-
效果越好
【答案】
C
A
项
,
K
sp
(CuCl)=
c
(Cu
+
)·
c
(Cl
-
),
K
sp
(CuCl)
仅与温度有关
,
为方便计算
,
取横坐标为
1
时
,
即
c
(Cl
-
)=0.1
mol·L
-1
,
对应的
c
(Cu
+
)
约为
10
-6
mol·L
-1
,
所以
K
sp
(CuCl)
的数量级约为
0.1×10
-6
=10
-7
,
正确
;B
项
,Cu
2+
和
Cu
发生归中反应生成
Cu
+
,Cu
+
与
Cl
-
结合生成
CuCl
沉淀
,
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(2016
课标全国
Ⅲ
,13)
下列有关电解质溶液的说法正确的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
mol·L
-1
的
AgNO
3
溶液时
,
三种阴离子产生沉淀的先后顺序为
(
)
Ag
+
浓度最大
,
即最后产生沉淀。
3
.(2013
课标全国
Ⅰ
,11)
已知
K
sp
(AgCl)=1.56×10
-10
,
K
sp
(AgBr)=7.7×10
-13
,
K
sp
(Ag
2
CrO
4
)=9.0×10
-12
。某溶液中含有
Cl
-
、
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
4
.(2016
课标全国
Ⅰ
,27)
元素铬
(Cr)
在溶液中主要以
Cr
3+
(
蓝紫色
)
、
Cr(OH)
3
为难溶于水的灰蓝色固体。回答下列问题
:
(1)Cr
3+
与
Al
3+
的化学性质相似。在
Cr
2
(SO
4
)
3
溶液中逐滴加入
NaOH
溶液直至过量
,
可观察到的现象是
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
①
用离子方程式表示
Na
2
CrO
4
溶液中的转化反应
。
大
”“
减小
”
或
“
不变
”)
。根据
A
点数据
,
计算出该转化反应的平衡常数为
。
0(
填
“
大于
”“
小于
”
或
“
等于
”)
。
(3)
在化学分析中采用
K
2
CrO
4
为指示剂
,
以
AgNO
3
标准溶液滴定溶
mol·L
-1
。
(
已知
Ag
2
CrO
4
、
AgCl
的
K
sp
分别为
2.0×10
-12
和
2.0×10
-10
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
(1)
蓝紫色溶液颜色变浅
,
同时有灰蓝色沉淀生成
,
然后沉淀逐渐溶解形成绿色溶液
②
增大
1.0×10
14
③
小于
(3)2.0×10
-5
5.0×10
-3
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【解析】
(1)
根据
Cr
3+
与
Al
3+
化学性质相似可知
,Cr
2
(SO
4
)
3
溶液中加入
NaOH
溶液
,
先生成
Cr(OH)
3
灰蓝色沉淀
,
继续滴加
NaOH
溶
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
溶度积和离子积
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【疑难辨析】
溶液中离子浓度的变化只能使溶解平衡发生移动
,
改变该沉淀的溶解度
,
但不会改变溶度积。相同类型的难溶电解质的
K
sp
越小越难溶。如
:
由
K
sp
(AgCl)>
K
sp
(AgBr)>
K
sp
(AgI)
可得出溶解性大小为
AgCl>AgBr>AgI
。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
典例导引
(2017
河北沧州模拟
)
已知
:25
℃
时
K
sp
(BaSO
4
)=1.0×10
-10
。该温度下
,CaSO
4
悬浊液中
,
c
(Ca
2+
)
与
c
( )
的关系如图所示
,
下列叙述正确的是
(
)
A.
向
a
点的溶液中加入等物质的量固体
Na
2
SO
4
或
Ca(NO
3
)
2
,
析出的沉淀量不同
B.a
、
b
、
c
、
d
四点对应的体系中
,d
点体系最稳定
C.
升高温度后
,
溶液可能会由
a
点转化为
b
点
D.
反应
Ba
2+
(aq)+CaSO
4
(s) BaSO
4
(s)+Ca
2+
(aq)
的平衡常数
K
=9×10
4
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【解析】
向
a
点的溶液中加入等物质的量固体
Na
2
SO
4
或
Ca(NO
3
)
2
,
抑制固体溶解的作用相同
,
则析出的沉淀量相同
,A
错误
;
曲线上的点为平衡点
,c
为不饱和溶液
,d
为过饱和溶液
,
则
d
点体系最
【答案】
D
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
高招
1
解决相关沉淀溶解平衡图像题的四大技巧
(1)
沉淀溶解平衡曲线类似于溶解度曲线
,
曲线上任一点都表示饱和溶液
,
曲线上方的任一点均表示过饱和溶液
,
此时有沉淀析出
,
曲线下方的任一点
,
均表示不饱和溶液。
(2)
从图像中找到数据
,
根据
K
sp
公式计算得出
K
sp
的值。
(3)
比较溶液的
Q
c
与
K
sp
的大小
,
判断溶液中有无沉淀析出。
(4)
涉及
Q
c
的计算时
,
所代入的离子浓度一定是混合溶液中的离子浓度
,
因此计算离子浓度时
,
所代入的溶液体积也必须是混合溶液的体积。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
典例导引
(2017
河南周口模拟
)
已知
298 K
时
,Mg(OH)
2
的溶度积常数
K
sp
=5.6×10
-12
,
取适量的
MgCl
2
溶液
,
加入一定量的烧碱溶液达到沉淀溶解平衡
,
测得
pH=13.0,
则下列说法不正确的是
(
)
A.
所得溶液中的
c
(H
+
)=1.0×10
-13
mol·L
-1
B.
加入
Na
2
CO
3
固体
,
可能生成沉淀
C.
所加的烧碱溶液
pH=13.0
D.
所得溶液中的
c
(Mg
2+
)=5.6×10
-10
mol·L
-1
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【解析】
pH=13
的溶液中
,
c
(H
+
)=10
-13
mol·L
-1
,A
项正确
;
加入
mol·L
-1
=5.6×10
-10
mol·L
-1
,D
项正确。
【答案】
C
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
高招
2
根据溶度积常数计算离子浓度的方法
(1)
已知溶度积求溶液中的某种离子的浓度
,
如
K
sp
=
a
的饱和
AgCl
溶液中
c
(Cl
-
)=
c
(Ag
+
)= mol·L
-1
。
(2)
已知溶度积、溶液中某离子的浓度
,
求溶液中的另一种离子的浓度
,
如某温度下
AgCl
的
K
sp
=
a
,
在
0.1 mol·L
-1
的
NaCl
溶液中加入过量的
AgCl
固体
,
达到平衡后
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
1
.(2017
黑龙江哈尔滨模拟
)
已知
25
℃
时
,CaSO
4
在水中的沉淀溶解平衡曲线如图所示
,
向
100 mL
该条件下的
CaSO
4
饱和溶液中
,
加入
400 mL 0.01 mol·L
-1
的
Na
2
SO
4
溶液
,
针对此过程的下列叙述正确的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
D
由图示可知
,
在该条件下
,CaSO
4
饱和溶液中
,
以混合液中无沉淀析出
,
最终溶液中硫酸根离子浓度增大。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
2
.(2017
江苏无锡模拟
)
一定温度下
,
卤化银
AgX(X:Cl
-
、
Br
-
、
I
-
)
及
Ag
2
CrO
4
的沉淀溶解平衡曲线如图示。横坐标
p
(Ag
+
)
表示
“-lg
c
(Ag
+
)”,
纵坐标
Y
表示
“-lg
c
(X
-
)”
或
“-lg
c
( )”
。下列说法正确的是
(
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
A.
a
点表示
c
(Ag
+
)=
c
( )
B.
b
点可表示
AgI
的饱和溶液
C.
该温度下
AgI
的
K
sp
约为
1×10
-16
D.
该温度下
AgCl
、
AgBr
饱和溶液中
:
c
(Cl
-
)<
c
(Br
-
)
【答案】
C
a
点为
Ag
2
CrO
4
饱和溶液
,
存在
Ag
2
CrO
4
(s)
AgI
溶解平衡曲线的上方
,
Q
c
<
K
sp
,
为不饱和溶液
,
曲线上的点为饱和溶液
,B
错误
;
横坐标
p
(Ag
+
)
表示
“-lg
c
(Ag
+
)”,
纵坐标
Y
表示
“-lg
c
(I
-
)”,
该温度下
AgI
的
K
sp
约为
1×10
-8
×1×10
-8
=1×10
-16
,C
正确
;
纵横坐标的乘积越大
,
K
sp
越小
,
则
K
sp
(AgCl)>
K
sp
(AgBr),
故该温度下
AgCl
、
AgBr
饱和溶液中
:
c
(Cl
-
)>
c
(Br
-
),D
错误。
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
3
.(2017
山东东营模拟
)25
℃
时
,
用
Na
2
S
沉淀
Cu
2+
、
Mn
2+
、
Fe
2+
、
Zn
2+
四种金属离子
(M
2+
),
所需
S
2-
最低浓度的对数值
lg
c
(S
2-
)
与
lg
c
(M
2+
)
关系如图所示。下列说法正确的是
(
)
A.
K
sp
(CuS)
约为
1×10
-20
B.
向
Cu
2+
浓度为
10
-5
mol·L
-1
的废水中加入
ZnS
粉末
,
会有
CuS
沉淀析出
C.
向
100 mL
浓度均为
10
-5
mol·L
-1
Zn
2+
、
Fe
2+
、
Mn
2+
的混合溶液中逐滴加入
10
-4
mol·L
-1
Na
2
S
溶液
,Zn
2+
先沉淀
D.Na
2
S
溶液中
:
c
(S
2-
)+
c
(HS
-
)+
c
(H
2
S)=2
c
(Na
+
)
试做真题
高手必备
萃取高招
对点精练
考点
42
考点
43
考点
44
考点
45
【答案】
B
由图示可知
,
K
sp
(CuS)=
c
(Cu
2+
)·
c
(S
2-
)=1×10
-10
×1×10
-25
=1×10
-35
,A
错误
;
由图像知
,
K
sp
(CuS)<
K
sp
(MnS)<
K
sp
(FeS)<
K
sp
(ZnS),B
正确
,C
错误
;
根据物料守恒
:
c
(Na
+
)=2[
c
(S
2-
)+
c
(HS
-
)+
c
(H
2
S)],D
错误。