- 2021-08-24 发布 |
- 37.5 KB |
- 10页


文档介绍
江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题
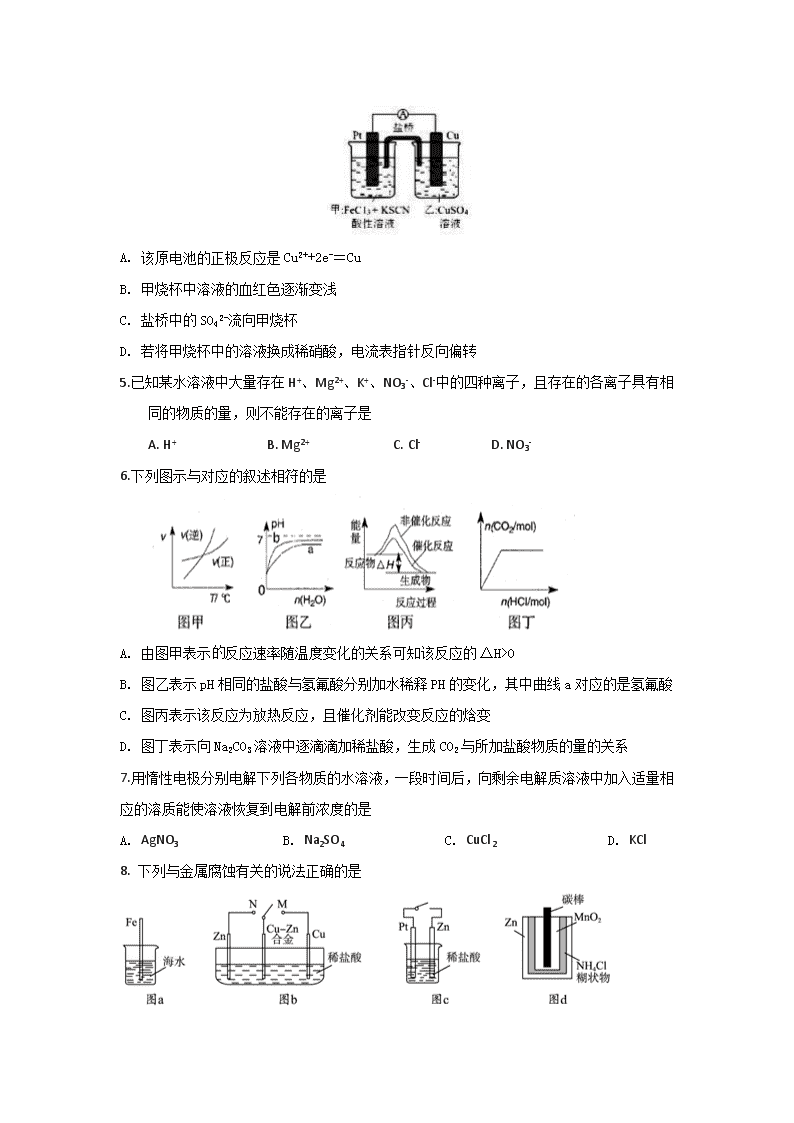
高二上学期期末考试 化学试卷 学校:南昌十中 考试时长:100分钟 试卷总分:100分 可能用到的原子量: H:1,Li:7,C:12,N:14,O:16,Mg:24,Al:27,S:32,Cl:35.5,Fe:56, Cu:64,Zn:65,Ag:108,Pb:207 一、选择题(每题只有一个选项符合题意,每题3分,16小题,共计48分) 1.化学与科学、技术、社会、环境关系密切,下列说法不正确的是 A. 海水淡化的方法有蒸馏法、离子交换法、电渗析法等 B. NH4Cl和ZnCl2溶液可用作焊接钢铁时的除锈剂 C. 用牺牲镁块的方法防止地下钢铁管道的腐蚀 D. 电解熔融氧化镁可以得到镁,电解熔融氯化镁不能得到镁 2.下列说法正确的是 A. 甲烷的燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 B. 已知H2O(1)=H2O(g) ΔH=+44kJ·mol-1,则2g H2(g)完全燃烧生成液态水比生成气态水多释放22kJ的能量 C. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同 3.NA为阿伏加德罗常数,下列说法不正确的是 A. 500mL2mol/L葡萄糖溶液中所含分子总数是NA B. 1L0.1mol/LNa2CO3溶液中的阴离子总数大于0.1NA C. 1molNa2O和Na2O2固体混合物中含有的阴、阳离子总数是3NA D. 1L2mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2NA 4. 某兴趣小组设计了如图所示原电池装置(盐桥中吸附有K2SO4饱和溶液)。下列说法正确的是 A. 该原电池的正极反应是Cu2++2e-=Cu B. 甲烧杯中溶液的血红色逐渐变浅 C. 盐桥中的SO42-流向甲烧杯 D. 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转 5. 已知某水溶液中大量存在H+、Mg2+、K+、NO3-、Cl-中的四种离子,且存在的各离子具有相同的物质的量,则不能存在的离子是 A. H+ B. Mg2+ C. Cl- D. NO3- 6.下列图示与对应的叙述相符的是 A. 由图甲表示反应速率随温度变化的关系可知该反应的ΔH>0 B. 图乙表示pH相同的盐酸与氢氟酸分别加水稀释PH的变化,其中曲线a对应的是氢氟酸 C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 7.用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是 A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl 8. 下列与金属腐蚀有关的说法正确的是 A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 B. 图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小 C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体速率也增大 D. 图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化反应引起的 9.解释下列事实的方程式不正确的是 A. NaHCO3溶液显碱性原因: HCO3-+H2O=H3O++CO32- B. 用FeCl3溶液腐蚀印刷电路板上铜:2Fe3++Cu=2Fe2++Cu2+ C. 盛装NaOH溶液试剂瓶不能用玻璃塞:2OH-+SiO2=SiO32-+H2O D. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的方铅矿(PbS),慢慢转变为铜蓝(CuS): CuSO4+PbS=CuS+PbSO4 10. 室温下,已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=5.0×10-9。下列说法中正确的是 A. 在含有BaSO4固体的溶液中,一定有c(Ba2+)=c(SO42-) B. 向只含有BaSO4的悬独液中加入少量水,溶液中c(Ba2+)增大 C. 若BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO32-)=5.0×10-4mol/L时,BaSO4开始向BaCO3沉淀转化 D. 往Na2CO3和Na2SO4的混合溶液中加入BaCl2溶液,当生成BaCO3沉淀时,(CO32-)/ c(SO42-)=0.02 11. 下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是 A. HCl+NH3=NH4Cl B. 2Na2O2+2H20=4NaOH+O2↑ C. 2KClO3=2KCl+302↑ D.Ba(OH)2•8H20+2NH4Cl=BaCl2+2NH3↑+10H2O 12. 向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是 A. Va>Vb时:c(CH3COOH) +c(CH3COO-)>c(K+) B. Va=Vb时:c(CH3COOH) +c(H+)=c(OH-) C. Va<Vb时:c(CH3COO-)> (K+)>c(OH-)> c(H+) D. Va与Vb任意比时:c(K+)+ c(H+) = c(OH-)+ c(CH3COO-) 13. 下列说法中不正确的有( ) ①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107 ②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2 ③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低 ④蒸干AlCl3溶液可得纯净的无水氯化铝 ⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱 A. 1个 B. 2个 C. 3个 D. 4个 14.在恒温、恒容密闭容器中发生反应: A(s) +2B(g)C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是 ①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 A. ②③⑤ B. ①②③ C. ①②③⑤ D. ①③④⑤ 15. 反应mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是 ① m+n>p ②x点表示的正反应速率小于逆反应速率 ③nc[X(OH)+] D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+) 第II卷(非选择题,共52分) 17、(6分)合成氨工业中,每生产2molNH3,放出92.4kJ热量。 (1)写出合成氨反应的热化学方程式为________________________________________________。 (2)已知: 1mol N-H键断裂吸收的能量等于______kJ。 (3)已知关于铁的氧化物存在下列三个热化学方程式: Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ① Fe2O3(s)+CO(g)=== Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol ② Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol ③ 则CO还原FeO的热化学方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=________kJ/mol。 18. (9分)如下左图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题: (1)甲池燃料电池的负极反应为___________________。 (2)写出乙池中电解总反应的化学方程式: ___________________。 (3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生____g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。 (4)某同学利用甲醇燃料电池设计电解法制取消毒液或Fe(OH)2 的实验装置(如上右图) 。若用于制消毒液,a 为电池的______极,电解质溶液最好用_____。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___作电极。 19、(9分)某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。 (1)仪器A的名称是_______。 (2)B中加入300.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为____________________________________。 (3)除去C中过量的H2O2,然后用0. 0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的___________________。 (4)若滴定终点时溶液的pH=8.8,则选择的指示剂为__________。 (5)该测定结果往往比实际值偏高,分析是由于采用试剂不当引起的,可能的原因为_____________。 20、(12分)按要求回答下列问题: I.将等物质的量的A、B混合放于2 L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A) ∶c(B) = 3:5,v(C) = 0.1 mol/(L·min)。则: (1)x =_________。 (2)前5 min内B的反应速率v(B) =_________。 (3)平衡时A的转化率为_________。 II.水蒸气通过炙热的碳层发生反应:C(s)+ H2O(g) CO(g)+H2(g) △H 。 (4)已知:K(300℃)<K(350℃),则该反应是_________(吸或放)热反应。 (5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号。 ① 缩小容器体积_________; ② 降低温度 ____________ (6)已知反应①CO(g)+ CuO(g)CO2(g)+Cu(s)②H2 (g)+ CuO(g)Cu(s)+ H2O(g) 在相同的某温度下的平衡常数分别为K1和K2,该温度下反应 CO (g)+H2O (g)CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。 21. (16分)甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。 (1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。 已知:C(s)+2H2(g)CH4(g) △H=-73kJ/mol 2CO(g)C(s)+CO2(g) △H=-171kJ/mol CO(g)+3H(g)CH4(g)+H2O(g) △H=-203kJ/mol。 写出CO与H2O(g)反应生成H2和CO2的热化学方程式_________________。 (2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知 T℃k(NH3·H2O)=1.74×10-5;k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是_______。 A. c(NH4+)>c(HS-)>c(OH-)>c(H+) B. c(HS-)>c(NH4+)>(S2-)>c(H+) C. c(NH4+)>c(HS-)>c(H2S)>c(H+) D. c(HS-)>c(S2-)>c(H+)>c(OH-) (3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)CO(g)+3H2(g) ①一定温度时,在一个体积为2L的恒容密闭容器中,加入lnmolCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_________。此反应的平衡常数为_____(结果保留到小数点后三位)。 ②下列说法中能说明此反应达到平衡状态的是_________。 A.体系的压强不再发生变化 B.生成1molCH4的同时消耗3molH2 C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化 E.反应速率V(CH4):V(H2O):V(CO):V(H2)=1:1:1:3 (4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______。 (5)如图所示,直接甲醇燃料电池是质子交换膜燃料电池的一种变种,它直接使用甲醇而勿需预先重整。请写出电池工作时的负极反应式:__________________。 答案 1-16题 DDABB BCBAC BCCAA C 17、 (1)N2(g)+3H2(g)2NH3(g)△H=-92.4KJ·mol-1(2分) (2)391(2分) (3)-218(2分) 18、 (1)CH3OH-6e-+8OH-+8OH-=CO32-+6H2O (2分) (2) 2CuSO4+2H2O2Cu+2H2SO4+O2↑ (2分) (3)1.16 1 (2分) (4) 负 饱和食盐水 铁(Fe) (3分) 19、 (1)冷凝管(1分) (2)SO2+H2O2=H2SO4(2分) (3)③(2分) (4)酚酞(2分) (5)盐酸的挥发(2分) 20、 I.(1)2(2分) (2)0.05mol/( L·min) (1分) (3)50%(2分) (4)吸(1分) (5)①b(2分) ②f(2分) (6)K=(2分) 21、(1)CO(g)+H2O(g)H2(g)+ CO2(g) △H=-41kJ/mol (2分) (2)AC (3分) (3)①0.06mol/(L·min) (2分) 0.011(mol2/L2) (2分) ②AC (3分) (4) (2分) (5)CH4O-6e-+H2O→6H++CO2(2分)