- 2021-08-24 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
吉林省公主岭市范家屯镇第一中学2020届高三上学期月考化学试卷
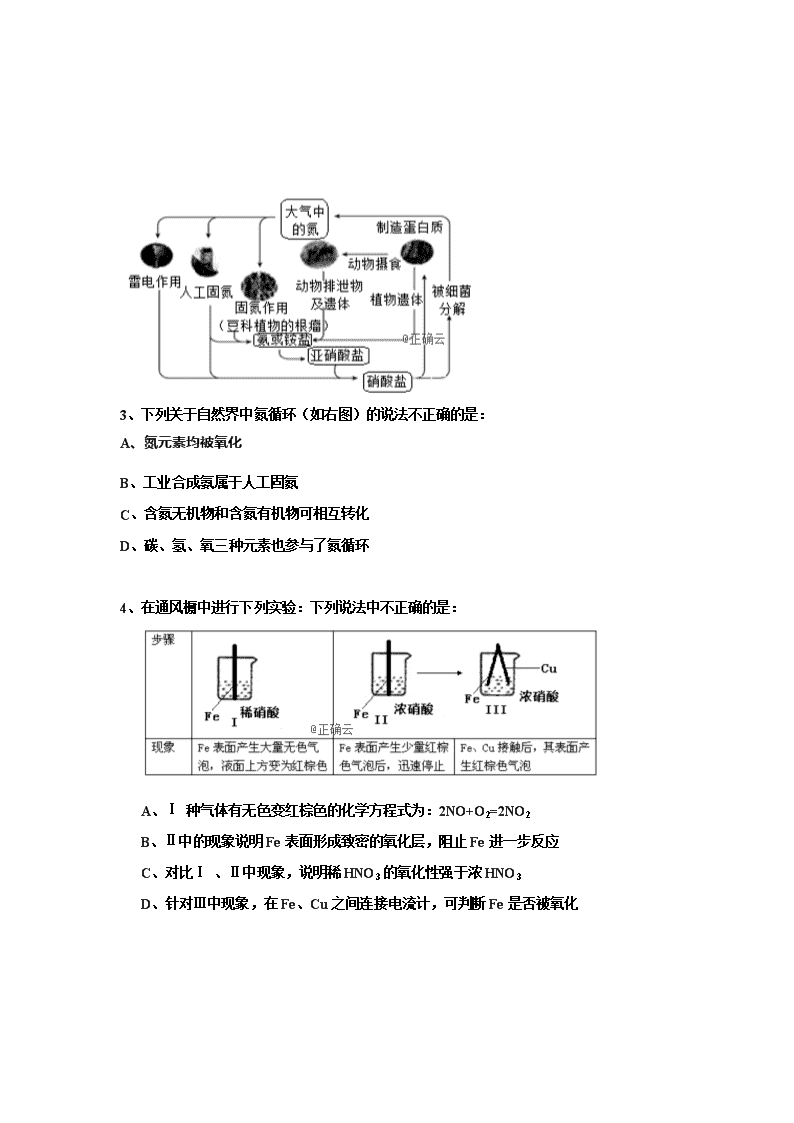
化学试卷 H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35.5 一选择题 (本题包括20小题每小题 3分 共计60分) 1、下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( ) 选项 实验 现象 结论 A. 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈血红色 稀硝酸将Fe氧化为Fe3+ B. 将铜粉加1.0mol·L-1Fe2(SO4)3溶液中 溶液变蓝、有黑色固体出现 金属铁比铜活泼 C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 熔化后的液态铝滴落下来 金属铝的熔点较低 D. 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 先有白色沉淀生成后变为浅蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的小 2、.用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 3、下列关于自然界中氮循环(如右图)的说法不正确的是: A、氮元素均被氧化 B、工业合成氨属于人工固氮 C、含氮无机物和含氮有机物可相互转化 D、碳、氢、氧三种元素也参与了氮循环 4、在通风橱中进行下列实验:下列说法中不正确的是: A、Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2 B、Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 C、对比Ⅰ 、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 D、针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 5、 6、下列说法正确的是 A.I的原子半径大于Br,HI比HBr的热稳定性强 B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强 C.Al2O3和MgO均可与NaOH溶液反应 D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 7、下列有关说法正确的是: A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 B.Fe(OH)3胶体无色、透明,能发生丁达尔现象 C.H2、SO2、CO2三种气体都可用浓硫酸干燥 D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 8、某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是: 选项 实验及现象 结论 A 将湿润的红色石蕊试纸放在试管口,试纸变蓝 反应中有NH3产生 B 收集产生的气体并点燃,火焰呈淡蓝色 反应中有H2产生 C 收集气体的同事测得溶液的pH为8.0 弱碱性溶液中Mg也可被氧化 D 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 弱碱性溶液中OH-氧化了Mg 9、纯净物X、Y、Z转化关系如右图所示,下列判断正确的是 A. X可能是金属铜 B. Y不可能是氢气 C. Z可能是氯化钠 D. Z可能是二氧化硫 10、某化合物由两种单质直接反应生成,将其加入BaHCO3溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是: A、AlCl3 B、Na2O C、FeCl2 D、SiO2 11、某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程: 下列说法不正确的是 A.溶解烧渣选用足量硫酸,试剂X选用铁粉 B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O 12、下列物质见光不会分解的是( ) A.HClO B.NH4Cl C.HNO3 D.AgNO3 13不能作为判断硫、氯两种元素非金属性强弱的依据是( ) A.单质氧化性的强弱 B.单质沸点的高低 C.单质与氢气化合的难易 D.最高价氧化物对应的水化物酸性的强弱 14、二氧化硫能使溴水褪色,说明二氧化硫具有( ) A.还原性 B.氧化性 C.漂白性 D.酸性 15、将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )[多选] A.231.5mL B. 286.8 mL C.287.5mL D.314.6 16. 17、在CO2中,Mg燃烧生成MgO和C。下列说法正确的是 ( ) A.元素C的单质只存在金刚石和石墨两种同素异形体 B.Mg、MgO中镁元素微粒的半径: C.在该反应条件下,Mg的还原性强于C的还原性 D.该反应中化学能全部转化为热能 18、 19、根据下列热化学方程式: ①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol ②H2(g)+O2(g)===H2O(l) ΔH2=-285.8 kJ/mol ③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol 可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( ) A. ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol 20、断裂1mol化学键所需要的能量如下: 化学键 N-N O=O N≡N N-H 键能 a 500 942 194 肼()的有关反应能量变化如图所示,下列说法正确的是( ) A.该图表示:1mol与1mol反应生成1mol和2mol反应热△H=-2752 B.a=154 C. D.当有2mol (g)生成时,放出534的热量 21、硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: (1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。 (2)利用_______的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(化学式)。 (3)“净化除杂”需先加H2O2溶液,作用是_______。然后在调节溶液的pH约为5,目的是_____。 (4)“粗硼酸”中的主要杂质是________(填名称)。 (5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。 (6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。 22.硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,易溶于水,其溶解度随温度变化大,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图: 实验具体操作步骤为: ① 开启分液漏斗,使硫酸慢慢滴下,适当调节滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。 ② 直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。 …… 回答下列问题: 1).写出仪器A的名称__________。 2).为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因__________。 3).写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式__________。 4).从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤如下: 为减少产品的损失,操作①为趁热过滤,“趁热”的原因是__________;操作②是__________;操作③是抽滤、洗涤、干燥。 5). 测定产品纯度:取6.00 g产品,配制成100 mL,溶液。取10.00 mL该溶液,以淀粉溶液为指示剂,用浓度为0.050 0 mol•L-1的I2标准溶液进行滴定,反应原理为,实验相关数据记录如下表所示: 编号 1 2 3 溶液的体积/mL 10.00 10.00 10.00 消耗I2标准溶液的体积/mL 19.98 22.50 20.02 滴定时,达到滴定终点的现象是_______________。产品的纯度为_________________。 6).Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成,该反应的离子方程式为_______。 23、从能量的变化和反应的快慢等角度研究化学反应具有重要意义。 1)①.已知一定条件下,反应N2+3H22NH3为放热反应:①下图能正确表示该反应中能量变化的是 ____. ②根据下表数据,计算生成1mol NH3时该反应放出的热量为__________kJ; 化学键 H-H N≡N N-H 断开1mol键所吸收的能量 436kJ 946kJ 391kJ ③一定温度下,将3mol H2和1mol N2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min时v(N2)=__________,反应开始与平衡时气体的物质的量之比为__________. 2).原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验: ①装置甲中向__________极移动(填“A”或“B”); ②四种金属活动性由强到弱的顺序是__________; ③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为__________mol. 24、FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性 Ⅰ.实验室制备FeBr2 实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉. 实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁请回答: (1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。 (2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽; ②是 _. Ⅱ.探究FeBr2的还原性, (1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液 除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是___ _____。 (2)取10mL上述FeBr2 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设: 假设1:Br- 被Cl2氧化成Br2溶解在溶液中; 假设2:Fe2+ 被Cl2氧化成Fe3+。 设计实验证明假设2是正确的 (3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明: ; (4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为: 1、D 2D 3A 4C 5A 6B 7C 8D 9A 10A 11 D 12 B 13B 14A 15B 16C 17C 18A 19、B 20、B 、 21【答案】14分⑴ Mg2B2O5·H2O+2H2SO4=== 2MgSO4+2H3BO3;搅拌矿粉、升高温度。 ⑵ Fe3O4;SiO2和CaSO4;⑶ 氧化溶液中的Fe2+;除去溶液中的Al3+和Fe3+。 ⑷(七水)硫酸镁 ⑸⑹ 2H3BO3+3Mg === 3MgO+2B+3H2O 22、1.)蒸馏烧瓶;2.);3).4SO2+2Na2S+Na2CO3═CO2+3Na2S2O3; 4).防止晶体在漏斗中大量析出而导致产率降低;蒸发浓缩,冷却结晶; 5).溶液由无色变为蓝色,且半分钟内不褪色;82.67%;6). 解析:1.仪器A的名称是蒸馏烧瓶。 2.硫代硫酸钠晶体(Na2S2O3•5H2O)在酸性溶液中不能稳定存在,发生离子反应:,所以实验中溶液的pH不能小于7。 3.向盛有Na2S、Na2CO3溶液的三颈烧瓶中通入SO2来制备Na2S2O3,Na2S中硫元素由-2价变为+2价,SO2中S元素由+4价变为+2价,根据得失电子守恒、原子守恒配平,可得总反应的化学方程式为4SO2+2Na2S+Na2CO3═CO2+3Na2S2O3。 4.操作①采用趁热过滤的原因是防止晶体在漏斗中大量析出而导致产率降低;操作2的目的是得到晶体,因此该实验操作是蒸发浓缩、冷却结晶。 5.淀粉遇碘显蓝色,则达到滴定终点的现象是溶液由无色变为蓝色,且半分钟内不褪色。根据表中数据可知,第二次实验误差太大,应舍去,因此消耗标准溶液体积的平均值是20.00 mL,消耗碘的物质的量是0.0500 mol•L-1 ×0.02 L=0.001 mol,所以硫代硫酸钠晶体的物质的量是0.002 mol,其质量是0.002 mol × 248 g•mol-1 =0.496 g,则产品的纯度。 23、.被Cl2氧化成,Cl2自身被还原为Cl-,该反应的离子方程式为。 231.A; 46; 0.04mol/(L•min); 5:4 2.A; D>A>B>C; 0.1 24、答案:Ⅰ(1) 浓H2SO4的洗气瓶 NaOH溶液(2)将Br2蒸气带入反应管中 Ⅱ.(1)100 mL容量瓶 A. 向黄色溶液中加入少量KSCN溶液,若溶液变血红色,则证明假设2正确 B. Fe2++Br2=2Fe3++2Br- (4)4Fe2++2Br- +3Cl2 = 4Fe3++ Br2+6Cl- 解析: 查看更多