- 2021-08-24 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习水溶液中的离子平衡作业(全国通用)(7)
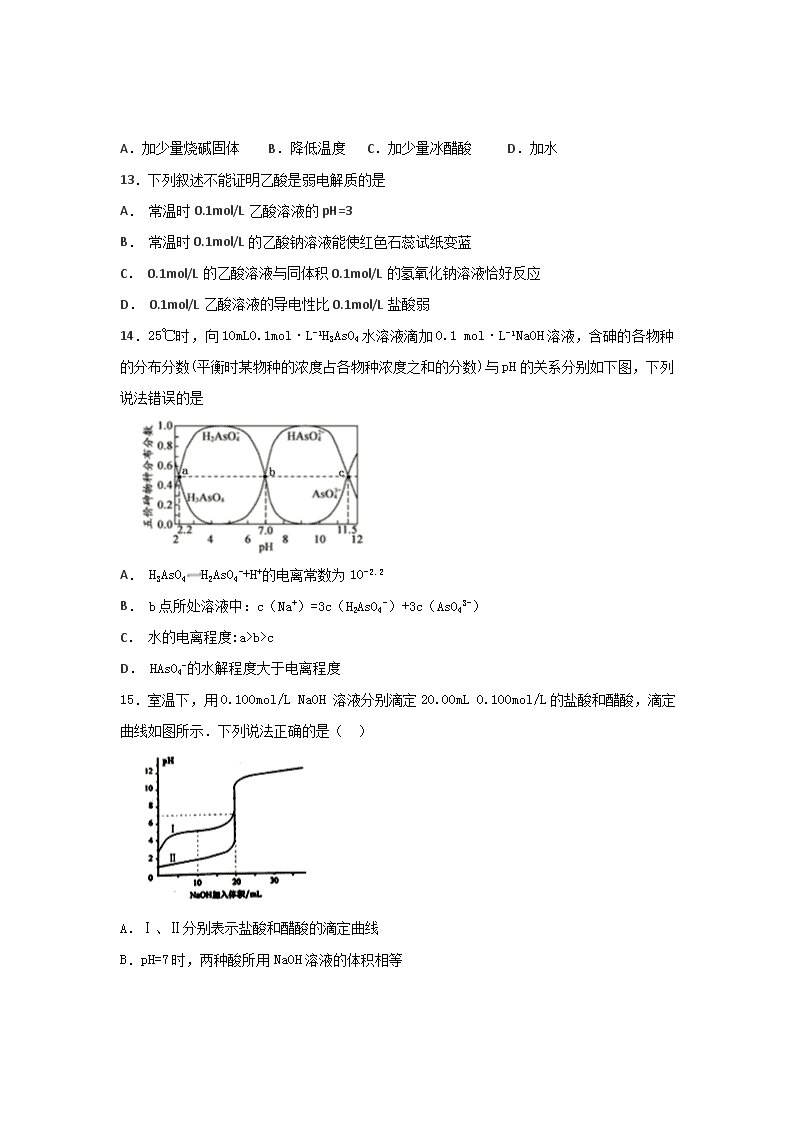
水溶液中的离子平衡 一、选择题:(每题只有一个正确选项) 1.有关电解质的下列叙述正确的是 ( ) A、离子化合物熔融状态时都导电,因此离子化合物都是电解质 B、共价化合物熔融状态时都不导电,因此共价化合物都是非电解质 C、易溶于水的化合物都是强电解质 D、强电解质溶液的导电能力一定强 2.在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( ) A.加热 B.加入100 mL 0.1 mol·L-1的醋酸溶液 C.加入少量的0.5 mol·L-1的硫酸 D.加入少量的1 mol·L-1的NaOH溶液 3.能说明溶液呈中性的可靠依据是 A. pH=7 B. c(H+)=c(OH-) C. pH试纸不变色 D. 石蕊试液不变色 4.250C,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是 A.该溶液的pH一定是9 B.该溶液可能pH=5 C.该溶液的pH可能是7 D.不会有这样的溶液 5.今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA B2-+HA=HB-+A-则下列说法正确的是: A、H2B的电离方程式为:H2B2H+ + B2- B、结合质子能力由强到弱的顺序为:B2->A->HB- C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 6.为了除去ZnCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,使溶液的pH升高,过滤后再向溶液中加入适量盐酸,这种试剂不应该是 A.ZnO B.K2CO3 C.Zn(OH)2 D.ZnCO3 7.能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是 A. 某温度下,测得溶液的pH < 7 B. 溶液中c(Na+)=c(A2-) C. 溶液中存在Na+、HA-、A2-、 H2A 多种微粒 D. NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应 8.已知三种一元弱酸的酸性强弱 :HX>HY>HZ,则相同pH的NaX、NaY、NaZ溶液,其物质的量浓度由大到小的顺序正确的是 A.NaX、NaY、NaZ B.NaZ、NaY、NaX C.NaY、NaZ、NaX D.NaX、NaZ、NaY 9.下列各选项所描述的两个量中,前者一定大于后者的是 A.pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 B.pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) C.0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率[来源:] D.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH 10.常温下,稀释0.1 mol·L-1 NH4Cl溶液,下图中的横坐标表示加水的量,则纵坐标可以表示的是 ( ) A. NH4+水解的平衡常数 B. 溶液的pH C. 溶液中NH4+物质的量 D. 溶液中c(NH4+) 11.能使H2O+H2OH3O++OH-电离平衡向正反应方向移动,且所得溶液呈酸性的是( ) A. 在水中加Na2CO3 B. 在水中加入CuCl2 C. 在水中加入稀硫酸 D. 将水加热到99℃,其中c(H+)=1×10-6mol·L-1 12.已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中值增大,可以采取的措施是( ) A.加少量烧碱固体 B.降低温度 C.加少量冰醋酸 D.加水 13.下列叙述不能证明乙酸是弱电解质的是 A. 常温时0.1mol/L乙酸溶液的pH=3 B. 常温时0.1mol/L的乙酸钠溶液能使红色石蕊试纸变蓝 C. 0.1mol/L的乙酸溶液与同体积0.1mol/L的氢氧化钠溶液恰好反应 D. 0.1mol/L乙酸溶液的导电性比0.1mol/L盐酸弱 14.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是 A. H3AsO4H2AsO4-+H+的电离常数为10-2.2 B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-) C. 水的电离程度:a>b>c D. HAsO4-的水解程度大于电离程度 15.室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( ) A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 B.pH=7时,两种酸所用NaOH溶液的体积相等 C.V(NaOH)=10.00 mL 时, D.V(NaOH)=20.00 mL 时,c(Cl—)<c(CH3COO—) 16.室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是 A. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA) B. a、b两点所示溶液中水的电离程度a点大于b点 C. pH=7时,c(Na+)=c(A-)+c(HA) D. 一元酸HA为弱酸 17.常温下下列关系的表述中,正确的是( ) A.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1 B.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3- )>c(CO32 -)>c(H2CO3) D.浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① 18.对于物质的量浓度均为0.01 mol·L-1的①NaHCO3、②Na2CO3、③CH3COOH、④CH3COONa 四种溶液,下列说法正确的是 A.①的离子浓度为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) B.②升高温度,减小 C.③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 D.④和③等体积混合,溶液pH<7,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) 二、非选择题: 19.在25℃时,有pH=a(a≤6)的盐酸VaL和pH=b(b≥8)的NaOH溶液VbL。二者混合恰好完全中和。问: (1)若a+b=14时,则=________(填数值); (2)若a+b=13时,则=________(填数值); (3)若a+b>14时,则=________(填表达式),且Va Vb(填“>”“<”或“=”) 20.今有①CH3COOH、②HCl、③H2SO4 三种溶液,请用序号回答下列问题 (1)当它们pH相同时,其物质的量浓度由大到小排列的是 . (2)当它们的物质的量浓度相同时,其pH由大到小排列的是 . (3)中和等量的烧碱溶液,需同浓度的三种酸溶液的体积大小关系为 . (4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,所需烧碱溶液的体积由大到小关系为 . 21.常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示: (1)由A、C点判断,滴定HCl溶液的曲线是__(填“图1”或“图2”)。 (2)a=___mL。 (3)c(Na+)=c(CH3COO-)的点是_______。 (4)E点对应离子浓度由大到小的顺序为________。 22.弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。 (1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。 (2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:__________________。 (3)0.1mol/L的NaHA溶液,测得溶液显碱性。则 ① 该溶液中 c(H2A)_______________c(A2-)(填“>’’、“<’’或“ =’’)》 ② 作出上述判断的依据是_____________(用文字解释)。 (4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理: 绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。 常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH) 3]=6.0×10-31} 23.(1) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则醋酸体积__________氢氧化钠溶液体积 (填“>”“=”“<”)。 (2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,溶液中c(Na+)___________c(CH3COO-)(填“>”“=”“<”)。 (3)某温度(t℃)时,水的KW=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a∶b___________;若所得混合液的pH=2,则a∶b___________。 (4)室温下,若某pH值的硫酸溶液中水电离的c(H+)=1.0×10-amol·L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-b mol·L-1,(已知a.b均小于14的正整数),那么a和b之间满足的数量关系是____________(用一个等式和一个不等式表示)。 24.Ⅰ:为了检测熟肉中NaNO2含量,某兴趣小组从1000g隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.00500 mol·L–1的高锰酸钾(酸性)溶液滴定。平行测定三次,求出每次NaNO2含量,取其平均值。(已知:2MnO4–+5NO2–+6H+=2Mn2++5NO3–+3H2O) (1)滴定前排气泡时,应选择图中的___________(填序号)。 (2)滴定终点的判断依据为_____________________________。 (3)下列操作会导致样品含量测定值偏高的是_____________(填字母)。 A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗 C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出 D.滴定前平视读数,滴定结束仰视读数 (4)某次滴定过程中,消耗高锰酸钾溶液的体积为16.00 mL。则此次求得的NaNO2的含量为_________mg·kg–1。 参考答案 1.A 【解析】本题考查电解质的概念的掌握情况,应在理解的基础上对基本概念进行强化记忆。物质的溶解性与它是否是电解质无关。 2.D 【解析】A项,加热促进电离,H+浓度增大;B项,H+浓度不变;C项,加H2SO4抑制电离,但H+浓度增大;D项,加入NaOH,OH-与H+反应,平衡向右移动,H+浓度减小。 3.B 【解析】 试题分析:常温下,pH=7、pH试纸不变色、石蕊试液不变色的溶液是中性溶液。c(H+)=c(OH-)的溶液任何情况下都呈中性,B正确。 考点: 溶液的酸碱性 点评:溶液呈中性的本质是氢离子浓度和氢氧根离子浓度相等。 4.B 【解析】 试题分析:250C,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18<1×10-14,这说明该溶液中水的电离平衡被抑制,则溶液可能显酸性,也可能显碱性。因此溶液的pH可能是5或9,答案选B。 考点:考查水的电离及pH计算 5.B 【解析】 试题分析:反应1可以看到,H2B-查看更多