【化学】河南省濮阳市油田一中2019-2020学年高一11月月考试题(解析版)
河南省濮阳市油田一中2019-2020学年高一11月月考试题
可能用到的相对原子质量H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 K:39 Cu:63.5 Fe: 56
第I卷(选择题)
一、选择题(本题共10道小题,每小题2分,共20分)
1.《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”, “以烧酒复烧二次……价值数倍也”。其方法与分离下列物质的实验方法原理上相同的是( )
A. 四氯化碳和水
B. 硝酸钾和氯化钠
C. 乙酸乙酯(沸点77 ℃)和乙酸(118 ℃)(两者互溶)
D. 食盐水和泥沙
【答案】C
【解析】
【详解】烧酒的制造工艺是利用蒸馏的方法,可用于分离沸点不同的液体混合物。
A.四氯化碳和水互不相溶,可用分液的方法分离,A不合题意;
B.硝酸钾和氯化钠的溶解度不同,可用结晶的方法分离,B不合题意;
C.乙酸乙酯和乙酸沸点相差较大,可用蒸馏的方法分离,C符合题意;
D.泥沙不溶于水,可用过滤的方法分离,D不合题意。
故选C。
2.用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 28 g 乙烯(C2H4)和丙烯(C3H6)的混合气体中所含原子数为3NA
B. 标准状况下2.24 L苯(C6H6)在氧气中完全燃烧,得到0.6NA CO2分子
C. 1 L 1 mol/L Na2SO4水溶液中含有的氧原子数为4NA
D. 欲配制480 mL 0.4 mol/L NaOH溶液,需称量NaOH的质量为8.0 g
【答案】D
【解析】
【详解】A.乙烯和丙烯的最简式相同,都为CH2,依据最简式可知,28 g CH2的物质的量为2mol,则混合气体中所含原子数为6NA,故A错误;
B. 标准状况下苯(C6H6)为液体,不能使用22.4L/mol进行计算,故B错误;
C. 1 L 1 mol/L Na2SO4中含有的氧原子数为4NA,但其水溶液中,水也含O原子,所以氧原子总数大于4NA,故C错误;
D. 欲配制480 mL 0.4 mol/L NaOH溶液,需选择500mL的容量瓶,利用500mL进行计算,需称量NaOH的质量为8.0 g,故D正确。
故选D。
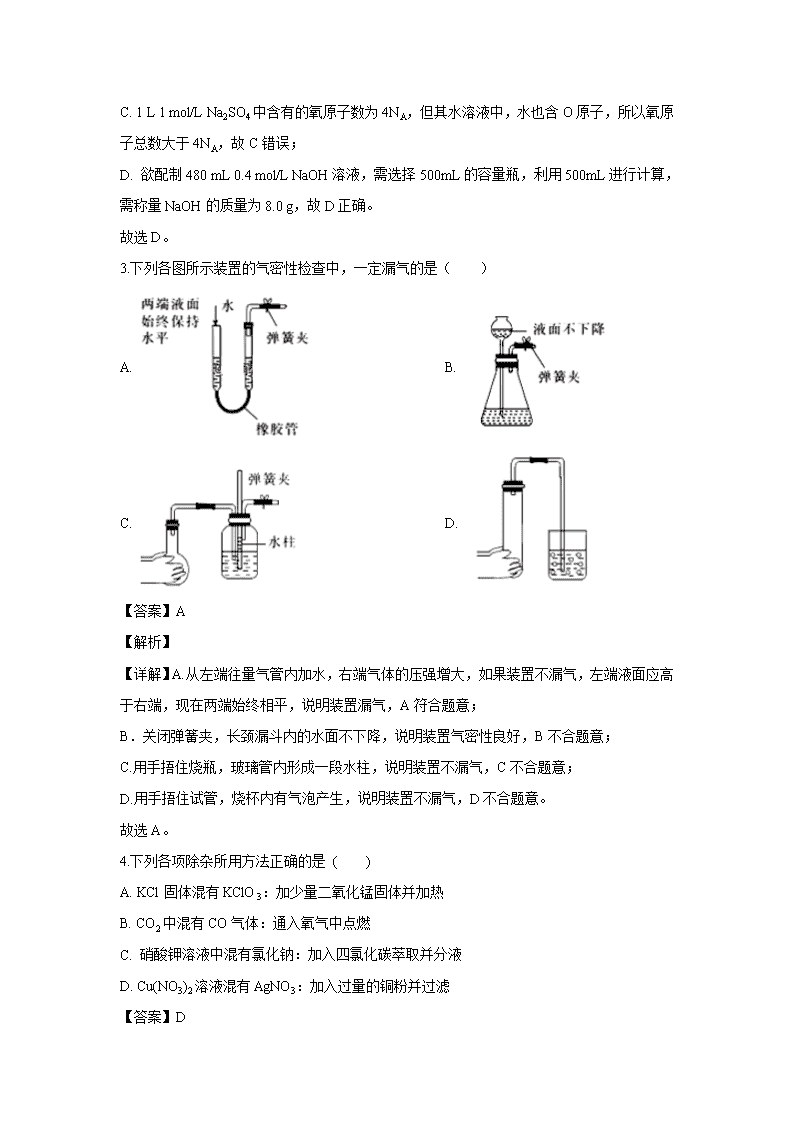
3.下列各图所示装置的气密性检查中,一定漏气的是( )
A. B.
C. D.
【答案】A
【解析】
【详解】A.从左端往量气管内加水,右端气体的压强增大,如果装置不漏气,左端液面应高于右端,现在两端始终相平,说明装置漏气,A符合题意;
B.关闭弹簧夹,长颈漏斗内的水面不下降,说明装置气密性良好,B不合题意;
C.用手捂住烧瓶,玻璃管内形成一段水柱,说明装置不漏气,C不合题意;
D.用手捂住试管,烧杯内有气泡产生,说明装置不漏气,D不合题意。
故选A。
4.下列各项除杂所用方法正确的是 ( )
A. KCl固体混有KClO3:加少量二氧化锰固体并加热
B. CO2中混有CO气体:通入氧气中点燃
C. 硝酸钾溶液中混有氯化钠:加入四氯化碳萃取并分液
D. Cu(NO3)2溶液混有AgNO3:加入过量的铜粉并过滤
【答案】D
【解析】A.加入二氧化锰,为反应的催化剂,引入新杂质,故A错误;B.含有少量CO,不易燃烧,可用灼热的CuO除杂,故B错误;C.氯化钠不溶于四氯化碳,可用重结晶的方法除杂,故C错误;D.铜可置换出银,同时生成硝酸铜,可用于除杂,故D正确;故选D。
5.在实验室用自来水制取蒸馏水的实验中,下列说法错误的是( )
A. 烧瓶中要放入碎瓷片以防止暴沸
B. 通过蒸馏可以除去自来水中含有Cl-等杂质
C. 冷凝水应该是下进上出,与水蒸气的流向相反
D. 开始蒸馏时,应先加热再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
【答案】D
【解析】
【详解】A. 为防止液体暴沸,加热前应在烧瓶中放入碎瓷片,A正确;
B. 蒸馏是利用沸点的差异,实现物质的分离,自来水中含有的Cl-等杂质构成的物质沸点高,不会随水一起蒸出,B正确;
C. 蒸气冷凝时,为确保冷凝效果,采用逆流原理,冷凝水应该是下进上出,与水蒸气的流向相反,C正确;
D. 开始蒸馏时,应先开冷凝水再加热;蒸馏完毕,应该先撤酒精灯再关冷凝水,D错误。
故选D。
6.下列哪种物质所含原子数与0.2 mol H3PO4所含原子数相等( )
A. 0.4 mol H2O2 B. 0.2 mol H2SO4
C. 0.9 mol NaCl D. 0.3 mol HNO3
【答案】A
【解析】
【详解】0.2 mol H3PO4所含原子数为1.6mol。
A. 0.4 mol H2O2所含原子数为1.6mol;
B. 0.2 mol H2SO4所含原子数为1.4mol;
C. 0.9 mol NaCl由离子构成,原子数为0;
D. 0.3 mol HNO3所含原子数为1.5mol;
故选A。
7.意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,N4
分子的结构如图所示,下列说法正确的是( )
A. N4属于一种新型的化合物
B. N4与N2的摩尔质量相等
C. 等质量的N4与N2所含的原子个数比为1∶1
D. 等质量的N4与N2所含的原子个数比为2∶1
【答案】C
【解析】
【详解】A. N4由一种元素组成,属于单质,不是化合物,A错误;
B. N4与N2的摩尔质量分别为56g/mol、28g/mol,B错误;
C. 等质量的N4与N2所含的原子个数比为,C正确;
D. 由C可知,等质量的N4与N2所含的原子个数比不为2∶1,D错误。
故选C。
8.下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同
②标准状况下,1gH2和14gN2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③ B. ④⑤⑥ C. ②③⑥ D. ②⑤⑥
【答案】D
【解析】
【详解】①标准状况下,H2O不是气态,无法计算其物质量,错误;
②标准状况下,1gH2和14gN2的物质的量都为0.5mol,体积相同,正确;
③28gCO的物质的量是1mol,没有告诉是标况,体积不一定是22.4L,错误;
④两种物质的物质的量相同,则它们在标准状况下的体积不一定相同,因为该物质的状态不一定是气体,错误;
⑤根据PV=nRT可知在同温同体积时,气体物质的物质的量越大,则压强越大,正确;
⑥根据阿伏加德罗定律及其推论可知同温同压下,气体的密度与气体的相对分子质量成正比,正确;
答案选D。
9.用10 mL0.1mol·L-1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、K2SO4和ZnSO4三种溶液中的SO42-完全转化为BaSO4沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A. 3∶2∶2 B. 1∶2∶3
C. 1∶3∶3 D. 3∶1∶1
【答案】C
【解析】
【分析】反应消耗BaCl2的物质的量相同,Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42-离子恰好完全转化为沉淀,则各溶液中硫酸根物质的量相等,据此确定Fe2(SO4)3、ZnSO4、K2SO4物质的量之比,因三种溶液的体积相同,则物质的量之比等于其浓度之比。
【详解】由题意知反应消耗BaCl2的物质的量相同,Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42-离子恰好完全转化为沉淀,设Fe2(SO4)3、ZnSO4、K2SO4三种物质的物质的量为x、y、z,则由Ba2++ SO42-=BaSO4↓可知:3x=y=z,则x:y:z=1:3:3,因三种溶液的体积相同,则物质的量之比等于其浓度之比,即浓度之比为1:3:3;故选:C。
10.将质量均为a g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(p)与温度(T)的关系如下图所示,则X、Y气体可能分别是( )
A. C2H4、CH4 B. CO2、Cl2 C. SO2、CO2 D. CH4、Cl2
【答案】B
【解析】
【分析】根据PV=nRT可知,在质量相同、体积相同的条件下,气体的相对分子质量与压强成反比,据此分析解答。
【详解】由图可知,温度相同时P(氧气)>P(X)>P(Y),根据PV=nRT可知,在质量相同、体积相同的条件下,气体的相对分子质量与压强成反比,则相对分子质量越大,压强越小,即X、Y的相对分子质量大于32,且Y的相对分子质量大于X,所以符合条件的只有B;
答案选B。
二、选择题(本题共10道小题,每小题3分,共30分)
11.VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
【答案】D
【解析】
【详解】Fe3+的物质的量为m/56 mol,Fe3+和SO42-的物质的量之比为2:3,即SO42-的物质的量为3m/112 mol,因此硫酸根离子的浓度为3m/112V mol·L-1,故选项D正确。答案选D。
12.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA
B. 常温常压下,22.4LCl2中含有的分子数为NA
C. 1L1mol/LK2SO4溶液中含有的钾离子数为NA
D. 1mol钠变为Na+失去的电子数为11NA
【答案】A
【解析】
【详解】A. 6.4g氧气和臭氧可以看做6.4g氧原子,即为0.4mol氧原子,所以混合气体中含有的原子总数为0.4NA,故A选;
B. 常温常压下,22.4LCl2的物质的量不是1mol,故B不选;
C. 1L1mol/LK2SO4溶液中含有的钾离子数为2NA,故C不选;
D. 1mol钠变为Na+失去的电子数为NA,故D不选。
故选A。
13.在标准状况下,将a L A气体(摩尔质量是M g/mol)溶于0.1L水中,所得溶液的密度为b g/cm3,则此溶液的物质的量浓度为( )
A. B.
C. D.
【答案】B
【解析】
【分析】根据n=来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V=来计算溶液的体积,最后利用c=来计算该溶液的物质的量浓度。
【详解】标准状况下,气体的物质的量为n=,气体的质量m=×Mg/mol=g,溶剂水的质量为m(H2O)=100mL×1g/mL=100g,即溶液的质量为g,则溶液的体积为=L,故该溶液的物质的量浓度为c= ,故合理选项是B。
14.在一定温度下有分解反应A(固)=B(固)+C(气)+4D(气).若测得生成的气体的质量是同温同压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为( )
A. 252g/mol B. 182.4g/mol C. 120.4g/mol D. 50.4g/mol
【答案】A
【解析】
【详解】生成的气体在标况下的体积为22.4L时,气体总物质的量为1moL,根据A(s)=B(s)+C(g)+4D(g),生成气体的物质的量之比为1:4,所以C(g)的物质的量为0.2mol,则反应掉A(s)的物质的量为0.2mol;因为测得生成的气体的质量是同温同压下,相同体积氢气的10倍,所以气体质量为20g,根据质量守恒定律,参加反应的A的质量为20+30.4=50.4g,摩尔质量为:50.4g÷0.2mol=252g/mol。故答案选A。
15.下列说法不正确的是( )
A. 硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B. 6.02×1023个N2和6.02×1023个O2的质量比等于7∶8
C. 3.2 g O2所含原子数目约为0.2×6.02×1023
D. 常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g
【答案】D
【解析】
【详解】A.摩尔质量是指1mol物质的质量,硫酸的摩尔质量为98g/mol,6.02×1023个磷酸分子为1mol,1mol磷酸的质量为98g,则硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等,故A正确;
B.6.02×1023个氮气分子和6.02×1023个氧气分子的物质的量都为1mol,质量分别为1mol×28g/mol=28g、1mol×32g/mol=32g,所以6.02×1023个氮气分子和6.02×1023个氧气分子的质量比等于7:8,故B正确;
C.3.2g氧气的物质的量为0.1mol,1个氧气分子中含2个O原子,所以3.2g氧气所含的原子数目为0.2×6.02×1023,故C正确;
D.常温常压下,0.5×6.02×1023个二氧化碳分子的物质的量为0.5mol,质量=0.5mol×44g/mol=22g,故D错误。
故选D。
16.若以w1和w2分别表示物质的量浓度为c1 mol/L和c2 mol/L H2SO4溶液的质量分数,且2w1=w2,则下列推断正确的是( )
A. 2c1=c2 B. 2c2=c1 C. c1
2c1
【答案】D
【解析】等质量上述两种硫酸溶液,由于2w1=w2,所以溶质质量2m1=m2,溶质的物质的量2n1=n2,而且溶液密度ρ1<ρ2,溶液体积V1>V2,因此,溶液物质的量浓度2c1< c2,故选D。
17.在体积为V L的密闭容器中通入a mol CO和b mol O2,点燃充分反应后容器内碳原子数和氧原子数之比为( )
A. a:2b
B. a:(a+2b)
C. a:2(a+b)
D. 无法确定
【答案】B
【解析】试题分析:根据质量守恒,点燃充分反应后容器内碳原子数和氧原子数之比为a : (a+2b),故B正确。
18.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A. 体积相等时密度相等 B. 原子数相等时具有的中子数相等
C. 体积相等时具有的电子数相等 D. 质量相等时具有的质子数相等
【答案】C
【解析】
【详解】A、根据阿伏加德罗定律,物质的量相等,因为摩尔质量不相等,则质量不等,根据密度的定义,密度不相等,故错误;
B、两者都是双原子分子,原子数相等,则物质的量相等,前者中子数为16,后者为14,则中子数不等,故错误;
C、根据阿伏加德罗定律,两者物质的量相等,前者电子为14,后者为14,因此等物质的量时,两种物质所含电子数相等,故正确;
D、质量相等,两种物质的摩尔质量不等,则物质的量不相等,质子数不相等,故错误。
19.某工业废气所含氮氧化物(NOx)的氮氧质量比为7:4,则该NOx可表示为( )
A. N2O B. NO C. N2O3 D. NO2
【答案】A
【解析】
【详解】依题意,,x=,从而得出其化学式为N2O。
故选A。
20.在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量为( )
A. 16 B. 32 C. 64 D. 72
【答案】C
【解析】
【详解】设瓶重为w,瓶内气体的物质的量为x,则有① 36=w+32x ,②42=w+44x解以上方程组,求出w=20g,x=0.5mol,则M(A)=, A的相对分子质量为64,故选C。
第II卷(非选择题)
三、填空题
21. 已知:①标准状况下,1体积水中最多能溶解500体积的HCl;
②饱和NaCl溶液的浓度约为5.00 mol·L-1。
在标准状况下,将448LHCl气体溶于1 L水中,所得溶液A的密度为1.20 g·cm-3,则溶液A中HCl的物质的量浓度为 。(本题计算结果均取三位有效数字)
(1)若使Cl-浓度与溶液A中的Cl-浓度相等,则在1 L NaCl饱和溶液中还应溶解约 L标准状况下HCl气体 (溶液体积变化忽略不计)。
(2)取10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为 。
(3)在溶液B的配制过程中,使用前必须检查是否漏液的仪器有 ;下列配制操作,造成溶液B浓度偏低的是_______________(选填序号)。
a.容量瓶用蒸馏水洗涤后未干燥
b.量取溶液A的量筒用蒸馏水洗涤后未干燥
c.定容时,俯视液面加水至刻度线
d.加水定容时液面不慎超过刻度线,立即用胶头滴管吸出部分水使液面刚好达刻度线
e.烧杯中溶液移入容量瓶后,未用水洗涤烧杯和玻璃棒即定容
【答案】13.9 mol·L-1(未带单位扣1分)(2分)
(1) 199(1分) (2)0.278 mol·L-1(未带单位扣1分)(2分)
(3)容量瓶(或容量瓶、滴定管)(1分) bde(3分,每个1分,错一个扣1分)
【解析】试题分析:c(HCl)=448L÷22.4L/mol÷[(448L÷22.4L/mol×36.5g/mol+1000g)
÷1200g/L]=13.9mol•L‾1。
(1)还应加入HCl:(13.9mol-5.00mol)×22.4L/mol=199L。
(2)溶液B的物质的量浓度为:0.01L×13.9mol/L÷0.5L="0.278" mol·L-1。
(3)容量瓶必须检查是否漏液;a、容量瓶用蒸馏水洗涤后未干燥,不影响配制溶液的浓度;b、量取溶液A的量筒用蒸馏水洗涤后未干燥,使溶质减少,造成溶液B浓度偏低;c、定容时,俯视液面加水至刻度线,使溶液的体积变大,造成溶液B浓度偏高;d、加水定容时液面不慎超过刻度线,立即用胶头滴管吸出部分水使液面刚好达刻度线,造成溶液B浓度偏低;e、烧杯中溶液移入容量瓶后,未用水洗涤烧杯和玻璃棒即定容,使溶质减少,造成溶液B浓度偏低;故答案为bde。
22.某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。
(1)该同学应选择____ mL的容量瓶。
(2)其操作步骤如图所示,则图中操作应在下图中的____(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体_____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会______(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会_______③溶液未冷却就转移入容量瓶____________
【答案】(1). 500 (2). C (3). 10.0 (4). cd (5). c (6). 偏小 (7). 无影响 (8). 偏大
【解析】
【分析】(1)实验室没有480mL规格的容量瓶,该同学应选择规格稍大的容量瓶。
(2)图中操作应是定容操作中往容量瓶内加水至液面离刻度线1~2cm处。
(3)该同学应称取NaOH固体0.5L×0.5mol/L×40g/mol=10.0g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,应选取所需砝码30g,游码位置3.1g。
(4)①转移完溶液后未洗涤玻璃棒和烧杯,溶质减少;
②容量瓶中原来有少量蒸馏水,溶质未变,溶液体积未变;
③溶液未冷却就转移入容量瓶,将导致溶液体积减小。
【详解】(1)实验室没有480mL规格的容量瓶,该同学应选择500mL的容量瓶,故答案为:500;
(2)图中操作应是定容操作中往容量瓶内加水至液面离刻度线1~2cm处,即选C,故答案为:C;
(3)该同学应称取NaOH固体0.5L×0.5mol/L×40g/mol=10.0g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,应选取所需砝码30g,游码位置3.1g,故答案为:10.0;cd;c;
(4)①转移完溶液后未洗涤玻璃棒和烧杯,溶质减少,溶质的物质的量浓度减小,即浓度偏小,故答案为:偏小;
②容量瓶中原来有少量蒸馏水,溶质未变,溶液体积未变,浓度不变,故答案为:无影响;
③溶液未冷却就转移入容量瓶,将导致溶液体积减小,浓度偏大,故答案为:偏大。
23.(1)CaCO3质量分数为0.90的石灰石100 kg完全分解产生CO2________L(标准状况),石灰窑中该石灰石100 kg与焦炭焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的质量为__________g
(2)在25℃、101kPa的条件下,同质量的CH4和X气体的体积之比为15:8,则X的摩尔质量是_______________。
(3)两个相同体积的密闭容器X、Y,在25℃下,X中充入a gA气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量是_______________。
【答案】(1). 20160 (2). 4800 (3). 30g/mol (4). 44g/mol
【解析】
【分析】(1) n(CaCO3)=,利用CaCO3——CO2
可求出CaCO3完全分解产生CO2的体积;n(CO2)=,n(CaCO3)=900mol,则焦炭燃烧生成CO2物质的量为1300mol-900mol=400mol,从而求出焦炭的质量。
(2)利用阿伏加德罗定律的推论,气体的物质的量之比等于其体积比,建立等量关系式,从而求出X的摩尔质量。
(3)利用阿伏加德罗定律的推论,气体的物质的量之比等于其压强比,建立等量关系式,从而求出A的摩尔质量。
【详解】(1) n(CaCO3)=,利用CaCO3——CO2可求出CaCO3完全分解产生CO2的体积,V=900mol×22.4L/mol= 20160L;
n(CO2)=,n(CaCO3)=900mol,则焦炭燃烧生成CO2物质的量为1300mol-900mol=400mol,从而求出焦炭的质量为400mol×12g/mol=4800g,故答案为:20160;4800;
(2)利用阿伏加德罗定律的推论:气体的物质的量之比等于其体积比
设气体的质量都为1g,X的摩尔质量为M
则,从而求出M=30g/mol,故答案为:30g/mol;
(3)利用阿伏加德罗定律的推论,气体的物质的量之比等于其压强比
设A的摩尔质量为y
则,求出y=44g/mol,故答案为:44g/mol。
24.掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
(1)写出下列仪器的名称:
①_____________②________________,④______________________
(2)仪器①~④中,使用时必须检查是否漏水的是_______________________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器________________,将仪器补充完整后进行的实验操作的名称为______________②的进水口是____________(填“f”或“g”)。
(4)现需配制250mL、0.2mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:_____________________
【答案】(1). 蒸馏烧瓶 (2). 冷凝管 (3). 容量瓶 (4). ④ (5). 温度计 (6). 蒸馏 (7). g (8). 未用玻璃棒引流;未采用250ml容量瓶
【解析】
【分析】(1)下列仪器的名称:①蒸馏烧瓶,②冷凝管,④容量瓶
(2)容量瓶是配制一定物质的量浓度溶液的精密度较高的仪器,在使用前,需检查其是否漏液。
(3)分离酒精和水的混合物,采用的操作方法为蒸馏,对照蒸馏装置可确定装置Ⅰ还缺少的仪器;冷凝管中,时刻要确保冷却水的充满。
(4)配制250mLNaCl溶液,首先考虑选择250mL的容量瓶,其次还应有烧杯、玻璃棒、胶头滴管等,对照检查,便可确定缺少的仪器。
【详解】(1)①蒸馏烧瓶 ②冷凝管 ④容量瓶,故答案为:蒸馏烧瓶;冷凝管;容量瓶;
(2)仪器①~④中,使用时必须检查是否漏水的是容量瓶,故答案为:④;
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器为温度计,将仪器补充完整后进行的实验操作的名称为蒸馏;②的进水口是g,故答案为:温度计;蒸馏;g;
(4)装置Ⅱ图中的错误操作:未用玻璃棒引流;未采用250ml容量瓶,故答案为:未用玻璃棒引流;未采用250ml容量瓶。
25.(1)某溶液中含有SO42--、CO32--、Cl--,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
材料一、(见图)
材料二、
物质
熔点/℃
沸点/℃
密度/g·cm-3
溶解性
乙二醇( C2H6O2)
-11.5
198
1.11
易溶于水和乙醇
丙三醇(C3H8O3)
17.9
290
1.26
能跟水、酒精以任意比互溶
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
【答案】(1). HNO3 (2). CO32- (3). Ba(NO3)2 (4). SO42- (5). AgNO3 (6). Cl- (7). C (8). A
【解析】
分析】(1)检验SO42-,需使用Ba2+;检验CO32-,需使用H+;检验Cl-,需使用Ag+。
(3)从曲线图中可以看出,氯化钠和纯碱都是易溶于水盐,二者的溶解度受温度的影响不同,可通过改变温度,将纯碱分离出来。
(4)乙二醇和丙三醇是沸点相差较大的两种有机物,可利用沸点的差异,将二者分离开来。
【详解】(1)由前面的分析可知,将SO42-、CO32-、Cl--分离开来,必须先检验CO32-,再检验SO42-,最后检验Cl-。
①先加入HNO3,检验CO32-,故答案为:HNO3;CO32-;
②然后加入Ba(NO3)2,检验SO42-,故答案为:Ba(NO3)2;SO42-;
③最后加入AgNO3,检验Cl-,故答案为: AgNO3;Cl-;
(2) ①从溶解度曲线看,氯化钠和纯碱的溶解度受温度影响不同,最好应用结晶法提取纯碱,故答案为:C;
②从表中数据看,乙二醇和丙三醇的沸点相差较大,可利用蒸馏法分离,故答案为:A。
26.现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)一个X原子的质量_________g。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
(5)该气体溶于1L水中(不考虑反应),所得溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(6)相同状况下,若X2与氮气以体积比1:4混合,该混合气体相对氢气密度为14.4,X2的相对分子质量为_______。
(7)若标况下X2的密度为1.25 g/L,X原子最外层有_____个电子。
【答案】(1). (2). (3). (4). (5). (6). 32 (7). 5
【解析】
【详解】(1)mg该气体的物质的量 ;(2)设该气体为1mol,则一个分子的质量== ,而该分子是双原子分子,故一个X原子质量=g ;(3)标况下,该气体的体积=L ;(4)c==mol/L;(5)1L水的质量=1L×1000g/L=1000g,所得溶液质量=1000g +mg,溶液的体积=m(溶液)/ ρg/cm3×10—3L,c==(6)相同状况下,若X2与氮气以体积比1:4混合,则X2与氮气的物质的量比为1:4,由于气体的密度之比等于其相对分子质量之比,则混合气体的平均相对分子质量为14.4×2=28.8,,则 ,X2
的相对分子质量为32;(7)若标况下X2的密度为1.25 g/L,X2的相对分子质量=1.25 g/L×22.4L/mol28,X的相对原子质量为14,猜测为氮原子,氮原子最外层电子数为5。