- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省张家口市第一中学高一下学期开学考试化学试题(衔接班)
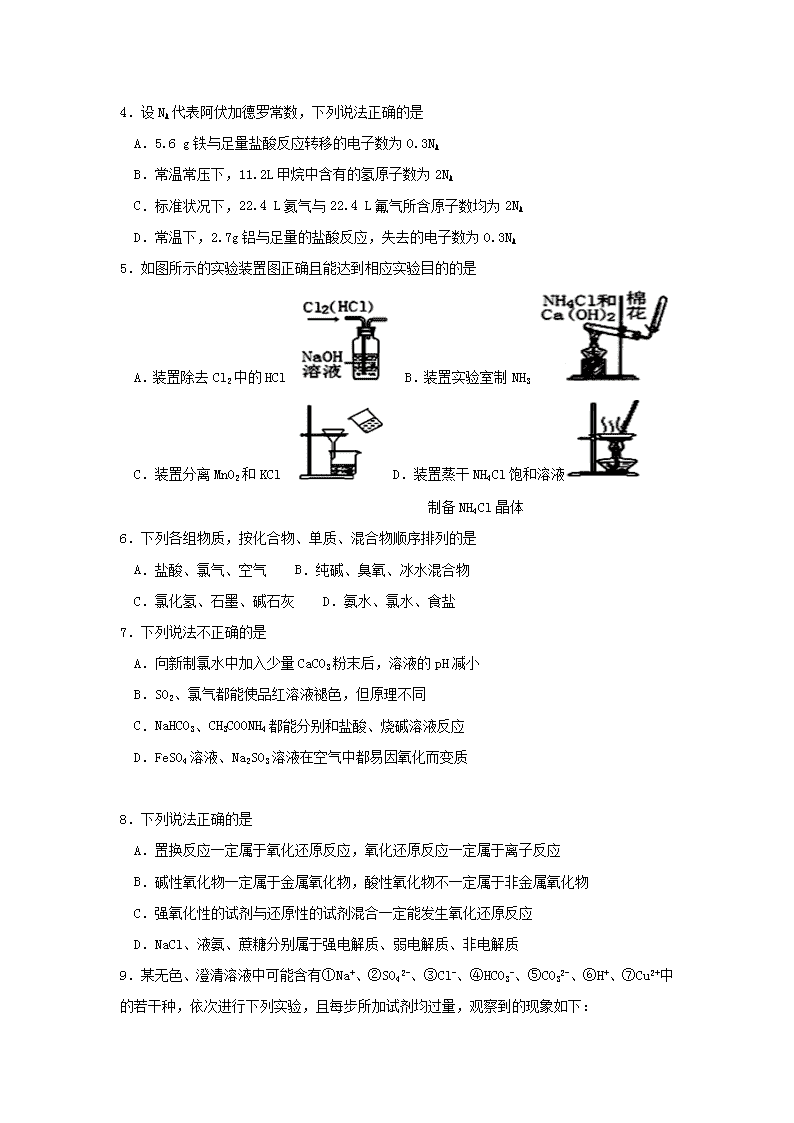
2018-2019学年河北省张家口市第一中学高一下学期开学考试化学试题(衔接班) 考试时间:60分钟 总分:100分 可能用到的相对原子质量:H :1 Cu:64 Fe:56 Cl:35.5 N:14 O:16 S:32 Na︰23 一、选择题 (每个小题只有一个选项符合题意,每小题3分,共20小题,共60分) 1.黑火药是硫磺粉、硝石、木炭粉按一定比例混合而成。古文献《本草经集注》记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”。下列推断不正确的是 A.“紫青烟”主要是指钾元素的焰色反应 B.“朴消”在灼烧时火焰没有颜色 C.“硝石”在黑火药中起氧化剂的作用 D.“朴消”不能替代“硝石”制黑火药 2.下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是 A.标签上离子的浓度是物质的量浓度 B.由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶 C.该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L D.一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol 3.以下关于化学实验中“先与后”的说法中正确的是 ①加热试管时,先均匀加热,后局部加热 ②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管后撤酒精灯 ③制取气体时,先检查装置气密性后装药品 ④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃 ⑤做H2还原CuO实验时,先通H2后加热CuO反应完毕后,先撒酒精灯待试管冷却后停止通H2 ⑥使用托盘天平称量物体质量时,先放质量较小的砝码,后放质量较大的砝码 A.①②③⑤ B.①②④⑤⑥ C.①②③④⑤ D全部 4.设NA代表阿伏加德罗常数,下列说法正确的是 A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA B.常温常压下,11.2L甲烷中含有的氢原子数为2NA C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA 5.如图所示的实验装置图正确且能达到相应实验目的的是 A.装置除去Cl2中的HCl B.装置实验室制NH3 C.装置分离MnO2和KCl D.装置蒸干NH4Cl饱和溶液 制备NH4Cl晶体 6.下列各组物质,按化合物、单质、混合物顺序排列的是 A.盐酸、氯气、空气 B.纯碱、臭氧、冰水混合物 C.氯化氢、石墨、碱石灰 D.氨水、氯水、食盐 7.下列说法不正确的是 A.向新制氯水中加入少量CaCO3粉末后,溶液的pH减小 B.SO2、氯气都能使品红溶液褪色,但原理不同 C.NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应 D.FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质 8.下列说法正确的是 A.置换反应一定属于氧化还原反应,氧化还原反应一定属于离子反应 B.碱性氧化物一定属于金属氧化物,酸性氧化物不一定属于非金属氧化物 C.强氧化性的试剂与还原性的试剂混合一定能发生氧化还原反应 D.NaCl、液氨、蔗糖分别属于强电解质、弱电解质、非电解质 9.某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下: 步骤 操作 现象 (1) 用紫色石蕊试液检验 溶液变红 (2) 向溶液中滴加BaCl2和稀HC1 有白色沉淀生成 (3) 将(2)中所得混合物过滤,向滤液中加入 AgN03溶液和稀HN03 有白色沉淀生成 下列结论正确的是 A.肯定含有的离子是②③⑥ B.该实验无法确定是否含有③ C.可能含有的离子是①③⑦ D.肯定没有的离子是④⑤,可能含有的离子是② 10.已知反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应: (1)2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 (2)2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 下列说法正确的是 A.两个反应中NaHSO4均为氧化产物 B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物 C.氧化性:MnO2>SO42->IO3->I2 D.反应(1)、(2)中生成等量的I2时转移电子数之比为1: 5 11.如下图所示,室温下的两个连通刚性容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应且恢复至室温,反应如下:2NO+O2=2NO2。不考虑NO2转化为N2O4,下列判断正确的是 A.反应前后左室的压强相同 B.反应后容器内的密度与反应前的相同 C.开始时左右两室中的分子数相同 D.反应后容器内无O2存在 12 .纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的说法正确的是 A.分别用坩埚加热两种样品,全部分解挥发,没有残留物的是小苏打 B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化的是小苏打 C.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生气泡速率较快的是小苏打 D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打 13.下列逻辑关系图示中一定正确的是 A B C D 14.常温下,下列各组离子一定可以大量共存的是 A.强碱性溶液中:Na+、HCO3-、SO32-、K+ B.含大量Ca2+的溶液:Cl-、Na+、CO32-、NO32- C.pH>7的溶液中:Mg2+、Br-、K+、Al3+ D.加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ 15.下列实验不能达到目的的是 A.用Na2O2与水反应制氧气 B.用Cl2与Ca(OH)2反应制备漂粉精 C.向某无色溶液中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,以证明原溶液中含有SO42- D.向某溶液加入NaOH并微热,产生使湿润的红色石蕊试纸变蓝的气体,以证明原溶液中有NH4+ 16.下列实验操作、实验现象、解释或结论不对应的是 选项 实验操作 实验现象 解释或结论 A 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨气与氯化氢反应生成固体物质 B 常温下,将洁净的铁片放入浓硫酸 或浓硝酸中 无明显变化 常温下,浓硫酸、浓硝酸使铁片钝化 C 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 产生苍白色火焰 物质燃烧不一定需要氧气 D 向某无色溶液中滴加盐酸 产生能使澄清石灰水变浑浊气体 说明溶液中一定含有CO32- 17. 短周期主族元素A、B、C、D,原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是 A.原子半径:A<B<C<D B.非金属性:A<C C.最高价氧化物对应水化物的酸性: D>C D.单质B常温下能溶于浓硝酸 18.下列说法正确的是 ①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子质子数和中子数一定为6 ④IA族和IIA族的元素全部是金属元素 ⑤元素周期表有7个周期、16个纵行 A.② B.①③⑤ C.①②⑤ D.③④ 19.某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是 A.一定存在HCl B.一定存在SO2 C.肯定没有CO2 D.不能肯定是否含有HI 20.在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是 方法 现象 结论 A 观察氯水颜色 氯水呈黄绿色 氯水中含Cl2 B 向饱和NaHCO3溶液中加入足量氯水 有无色气体产生 氯水中含HClO C 向红色纸条上滴加氯水 红色纸条褪色 氯水具有漂白性 D 向FeCl2溶液中滴加氯水 溶液变成棕黄色 氯水具有氧化性 二、填空题(共3小题,共40分) 21.(16分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO 提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。 (1)若假设1成立,则实验现象是 。 (2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 ) 。 (3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是 ,写出发生反应的离子方程式 、 、 。 探究延伸: (4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。 22.(10分)中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。 (1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________, a.SO2 b.NOx c.VOCs d. NH3 (2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。 (3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。 SO2性质梳理 化学方程式 物质类别 酸性氧化物 ①SO2 +H2O H2SO3 ②SO2 + CaO = CaSO3 ③_______________________ S元素价态 S为+4价 ①_______________________ ② SO2 + 2H2S = 3S + 2H2O (4)科学家经过研究发现中国雾霾呈中性,其主要原因如图所示: 请判断A的化学式并说明判断理由:______________________。 23.(14分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。 (1)NaN3是气体发生剂,其中N的平均化合价为________,是_____________(用“电解质”或者“非电解质”填空)。NaN3受热分解产生N2和Na,则该反应方程式为: ________。已知常温常压下气体摩尔体积为24.5L/mol,则在常温常压下,反应130g NaN3能产生 _____________L的N2。 (2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________________(已知该反应为置换反应)。若已知2.3gNa完全反应,转移的电子物质的量为____________。 (3)KClO4是助氧化剂,反应过程中与Na作用生成KC1和Na2O,请用单线桥表示该反应电子转移:KClO4+8Na= KCl+4Na2O_____________________ 答案:1-5BCCDB 6-10CABBD 11-15 BCDDC 16-20DCABB 填空题每空2分 21.16分 (1)溶液变为红色 (2)不合理 Cu能将Fe3+还原为Fe2+ (3)Fe2O3和Cu2O的混合物 Fe2O3+6H+= 2Fe3++3H2O ; Cu2O+2H+ = Cu + Cu2+ + H2O 2 Fe3+ + Cu = 2 Fe2+ + Cu2+ (4) 22.10分(1)a (2)2NO+O2=2NO2 (3) SO2+2NaOH=Na2SO3+H2O 2SO2+O22SO3 (4)SO42- ,因为反应之前S为+4价,N为+4价,反应之后HONO中N元素的价态为+3价,氮元素化合价降低,必有元素化合价升高,综合推断,应是S元素化合价升高:从+4升高到+6价,在液相应以SO42-形式存在 23.14分(1) 1/3 电解质 2NaN32Na+3N2↑ 73.5 (2) Fe 0.1mol (3) 查看更多