【化学】广东省揭阳市揭西县河婆中学2020届高三下学期综合测试(三)
广东省揭阳市揭西县河婆中学2020届高三下学期综合测试(三)
7.化学与生产、生活密切相关,下列说法不正确的是( )
A.用报纸包装食物属于资源的充分利用,应该提倡
B. 是矿泉水瓶、饮料瓶底的常见标志,表示可回收利用,只能一次性使用,不能长期使用
C.具有吸水性的植物纤维加工后可用作食品干燥剂
D.防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
8、设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2mol FeI2与足量氯气反应时转移电子数为0.4NA
B.常温常压下,46g NO2和N2O4混合气体含有的原子数为3NA
C.标准状况下,2.24LCCl4含有的共价键数为0.4NA
D.常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
9. 的分子式均为C5H6,下列有关叙述正确的是( )
A.符合分子式为C5H6的同分异构体只有a、b、c三种
B.a、b、c的一氯代物都只有三种
C.a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D.a、b、c分子中的5个碳原子一定都处于同一个平面
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,常温下,0.1 mol·L-1 M的水溶液中=
1.0×10-12。下列说法正确的是( )
A.简单离子半径:Y
Z>W
D.Z分别与X、W均可形成具有漂白性的化合物
11.钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )
A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(Ⅱ)和Mn(Ⅱ)
C.操作Ⅱ是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
12.中国科学家用毛笔书写后的纸张作为空气电极,设计并组装了轻型、柔性且可折叠的可充电锂空气电池(图1),电池的工作原理如图2。下列有关说法正确的是( )
A.放电时,纸张中的纤维素作锂电池的正极
B.放电时,Li+由正极经过有机电解质溶液移向负极
C.开关K闭合给锂电池充电,X为直流电源正极
D.充电时,阳极的电极反应为Li2O2-2e-===O2↑+2Li+
13.室温下用0.1 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.1 mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法正确的是( )
A.导电能力:a点溶液c(B-)
C.a点溶液中由水电离出的c(H+)约为3×10-13 mol·L-1
D.HA对应曲线上c点溶液呈碱性的原因是A-+H2OHA+OH-
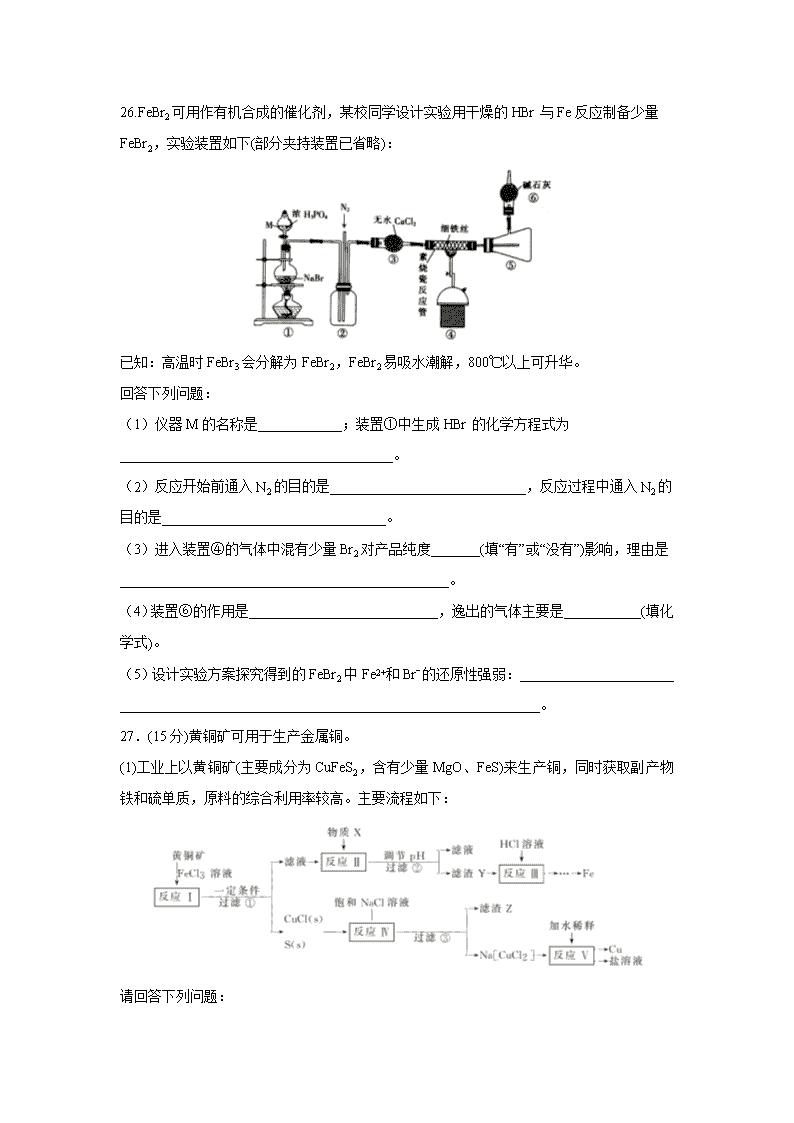
26.FeBr2可用作有机合成的催化剂,某校同学设计实验用干燥的HBr与Fe反应制备少量FeBr2,实验装置如下(部分夹持装置已省略):
已知:高温时FeBr3会分解为FeBr2,FeBr2易吸水潮解,800℃以上可升华。
回答下列问题:
(1)仪器M的名称是____________;装置①中生成HBr的化学方程式为_______________________________________。
(2)反应开始前通入N2的目的是____________________________,反应过程中通入N2的目的是________________________________。
(3)进入装置④的气体中混有少量Br2对产品纯度_______(填“有”或“没有”)影响,理由是_______________________________________________。
(4)装置⑥的作用是___________________________,逸出的气体主要是___________(填化学式)。
(5)设计实验方案探究得到的FeBr2中Fe2+和Brˉ的还原性强弱:______________________
____________________________________________________________。
27.(15分)黄铜矿可用于生产金属铜。
(1)工业上以黄铜矿(主要成分为CuFeS2,含有少量MgO、FeS)来生产铜,同时获取副产物铁和硫单质,原料的综合利用率较高。主要流程如下:
请回答下列问题:
①反应Ⅰ中FeCl3作________(选填“氧化剂”或“还原剂”);滤渣Z为________(填化学式)。
②物质X最好选用________(选填相应的字母)。
A.KMnO4 B.HNO3 C.H2O2
③已知几种常见离子沉淀时的pH如下表所示,调节pH获取滤渣Y时,pH的取值范围是________≤pH<________。
沉淀物
开始沉淀的pH
沉淀完全的pH
Fe(OH)3
2.7
3.5
Fe(OH)2
7.6
9.6
Mg(OH)2
9.5
11.1
注:Fe(OH)2为絮状沉淀,不易从溶液中除去
④常温下,某氢氧化镁悬浊液pH=8.5,此溶液中Mg2+浓度为________________mol·L-1。(常温下,Mg(OH)2的Ksp=1.8×10-11)
(2)实验室改进上述工艺方法,将黄铜矿精矿粉碎后采用如图装置进行电化学浸出实验来制取铜:
①硫酸铁与稀硫酸的混合液和黄铜矿粉反应的化学方程式为:CuFeS2+4H+===Cu2++Fe2++2H2S↑,生成的硫化氢气体被硫酸铁氧化而除去,除去硫化氢气体的离子方程式为________________________________________________________________________。
②选择性离子交换膜只允许________(填离子符号)通过。电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_______________________(用电极反应式表示)。
28.氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ・mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJ・mol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJ・mol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJ・mol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图
①已知T2>T1,则反应2NO(g)+2CO(g)N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=_ __________,该温度下用分压表示的平衡常数Kp= ____________MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是________________。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是_____________________
_____________________________。
36.化合物F是一种药物合成的中间体,F的一种合成路线如下:
已知:
(1) 的名称为____________________。
(2)D中含氧官能团的名称为____________________。
(3)B→C的反应方程式为________________________________________。
(4)D→E的反应类型为________________。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____________。
(6)依他尼酸钠()是一种高效利尿药物,参考以上合成路线中的相关信息,设计以 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________________________________________________
【参考答案】
题号
7
8
9
10
11
12
13
答案
A
B
C
D
D
D
C
26、(1)分液漏斗 (2). NaBr+H3PO4NaH2PO4+HBr↑ (3). 隔绝空气(或将装置中的空气排尽) (4). 稀释HBr并将其载入后续装置 (5). 没有 (6). 生成的少量FeBr3 在高温下会分解为FeBr2 (7). )除去尾气中的HBr等酸性气体并防止空气中水蒸气进入装置⑤ (8). H2和N2 (9). 取少量产品溶于经过煮沸再冷却后的蒸馏水,取溶液少许,滚入KSCN并加入CCl4,滴入氯水,轻轻振荡,观察现象(或其它合理答案)
27、(1)①氧化剂(1分) S(1分) ②C(2分) ③3.5(1分) 9.5(1分) ④1.8(2分)
(2)①2Fe3++H2S===2Fe2++S↓+2H+(3分)
②Cu2+(2分) Fe2+-e-===Fe3+(2分)
28、 (1). -244.1 (2). < (3). bc (4). 0.025 mol·L-1·min-1 (5). 4/45(或0.089) (6). A (7). 催化剂活性随温度升高而增大,使NOx去除反应速率迅速增大;温度升高,反应速率加快 (8). 催化剂活性下降(或NH3与O2反应生成了NO)
36、(1). 2-氯丙酸 (2). 羧基、醚键 (3). (4). 取代反应 (5). 5 (6).
(7).