河北省张家口市宣化第一中学2020届高三上学期月考考试化学试卷
化学试卷
一、单选题(本大题共7小题,共42.0分)
1. 化学知识无处不在,下列与古诗文记载对应的化学知识不正确的是( )
常见古诗文记载
化学知识
A
绿蚁新醅酒,红泥小火炉
在酿酒的过程中,葡萄糖发生了水解反应
B
南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。
泥土具有吸附作用,能将红糖变白糖
C
陶成雅器,有素肌、玉骨之象焉
制陶的主要原料是黏土,烧制陶瓷属硅酸盐工业
D
釆蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如“石”,浣衣发面
“石”即石碱,具有碱性,遇酸产生气体
A. A B. B C. C D. D
2. NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 18g D2O和18g H2O中含有的质子数均为10NA
B. 1L 0.1mol⋅L-1磷酸(H3PO4)溶液中含有的H+离子数为0.3NA
C. 40g34%的过氧化氢催化分解,生成0.1mol氧气时转移的电子数为0.2NA
D. 密闭容器中1mol NO与0.5mol O2充分反应,产物的分子数为NA
3. 短周期主族元素A、B、C、D的原子序数依次增大,A、D同主族且D原子核电荷数等于A原子核电荷数的2倍,B、C原子的核外电子数之和与A、D原子的核外电子数之和相等。下列说法中一定正确的是( )
A. B的原子半径比A的原子半径小
B. A形成的氢化物分子中不可能含非极性键
C. B单质与水反应,水可能作氧化剂也可能作还原剂
D. C、D的最高价氧化物对应的水化物是酸
4. 有Fe2+、Fe3+、H+、NH4+、NO3-和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A. 被氧化和被还原的离子数目比为8:1
B. 该反应说明Fe2+、NO3-、H+在溶液不能大量共存
C. 每1mol NO3-发生氧化反应,转移8mol e-
D. 若利用该反应设计原电池,则负极反应为:Fe2+-e-=Fe3+
5. 以下实验设计能达到实验目的的是( )
选项
实验目的
实验设计
A
证明非金属性强弱:Cl>C>Si
B
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
C
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
D
证明相同温度下:Ksp(Ag2S)
C,再者盐酸挥发,无洗气装置,故A错误;
B.氯水与NaBr和KI反应分别生成Br2、I2,两者都易溶于CCl4,分别在CCl4层中显橙红色、紫红色,故B正确;
C.NaHCO3受热易分解,而Na2CO3受热不易分解,故C错误;
D.硝酸银与氯化钠反应,硝酸银过量,硫化钠与溶液中的银离子直接反应,不能比较溶度积大小,故D错误;
故选:B。
A.盐酸易挥发,与硅酸钠反应,且盐酸为无氧酸;
B.氯水可与NaBr反应生成溴,与KI反应生成碘,在四氯化碳中颜色不同;
C.加热碳酸氢钠分解;
D.硝酸银过量,均为沉淀生成。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、沉淀生成、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
6.【答案】D
【解析】解:A.单糖、低聚糖不属于高分子化合物,故A错误;
B.CH3CH(CH3)CH2COOH正确命名:3-甲基丁酸,故B错误;
C.苯甲酸的溶解度不大,溶解后应趁热过滤减少苯甲酸的损失,故C错误;
D.含-OH与乙酸发生酯化反应,含-COOH与乙醇发生酯化反应,故D正确;
故选:D。
A.单糖不是高分子化合物;
B.编号从靠近官能团一端开始;
C.苯甲酸的溶解度不大;
D.含-OH与乙酸发生酯化反应,含-COOH与乙醇发生酯化反应。
本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意醇、羧酸、烯烃的性质,题目难度不大。
7.【答案】
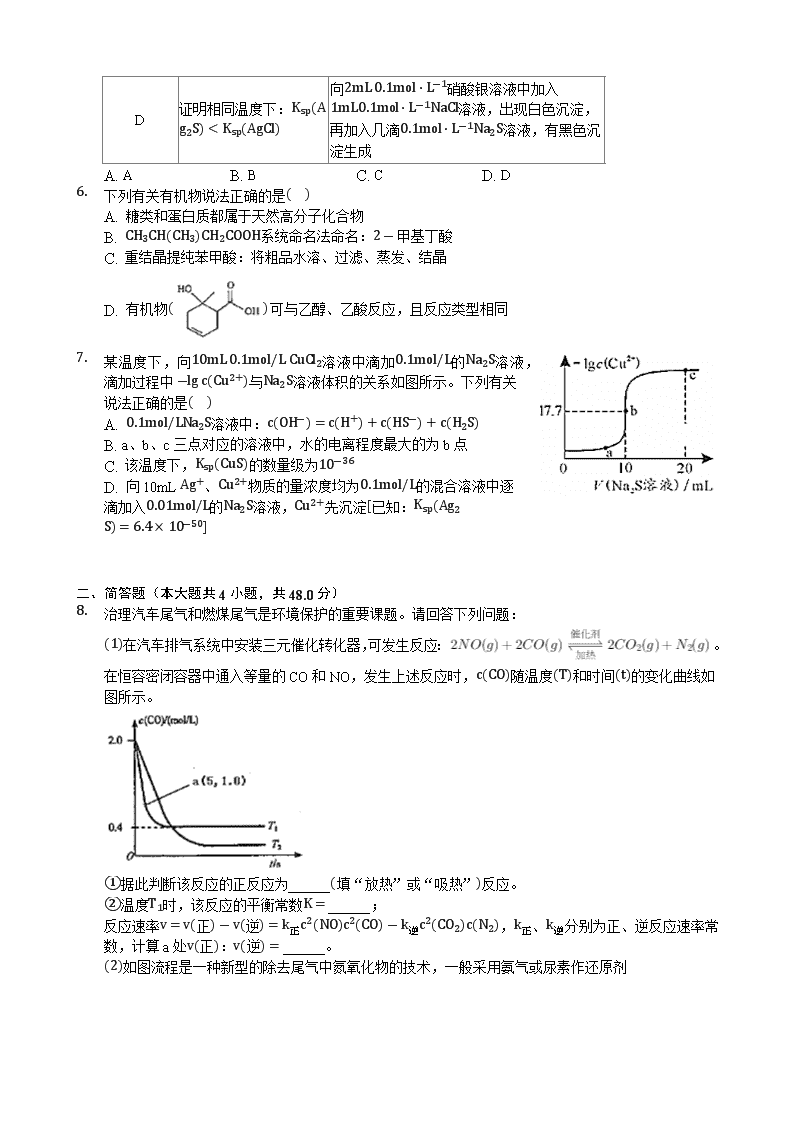
C
【解析】解:A、Na2S溶液中质子守恒关系为c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B、a、c两点Cu2+、S2-的水解促进了水的电离,水的电离程度增大,b点可认为是NaCl溶液,水的电离没有被促进,水的电离程度最小,故B错误;
C、b点CuCl2和Na2S溶液恰好反应生成CuS沉淀,即为CuS的饱和溶液,溶液中c(S2-)=c(Cu2+)=10-17.7,Ksp(CuS)=c(S2-)×c(Cu2+)=10-17.7×10-17.7=10-35.4=100.6×10-36,即Ksp(CuS)数量级为10-36,故C正确;
D、刚开始产生Ag2S沉淀时,c2(Ag+)×c(S2-)=Ksp(Ag2S),其中c(Ag+)=0.1mol/L,则此时c(S2-)=6.4×10-50(0.1)2mol/L=6.4×10-48mol/L,同理,刚产生刚开始产生CuS沉淀时,c (Cu2+)×c(S2-)=Ksp(CuS),其中c(Cu2+)=0.1mol/L,则此时c(S2-)=10-35.40.1mol/L=10-34.4mol/L,所以Ag+先沉淀,故D错误;
故选:C。
A、根据Na2S溶液中质子守恒关系分析判断;
B、a、c两点分别是强酸弱碱盐溶液和弱酸强碱盐溶液,对水的电离有促进作用,b点是NaCl溶液,不能促进水的电离;
C、b点CuCl2和Na2S溶液恰好反应生成CuS沉淀,是CuS的饱和溶液,由CuS(s)⇌S2-(aq)+Cu2+(aq),所以饱和溶液中c(S2-)=c(Cu2+),结合Ksp=c(S2-)×c(Cu2+)计算Ksp(CuS);
D、结合Ksp计算Ag+、Cu2+沉淀时c(S2-)大小,需要离子浓度小的先沉淀,据此分析解答。
本题考查沉淀溶解平衡知识,根据图象所提供的信息计算出CuS的Ksp数值是关键,对于同类型的沉淀可直接根据Ksp数值比较溶解性情况,不同类型的沉淀则需要定量计算比较,这是易错点,题目难度中等。
8.【答案】放热 80 160 4NH3+4NO+O2(g)=4N2+6H2O ②④⑤ BCD CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-978.0 kJ/mol
【解析】解:(1)由图可知T1大时CO浓度高,则升高温度平衡逆向移动,则正反应为放热反应,
故答案为:放热;
②温度T1时,平衡时CO的浓度为0.4mol/L,则
开始 2.0 2.0 0 0
转化 1.6 1.6 1.6 0.8
平衡 0.4 0.4 1.6 0.8
K=0.8×(1.6)2(0.4)2×(0.4)2=80;
a处时CO的浓度为1mol/L,则
起始 2mol/L 2mol/L 0 0
转化 1mol/L 1mol/L 1mol/L 0.5mol/L
a点 1mol/L 1mol/L 1mol/L 0.5mol/L
平衡时,因v(正)=v(逆)则k正c2(NO)平c2(CO)平=k逆c2(CO2)平c(N2)平,
故k正k逆=[c2(CO2)平c(N2)平]:[c2(NO)平c2(CO)平]=K(平衡常数)=8,
则v(正):v(逆)=[k正c2(NO) c2(CO)]:[k逆c2(CO2)c(N2)]=80×12×1212×0.5=160,
故答案为:80;160;
(2)用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)
的化学方程式为4NH3+4NO+O2(g)=4N2+6H2O,
故答案为:4NH3+4NO+O2(g)=4N2+6H2O;
(3)流程中为提高原料利用率而采取的措施为②④⑤,且净化干燥、催化剂不影响平衡移动,
故答案为:②④⑤;
(4)A.Pd电极b上是氢气发生氧化反应,Pd电极b为阳极,故A错误;
B.Pd电极a为阴极,N2发生还原反应,N2+6H++6e-=2NH3,故B正确;
C.阳离子向阴极移动,故C正确;
D.陶瓷隔离N2和H2,使之分别在阴极、阳极放电,故D正确;
故答案为:BCD;
(5)由①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g)△H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g)△H=+89.0 kJ/mol,
结合盖斯定律可知,①+②-③×2得到CH4 (g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-978.0 kJ/mol,
故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-978.0 kJ/mol。
(1)①由图可知T1大时CO浓度高,则升高温度平衡逆向移动;
②温度T1时,平衡时CO的浓度为0.4mol/L,则
开始 2.0 2.0 0 0
转化 1.6 1.6 1.6 0.8
平衡 0.4 0.4 1.6 0.8
K为生成物浓度幂之积与反应物浓度幂之积的比;
a处时CO的浓度为1mol/L,则
起始 2mol/L 2mol/L 0 0
转化 1mol/L 1mol/L 1mol/L 0.5mol/L
a点 1mol/L 1mol/L 1mol/L 0.5mol/L
v(正):v(逆)=[k正c2(NO)c2(CO)]:[k逆c2(CO2)c(N2)];
(2)用NH3作还原剂还原尾气中NO,生成氮气和水;
(3)提高原料利用率,可增大压强,分离出生成物,循环使用反应物,使平衡正向移动;
(4)由图可知为氢气失去电子,氮气得到电子,阳离子向阴极移动;
(5)由①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g)△H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g)△H=+89.0 kJ/mol,
结合盖斯定律可知,①+②-③×2得到CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)。
本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及速率计算、焓变计算为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等。
9.【答案】2SnO+4NaOH+O2=2Na2SnO3+2H2O PbO22-+S2-+2H2O=PbS+4OH- 0.0017 除去SbO32-或除锑 在140℃以下加热蒸发或蒸发浓缩、冷却结晶 低温干燥 还原FeO以减少生成物,使钙铁置换反应向正反应方向移动
【解析】解:(1)在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,反应的方程式为2SnO+4NaOH+O2=2Na2SnO3+2H2O,
故答案为:2SnO+4NaOH+O2=2Na2SnO3+2H2O;
(2)加入硫化钠所发生反应的离子方程式为PbO22-+S2-+2H2O=PbS+4OH-,
假定溶液体积为VL,Ba2+在混合体系中的存在形式由两部分构成,一部分与AsO43-沉淀3Ba2++2AsO43-=Ba3(AsO4)2,需n(Ba2+)=0.0015Vmol;同时溶液中存在Ba3(AsO4)2的溶解平衡,c3(Ba2+)c2(AsO43-)=Ksp(Ba3(AsO4)2),
此时c(AsO43-)=10-6mol/L,c(Ba2+)=10-4mol/L,
需n(Ba2+)=10-4×2Vmol,故c(Ba(OH)2)=(10-4×2V+0.0015V)÷V=0.0017mol/L,
故答案为:PbO22-+S2-+2H2O=PbS+4OH-; 0.0017;
(3)除杂2中加入Sn粒的目的是除去SbO32-或除锑,故答案为:除去SbO32-或除锑;
(4)最后一步从滤液中得到锡酸钠晶体的操作步骤为在140℃以下加热蒸发或蒸发浓缩、过滤、用乙醇洗涤、然后低温干燥,
故答案为:在140℃以下加热蒸发或蒸发浓缩、冷却结晶;乙醇;低温干燥;
(5)为可逆反应,加入还原剂烟煤,具有还原性,可还原FeO以减少生成物,使钙铁置换反应向正反应方向移动,
故答案为:还原FeO以减少生成物,使钙铁置换反应向正反应方向移动。
以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠,锡锑渣加入烧碱反应碱浸,加入硫化钠脱铅生成硫化铅渣,加入氢氧化钡脱砷生成砷酸钡渣,加入锡粒脱锑得到锑渣,最后得到锡酸钠溶液,蒸发结晶、趁热过滤洗涤、干燥得到晶体。
本题考查混合物分离的综合应用,为高频考点,把握物质的性质、发生的反应、混合物分离方法、实验技能为解答关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
10.【答案】[Ar]3d9 三角锥形 SiF4、CCl4 4 sp3杂化 26NA CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl
阴阳离子所带电荷,CuO的晶格能更大 C
【解析】解:(1)Cu原子核外电子数为29,核外电子排布式为1s22s22p63s23p63d104s1,基态Cu失去2个电子生成基态Cu2+,所以Cu2+的核外电子排布式1s22s22p63s23p63d9或[Ar]3d9,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;
(2)IO3-的中心原子I的价层电子对数=7+1+02=4,VSEPR模型为四面体,略去1对孤电子对,即为IO3-的空间构型为三角锥形;与SO42-互为等电子体的
有CCl4(或SiCl4或CBr4或SiF4等),
故答案为:三角锥形,CCl4(或SiCl4或CBr4或SiF4等);
(3)配离子[Cu(H2NCH2CH2NH2)2]2+中,配体为2个H2NCH2CH2NH2分子,其中4个N原子均为配位原子,所以Cu2+的配位数是4,
故答案为:4;
①乙二胺分子中的N原子形成3个σ键,还有1对孤电子对,所以N原子为sp3杂化,
故答案为:sp3;
②配离子[Cu(H2NCH2CH2NH2)2]2+中,Cu2+的配位数是4,则每个N原子与Cu形成一个配位键,结构图为,一个离子中含有4个配位键、8个C-H键、8个N-H键、2个C-C键、4个C-N键,共26个σ 键,
所以1mol[Cu(H2NCH2CH2NH2)2]2+中含有的 σ 键的数目26NA,
故答案为:26NA;
(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-
查看更多