- 2021-08-24 发布 |
- 37.5 KB |
- 9页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第4章 专题讲座二 常见气体的实验室制备、净化和收集
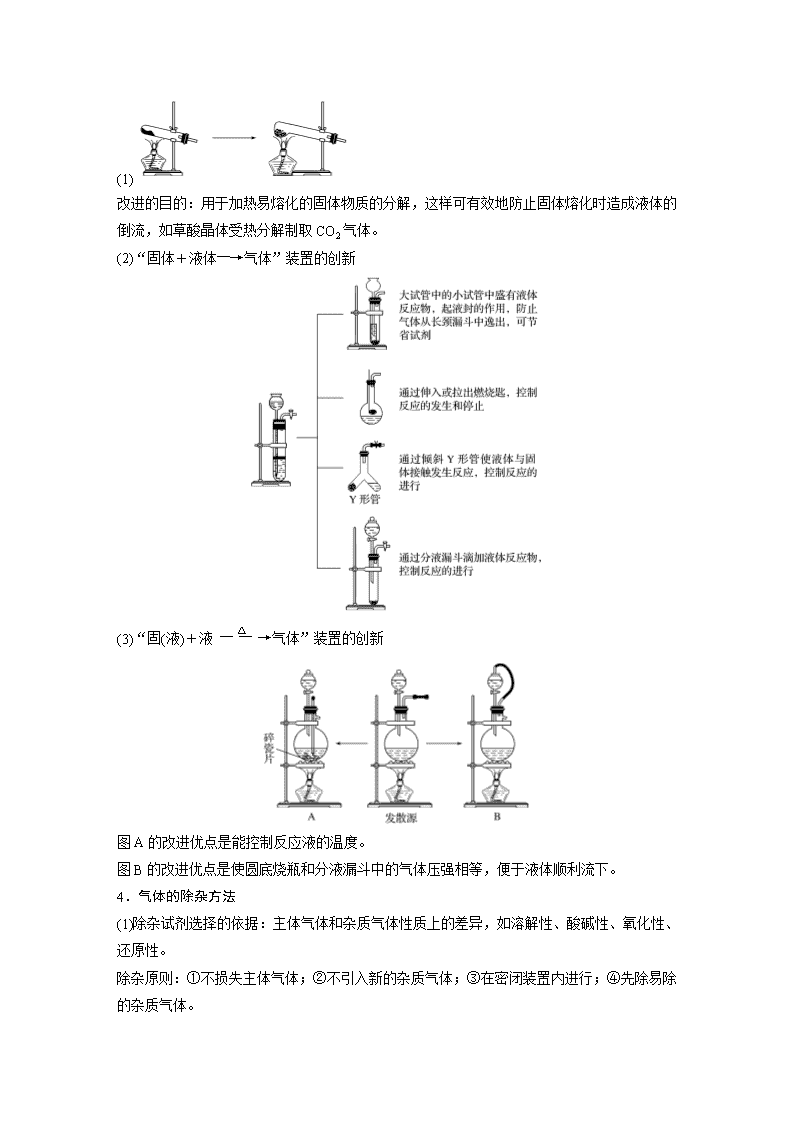
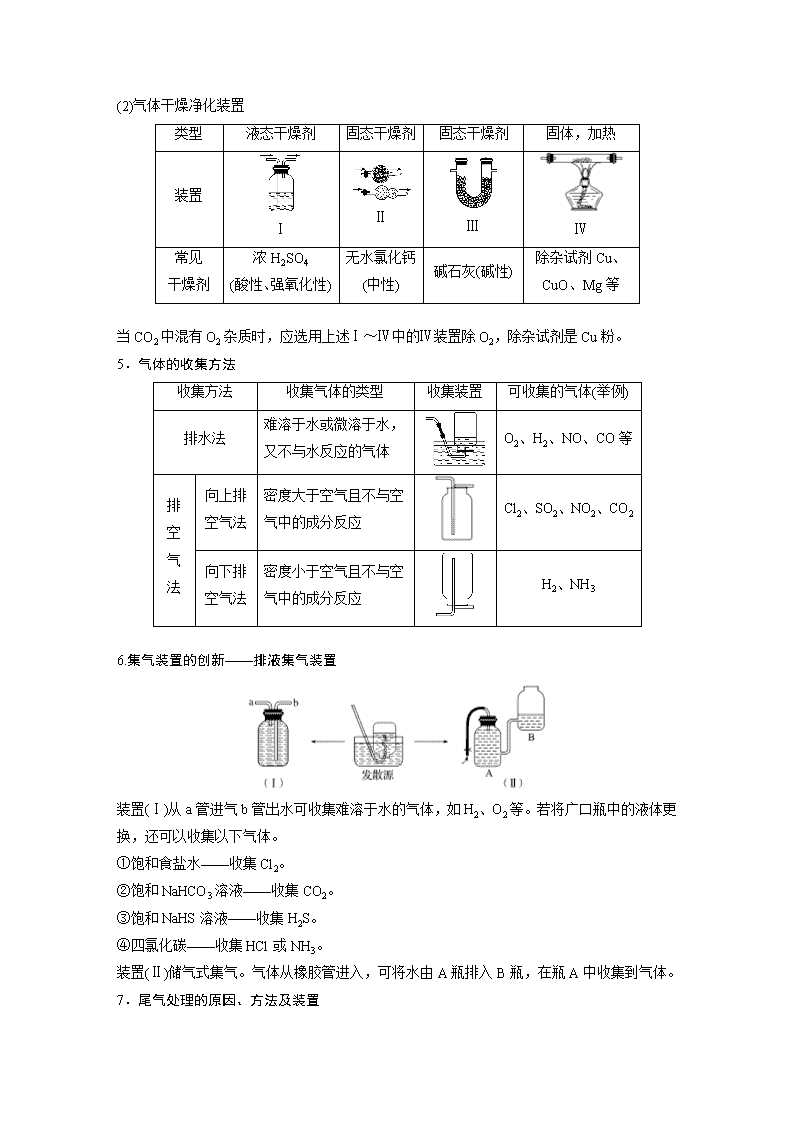
专题讲座二 常见气体的实验室制备、净化和收集 1.气体制备实验的基本思路 2.重要气体的发生装置 依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体气体 发生装置(如图): 制备气体:O2、NH3、CH4等。 (2)固体+液体或液体+液体气体 发生装置: 制备气体:Cl2、C2H4等。 (3)固体+液体(不加热)―→气体 发生装置: 制备气体:选择合适的药品和装置能制取中学化学中常见的气体。 3.气体制备装置的改进 (1) 改进的目的:用于加热易熔化的固体物质的分解,这样可有效地防止固体熔化时造成液体的倒流,如草酸晶体受热分解制取CO2气体。 (2)“固体+液体―→气体”装置的创新 (3)“固(液)+液气体”装置的创新 图A的改进优点是能控制反应液的温度。 图B的改进优点是使圆底烧瓶和分液漏斗中的气体压强相等,便于液体顺利流下。 4.气体的除杂方法 (1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。 除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。 (2)气体干燥净化装置 类型 液态干燥剂 固态干燥剂 固态干燥剂 固体,加热 装置 Ⅰ Ⅱ Ⅲ Ⅳ 常见 干燥剂 浓H2SO4 (酸性、强氧化性) 无水氯化钙(中性) 碱石灰(碱性) 除杂试剂Cu、CuO、Mg等 当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。 5.气体的收集方法 收集方法 收集气体的类型 收集装置 可收集的气体(举例) 排水法 难溶于水或微溶于水,又不与水反应的气体 O2、H2、NO、CO等 排空气法 向上排空气法 密度大于空气且不与空气中的成分反应 Cl2、SO2、NO2、CO2 向下排空气法 密度小于空气且不与空气中的成分反应 H2、NH3 6.集气装置的创新——排液集气装置 装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。 ①饱和食盐水——收集Cl2。 ②饱和NaHCO3溶液——收集CO2。 ③饱和NaHS溶液——收集H2S。 ④四氯化碳——收集HCl或NH3。 装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在瓶A中收集到气体。 7.尾气处理的原因、方法及装置 (1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。 (2)处理方法:一般根据气体的相关性质,使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。 (3)尾气处理装置(见下图a、b、c) ①实验室制取Cl2时,尾气的处理可采用b装置。 ②制取CO时,尾气处理可采用a、c装置。 ③制取H2时,尾气处理可采用a、c装置。 题组一 气体的制备与性质探究 1.(2019·大连高三上学期期中)用下图所示装置进行实验,下列实验现象描述错误的是( ) 选项 试剂甲 试剂乙 试剂丙 丙中的现象 A 稀盐酸 CaCO3 Na2SiO3溶液 有白色沉淀生成 B 浓硫酸 Na2SO3 BaCl2溶液 有白色沉淀生成 C 过氧化氢 MnO2 酸性KI淀粉溶液 溶液变为蓝色 D 浓盐酸 KMnO4 Na2S溶液 有淡黄色沉淀生成 答案 B 解析 A项,盐酸和碳酸钙反应生成CO2,CO2与硅酸钠溶液反应生成硅酸白色沉淀,正确;B项,浓硫酸与亚硫酸钠反应生成SO2,但SO2与氯化钡不反应,错误;C项,过氧化氢在二氧化锰的作用下分解生成氧气,氧气把碘化钾氧化为单质碘,淀粉遇碘显蓝色,正确;D项,浓盐酸与高锰酸钾混合生成氯气,氯气把硫化钠氧化为单质S,生成淡黄色沉淀,正确。 2.(2020·开封高三检测)用如图所示装置和相应试剂能达到实验目的的是( ) 选项 实验目的 试剂a 试剂b 试剂c 装置 A 验证非金属性:S>C>Si 稀硫酸 Na2CO3 Na2SiO3溶液 B 制备纯净的氯气 浓盐酸 MnO2 饱和食盐水 C 检验溶液X中含有CO 盐酸 溶液X 澄清石灰水 D 除去Na2SO3中的Na2SO4 氯水 混合物 NaOH溶液 答案 A 解析 A项,装置b中出现气体,说明硫酸的酸性强于碳酸,装置c中出现沉淀,说明碳酸的酸性强于硅酸,最高价氧化物对应水化物的酸性越强,非金属性越强,即S>C>Si,正确;B项,MnO2和浓盐酸反应,需要加热,此装置中没有加热装置,饱和食盐水除去氯气中的HCl,从装置c中出来的氯气中混有水蒸气,不是纯净的,错误;C项,向装置b中加入盐酸,出现能使澄清石灰水变浑浊的气体,不能说明X中含有CO,可能含有HCO或SO或HSO,错误;D项,氯水具有强氧化性,能把SO氧化成SO,不能达到实验目的,错误。 3.(2019·成都高三上学期联考)利用如图所示装置进行下列实验,能得到相应实验结论的是( ) 选项 ① ② ③ 实验结论 A 浓硫酸 Na2SO3 KMnO4溶液退色 SO2有漂白性 B 浓盐酸 KMnO4 FeBr2溶液变为黄色 氧化性:Cl2>Br2 C 稀硫酸 碳酸钠 CaCl2溶液无明显变化 CO2不与CaCl2反应 D 浓硫酸 蔗糖 溴水退色 浓硫酸具有脱水性、吸水性 答案 C 解析 A项,二氧化硫使酸性高锰酸钾溶液退色表现的是还原性,错误;B项,氯气通入溴化亚铁溶液中先氧化亚铁离子,使溶液变为黄色,错误;C项,碳酸的酸性弱于盐酸,所以二氧化碳不与氯化钙反应,正确;D项,溴水退色说明有二氧化硫生成,证明了浓硫酸的强氧化性,错误。 4.(2019·武汉高三上学期期中)用下图所示装置进行实验,下列对实验现象的解释不合理的是( ) 选项 ①中试剂 ①中现象 解释 A 品红溶液 溶液退色 SO2具有漂白性 B Na2SiO3溶液 产生胶状沉淀 酸性:H2SO3>H2SiO3 C Ba(NO3)2溶液 生成白色沉淀 SO与Ba2+生成BaSO3白色沉淀 D 酸性KMnO4溶液 紫色退去 SO2具有还原性 答案 C 解析 Cu和浓硫酸发生反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。A项,SO2具有漂白性,能使品红溶液退色,正确;B项,通入SO2后产生胶状沉淀,说明产生H2SiO3,即H2SO3的酸性强于H2SiO3的酸性,正确;C项,SO2溶于水,溶液显酸性,NO在酸性条件下具有强氧化性,能把H2SO3或SO氧化成SO,因此白色沉淀是BaSO4,错误;D项,酸性高锰酸钾溶液具有氧化性,紫色退去,说明SO2具有还原性,正确。 题组二 高考新题型——和气体制备有关的仪器连接分析 5.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( ) A.①②③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 答案 B 解析 A项,气体从溶液中逸出易带出水蒸气,所以浓硫酸应放在③中,错误;B项,先通H2以排除空气,加热前应先检验H2的纯度,正确;C项,若先停止通H2,空气有可能重新将W氧化,应先停止加热,再关闭活塞K,错误;D项,MnO2 和浓盐酸反应制氯气需要加热,不能用启普发生器制备,错误。 6.(2019·信阳高三月考)用下图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因分析中,一定错误的是( ) A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置之后缺少干燥装置 C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原 答案 D 解析 用H2还原CuO时,装置Ⅲ中CaCl2吸收的是生成的水,而装置Ⅱ中玻璃管通H2前后的质量差为反应时消耗CuO中氧的质量,即生成水中氧元素的质量,而m(水)-m(氧)=m(氢)。当Zn和稀硫酸反应产生的H2不干燥[m(水)偏大],装置Ⅲ后不加干燥装置,使Ⅲ中CaCl2吸收空气中的水分[m(水)偏大],Ⅱ中玻璃管内有水冷凝[m(氧)偏小],都会造成测得m(H)∶m(O)>1∶8。H2O的组成与CuO是否完全反应无关,只与通H2前后玻璃管的质量差和生成的水有关。 7.(2020·山东等级模拟考,9)锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5 ℃,沸点364.5 ℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2SnI4制备SnI4。下列说法错误的是( ) A.加入碎瓷片的目的是防止暴沸 B.SnI4可溶于CCl4中 C.装置Ⅰ中a为冷凝水进水口 D.装置Ⅱ的主要作用是吸收挥发的I2 答案 D 解析 D选项,SnI4易水解,装置Ⅱ的主要作用为防止空气中的水蒸气进入。 题组三 仪器连接专练 8.将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20 ℃,1.01×105 Pa)的体积。某同学拟选用如图实验装置完成实验: 最简易的装置其连接顺序:A接(______)(________)接(________)(________)接(________)(填接口字母,可不填满)。 答案 E D G 9.实验室合成硫酰氯要先制取干燥氯气。制备干燥纯净的氯气所用仪器如下图: 上述仪器的连接顺序:e接________,________接________,________接________,________接________(按气流方向,用小写字母表示)。 答案 d c a b i h g 10.亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。 已知:① NO+NO2+2OH-===2NO+H2O ②气体液化的温度:NO2(21 ℃)、NO(-152 ℃) (1)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________________________。 (2)为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→________;组装好仪器后,接下来进行的操作是_________________________________________________。 答案 (1)排出装置中的空气,防止干扰NO的检验 (2)CEDB 检查装置的气密性 解析 (2)为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A是发生装置,C是干燥除去水。因为NO2更易液化,先分离NO2,所以接E冷却二氧化氮,NO2分离后再检验NO,再接D通氧气,观察到气体从无色变成红棕色,说明是NO,B是尾气处理装置,吸收反应后剩余的NO和NO2的混合气体,防止污染空气。装置的连接为A→C→E→D→B;有气体参与或生成的实验必须检查装置的气密性,故组装好仪器后,接下来进行的操作是检查装置的气密性。 11.利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、 H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。 (1)仪器a的名称为________,仪器b中装入的试剂可以是____________。 (2)按气流方向正确的装置连接顺序为________(填字母,装置可重复使用)。 答案 (1)分液漏斗 NaOH固体(或生石灰或碱石灰) (2)BDADC 解析 (2)该实验在B装置产生氨,通过D干燥氨,在A中NH3与MxOy反应,生成的水在D中被吸收,残留氨被C吸收,所以按气流方向正确的装置连接顺序为BDADC。查看更多