广东省2021高考化学一轮复习专题四氧化还原反应课件
考点清单
考点一 氧化还原反应的概念及规律
一、氧化还原反应
1.
氧化还原反应的本质及判断依据
(1)
氧化还原反应的本质
:
有电子①
转移
(
包括电子得失和电子对偏
移
)
。
(2)
判断依据
:
有元素化合价的升高或降低。
2.氧化还原反应的有关概念
(1)氧化反应:②
失去
电子(化合价升高)的反应。
(2)还原反应:③
得到
电子(化合价降低)的反应。
(3)氧化剂(被还原):④
得到
电子的物质(所含元素化合价降低的物质)。
(4)还原剂(被氧化):⑤
失去
电子的物质(所含元素化合价升高的物
质)。
(5)氧化产物:
还原剂失电子后的对应产物
(包含化合价⑥
升高
的元素
的产物)。
(6)还原产物:
氧化剂得电子后的对应产物
(包含化合价⑦
降低
的元素
的产物)。
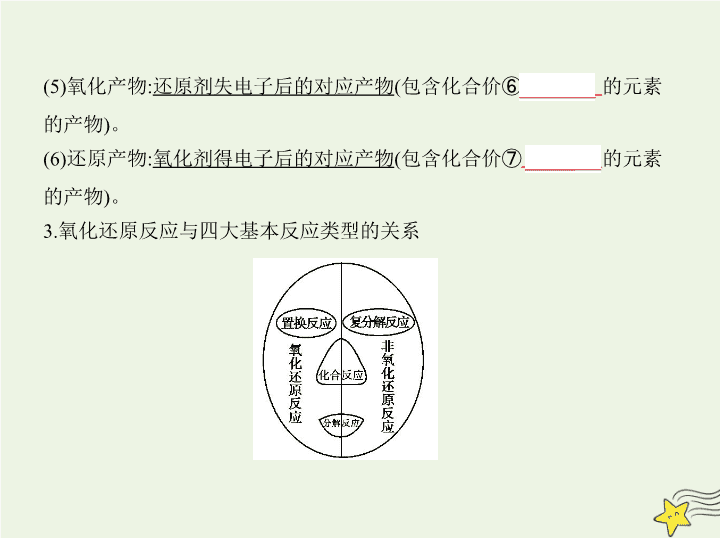
3.氧化还原反应与四大基本反应类型的关系
二、常见的氧化剂和还原剂
1.常见的氧化剂
(1)活泼的非金属单质:如Cl
2
、O
2
、Br
2
、F
2
等。
(2)高价金属阳离子:如Fe
3+
、Sn
4+
、Cu
2+
等。
(3)高价或较高价含氧化合物:如KMnO
4
、MnO
2
、PbO
2
、KClO
3
等。
(4)过氧化物:如H
2
O
2
、Na
2
O
2
等。
2.常见的还原剂
(1)金属单质:如K、Na、Mg等。
(2)某些非金属单质:如H
2
、C、Si等。
(3)低价态金属阳离子:如Fe
2+
、Cu
+
等。
(4)元素处于低价态的氧化物:如CO、NO、SO
2
等。
(5)非金属阴离子及低价态化合物:如S
2-
、I
-
、H
2
S等。
(6)非金属氢化物:如HBr、HI、H
2
S等。
三、氧化还原反应中电子转移的表示方法
1.双线桥法
注意事项:
(1)箭头必须由反应物指向生成物,且两端对准同种元素。
(2)箭头方向不代表电子转移的方向,仅表示电子转移前后的变化。
(3)在“桥”上标明电子的“得”与“失”,且
“得”“失”电子总数应相
等
。
2.单线桥法
注意事项:
(1)箭头必须由
还原剂中失电子的元素指向氧化剂中得电子的元素
。
(2)箭头方向表示电子⑧
转移的方向
。
(3)在“桥”上标明转移的⑨
电子总数
。
四、氧化还原反应的规律
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且得电子总数⑩
等于
失电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价
降低,且化合价降低总值必
等于
升高总值。
2.价态规律
元素处于最高价态,只有
氧化
性;元素处于最低价态,只有
还原
性
;
元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质
。
物质中若含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性或还原性。
3.转化规律
在氧化还原反应中,元素
相邻价态之间的转化最容易;同种元素不同价态之
间发生反应,元素的化合价只靠拢而不交叉
;含有相邻价态的同种元素的物
质之间不发生氧化还原反应。例如:
应用:判断氧化还原反应能否发生及电子转移情况。
4.难易规律
越易失去电子的物质,失去后就
越难
得到电子;越易得到电子的物
质,得到后就
越难
失去电子。一种氧化剂同时和几种还原剂相遇
时,与还原性
最强
的优先发生反应;同理,一种还原剂同时与多种氧
化剂相遇时,与氧化性
最强
的优先发生反应。如向FeBr
2
溶液中通
入Cl
2
时,发生离子反应的先后顺序为2Fe
2+
+Cl
2
2Fe
3+
+2Cl
-
,2Br
-
+Cl
2
Br
2
+2Cl
-
。
应用:判断物质的稳定性及反应顺序。
考点二 氧化还原反应方程式的配平及相关计算
一、氧化还原反应方程式的配平
1.配平的原则
(1)得失电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的
总数相等。
(2)电荷守恒原则:若为离子反应,反应前后离子所带正、负电荷总数相
等。
(3)原子守恒原则:反应前后各元素的原子个数相等。
2.配平步骤
化合价升降法是最重要的也是最基本的配平方法,步骤一般为:
(1)“一标”:根据反应物和生成物的化学式,标出化合价发生变化的元素
的化合价。例如:
K
O
4
+Na
2
O
3
+H
2
SO
4
SO
4
+K
2
SO
4
+Na
2
O
4
+H
2
O
(2)“二等”:使变价元素的化合价升降的总数相等,即求出化合价升降的
最小公倍数(化合价升高可用“↑”表示,降低可用“↓”表示)。
↓5
×
2
↑2
×
5
(3)“三定”:根据化合价升高与降低的最小公倍数,确定出参加氧化还原
反应的物质的化学计量数。
2KMnO
4
+5Na
2
SO
3
+H
2
SO
4
2MnSO
4
+K
2
SO
4
+5Na
2
SO
4
+H
2
O
(4)“四平”:用观察法配平,确定其他各物质的化学计量数。
2KMnO
4
+5Na
2
SO
3
+3H
2
SO
4
2MnSO
4
+K
2
SO
4
+5Na
2
SO
4
+3H
2
O
(5)“五查”:检查反应前后原子总数是否相等,检查离子反应中电荷是否
守恒,若相等且守恒,说明方程式正确,将箭头或短线改为等号(上海地区的
反应方程式都用箭头,不必改为等号)。
2KMnO
4
+5Na
2
SO
3
+3H
2
SO
4
2MnSO
4
+K
2
SO
4
+5Na
2
SO
4
+3H
2
O
二、氧化还原反应的相关计算
进行氧化还原反应的有关计算应分析元素化合价的变化,理清“得失两条
线”,以得失电子守恒为切入点,并结合化学方程式和原子守恒列式求解。
从试题的变化趋势来看,有一类题目是已知参加反应的氧化剂与还原剂的
物质的量之比,通过计算确定产物。计算公式如下:
氧化剂物质的量
×
变价元素原子的个数
×
化合价的变化值=还原剂物质的
量
×
变价元素原子的个数
×
化合价的变化值。
知能拓展
一、物质氧化性、还原性强弱的判断
1.根据元素活动性顺序(常见元素)判断
①金属活动性顺序
②非金属活动性顺序(常见元素)
2.根据元素在周期表中的位置判断
①同主族元素(从上到下)
如:
②同周期主族元素(从左到右)
如:
3.根据元素最高价氧化物对应的水化物的酸碱性强弱判断
例如,酸性:HClO
4
>H
2
SO
4
>H
3
PO
4
>H
2
CO
3
,可判断氧化性:Cl
2
>S>P>C。
4.根据氧化还原反应的方向判断
氧化剂+还原剂
还原产物+氧化产物
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
5.根据氧化产物的价态高低判断
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据
氧化产物价态的高低判断氧化剂氧化性的强弱。
如2Fe+3Cl
2
2FeCl
3
、Fe+S
FeS,可以判断氧化性:Cl
2
>S。
6.根据反应所需条件判断
当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应
条件的高低进行判断。例如:
16HCl(浓)+2KMnO
4
2KCl+2MnCl
2
+8H
2
O+5Cl
2
↑
①
4HCl(浓)+MnO
2
MnCl
2
+2H
2
O+Cl
2
↑
②
4HCl(浓)+O
2
2H
2
O+2Cl
2
③
上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl
2
,而氧化剂分别是
KMnO
4
、MnO
2
、O
2
。①式中KMnO
4
常温时可把浓盐酸中的Cl氧化;②式
需要在加热条件下才能完成;③式不仅需要加热,而且还需要CuCl
2
作催化
剂才能完成。由此我们可以得出氧化性:KMnO
4
>MnO
2
>O
2
。
7.根据物质的浓度大小判断
具有氧化性(或还原性)的物质浓度越大,其氧化性(或还原性)越强,反之,其
氧化性(或还原性)越弱。如氧化性:HNO
3
(浓)>HNO
3
(稀);MnO
2
能与浓盐酸
反应,却不能被稀盐酸还原。
8.根据原电池、电解池的电极反应判断
①一般情况下,两种不同的金属构成原电池的两极,负极是电子流出的极,
正极是电子流入的极。还原性:负极金属>正极金属。
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳
极先放电的阴离子的还原性较强。
例1 (2019华南师大附中月考二,5)下列实验操作对应的现象和根据现象
得出的结论均正确的是
( )
实验操作
现象
结论
A
向FeCl
3
溶液中加入浓
NaOH溶液
溶液由黄色变为红棕
色
生成了氢氧化铁胶体
B
向Co
2
O
3
中滴入浓盐酸
产生黄绿色气体
氧化性:Cl
2
>Co
2
O
3
C
向某溶液中滴加K
3
[Fe
(CN)
6
]溶液
产生蓝色沉淀
溶液中存在亚铁离子
D
向NaHCO
3
溶液中滴加
NaAlO
2
溶液
有白色沉淀和气体产
生
Al
与HC
发生了相互促进的水解反应
解题导引 根据实验现象,根据氧化还原反应中价态升降的规律,判断出产
物,再根据相关知识分析、判断结论是否正确。
解析 向FeCl
3
溶液中加入浓NaOH溶液,生成氢氧化铁沉淀,不是生成氢氧
化铁胶体,现象是有红褐色沉淀生成,A项错误;向Co
2
O
3
中滴入浓盐酸产生
氯气,Co
2
O
3
是氧化剂、氯气是氧化产物,氧化性:Cl
2
”或
“<”),而方案Ⅱ实验表明,Cl
2
和Fe
的氧化性强弱关系相反,原因是
。
③资料表明,酸性溶液中的氧化性Fe
>Mn
,验证实验如下:将溶液b滴
入MnSO
4
和足量H
2
SO
4
的混合溶液中,振荡后溶液呈浅紫色,该现象能否证
明氧化性Fe
>Mn
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:
。
解题导引 本题有三个空是书写氧化还原反应方程式,可见其重要性,尤其
是陌生氧化还原反应方程式的书写。书写氧化还原反应方程式时,应首先
通过信息和经验确定部分反应物、生成物,再依据得失电子守恒配平氧化
剂、还原剂、氧化产物、还原产物的化学计量数,最后根据电荷守恒、原
子守恒配平其余物质的化学计量数。
解析 该题以K
2
FeO
4
的制备和其性质探究为载体,考查氧化还原反应原理
及实验探究等。
(1)①KMnO
4
与浓盐酸发生氧化还原反应制得Cl
2
,反应方程式为2KMnO
4
+
16HCl
2MnCl
2
+2KCl+5Cl
2
↑+8H
2
O。
②洗气装置的导管应长进短出,为除去Cl
2
中的HCl,应用饱和食盐水。
③在碱性环境中,Cl
2
易发生歧化反应:Cl
2
+2KOH
KCl+KClO+H
2
O。
(2)①ⅰ.Fe
3+
遇KSCN溶液显红色,故溶液中含有Fe
3+
;在酸性条件下,K
2
FeO
4
快速分解可生成Fe
3+
。
ⅱ.用KOH溶液洗涤可除去固体表面吸附的KClO等物质,排除对后续实验
的干扰。
②Cl
2
在碱性条件下能够氧化
Fe(OH)
3
,
生成
K
2
FeO
4
,
根据平衡移动原理
,3Cl
2
+
2Fe(OH)
3
+10KOH
2K
2
FeO
4
+6KCl+8H
2
O,
当溶液酸性增强时
,
平衡将向
逆反应方向移动,或者在酸性条件下,Fe
氧化性增强,能氧化Cl
-
生成Cl
2
。
③在酸性条件下,Fe
发生反应:4Fe
+20H
+
4Fe
3+
+3O
2
↑+10H
2
O,振
荡后溶液呈浅紫色能说明有Mn
生成。
答案 (1)①2KMnO
4
+16HCl
2MnCl
2
+2KCl+5Cl
2
↑+8H
2
O
②
③Cl
2
+2OH
-
Cl
-
+ClO
-
+H
2
O
(2)①ⅰ.Fe
3+
4Fe
+20H
+
4Fe
3+
+3O
2
↑+10H
2
O
ⅱ.排除ClO
-
的干扰
②> 溶液酸碱性不同
③理由:Fe
在过量酸的作用下完全转化为Fe
3+
和O
2
,溶液浅紫色一定是
Mn
的颜色
方案:向紫色溶液b中滴加过量稀H
2
SO
4
,观察溶液紫色快速褪去还是显浅紫色
实践探究
1.利用氧化剂(还原剂)氧化性(还原性)强弱判断规律,通过对照实验收集证
据,推理判断物质氧化性(还原性)强弱;注意变量控制,可进行平行对照或先
后对照。
例
1 (2019
济南外国语学校月考一
,17)
通过卤素间的反应实验
,
可以比较
出卤素单质氧化性的强弱。实验如下
:
下列说法不正确的是
( )
A.CCl
4
起到萃取、富集I
2
的作用
B.a中下层变无色,说明I
2
转化为I
-
C.Ⅲ中发生反应的离子方程式为Br
2
+2I
-
I
2
+2Br
-
D.依据a、b中现象,可以证明Cl
2
的氧化性比Br
2
强
解析 实验中CCl
4
起到萃取、富集I
2
的作用,A项正确;a中下层变无色,说明
碘单质被氯水氧化为碘酸根离子,而不是降价产物碘离子,B项错误;Ⅲ中发
生反应的离子方程式为Br
2
+2I
-
I
2
+2Br
-
,C项正确;依据a、b中现象,溴水
不能氧化碘单质而氯水可以,证明Cl
2
的氧化性比Br
2
强。
答案 B
题目价值 本题依据氧化还原反应原理设计实验方案,解决实际问题,体现
了证据推理与模型认知的学科核心素养。
2.分析实际氧化还原反应案例,建立平衡观念,打破化学反应惯性思维,体会
化学反应受到多变量影响,确立证据推理意识。
例2 常温下,研究pH对一定浓度FeSO
4
溶液的稳定性的影响,根据下图分
析不合理的是
( )
A.pH小于1时,Fe
2+
几乎无损耗,可能的原因是4Fe
2+
+O
2
+10H
2
O
4Fe(OH)
3
+8H
+
平衡逆向移动
B.pH在3.0~5.5之间,pH的变化对FeSO
4
溶液稳定性影响不大
C.pH大于6.5时,Fe
2+
损耗量突变,可能的原因是生成的Fe(OH)
2
更易被氧化
D.其他条件相同时,向FeSO
4
溶液中加入少量(NH
4
)
2
SO
4
固体,FeSO
4
溶液的
稳定性减弱
题目价值 提升学科核心素养,需要关注知识的实际应用和知识之间的联
系,摆脱理想化试题的设计和练习,建立在真实情境中抓住主要矛盾并解决
问题的化学思维模型,认识到化学变化是有条件的。
解析 Fe
2+
易与O
2
反应,离子方程式为4Fe
2+
+O
2
+10H
2
O
4Fe(OH)
3
+8H
+
,
pH小于1时,
c
(H
+
)较大,反应向左进行,Fe
2+
几乎无损耗,故A正确;由题图可
知,pH在3.0~5.5之间,Fe
2+
的损耗量几乎不变,说明pH在3.0~5.5之间,pH变化
对FeSO
4
溶液稳定性影响不大,故B正确;pH大于6.5时,
c
(H
+
)较小,Fe
2+
损耗量
突变,可能的原因是酸性减弱,Fe
2+
转化为Fe(OH)
2
从而更易被氧化,故C正
确;其他条件相同时,向FeSO
4
溶液中加入少量(NH
4
)
2
SO
4
固体,
c
(H
+
)增大,
FeSO
4
溶液的稳定性增强或不变,故D错误。
答案 D
创新思维
1.明确微粒种类、厘清反应关系
在一个反应现象背后未必是两种微粒在反应,假如有三种微粒,则反应个数
可能是四个,而且可能是氧化还原反应与非氧化还原反应同时存在,若增加
微粒数,则思维难度自然剧增,所以分析问题遇到障碍可能是有些微粒被忽
视,一些反应或者反应间的竞争被漠视。
例1 (2019北京朝阳一模,12)探究铝片与Na
2
CO
3
溶液的反应。
下列说法不正确的是
( )
A.Na
2
CO
3
溶液中存在水解平衡:C
+H
2
O
HC
+OH
-
B.对比Ⅰ、Ⅲ,说明Na
2
CO
3
溶液能破坏铝表面的保护膜
C.推测出现白色浑浊的原因:Al
+HC
+H
2
O
Al(OH)
3
↓+C
D.加热和H
2
逸出对C
水解平衡移动方向的影响是相反的
无明显现象
Ⅲ中铝片表面产生细小气泡
Ⅳ中出现白色浑浊,产生大量气泡(经检验为H
2
和CO
2
)
解析 A项,C
为多元弱酸根离子,分步水解,以第一步水解为主,即C
+
H
2
O
HC
+OH
-
。B项,Ⅰ中无明显现象说明铝和水没有发生反应,Ⅲ
中铝片表面产生细小气泡说明铝和C
水解生成的OH
-
反应生成H
2
,对比
Ⅰ、Ⅲ,说明Na
2
CO
3
溶液能破坏铝表面的保护膜。C项,C
+H
2
O
HC
+OH
-
,2Al+2OH
-
+2H
2
O
2Al
+3H
2
↑,Al
与HC
反应生成Al(OH)
3
和C
,即Al
+HC
+H
2
O
Al(OH)
3
↓+C
。D项,C
+H
2
O
HC
+OH
-
,加热促进水解平衡正向移动;铝和OH
-
反应放出 H
2
,消耗OH
-
,OH
-
浓
度降低,C
水解平衡正向移动,故加热和H
2
逸出对C
水解平衡移动方向
的影响相同。
答案 D
2.寻找竞争反应、评价并设计实验方案
化学高阶思维测查包括一般情境中识别已学知识体系并应用、批判反思
既有实验方案及其实验现象、创新设计实验方案深入研究实际化学问
题。许多问题往往是隐含竞争反应,使得表面的主反应消失或反应根本没
机会发生,需要考生想到并设计实验证明其存在,这是测查高阶思维的最佳
时机,也是对氧化还原反应原理巧妙运用的时候。
例2 (2019北京海淀零模,28)某小组同学对FeCl
3
与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I
2
生成,加入的试剂为
。
(2)写出实验Ⅰ反应的离子方程式:
。
(3)结合上述实验现象可以证明Fe
3+
与I
-
发生可逆反应,原因是
。
序号
操作
现象
实验Ⅰ
取5 mL 0.1 mol·L
-1
KI溶液,滴加
0.1 mol·L
-1
FeCl
3
溶液5~6滴(混
合溶液pH=5)
溶液变为棕黄色
实验Ⅱ
取2 mL实验Ⅰ反应后的溶液,滴
加2滴0.1 mol·L
-1
KSCN溶液
溶液呈红色
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ
溶液红色变浅。
(4)已知在酸性较强的条件下,I
-
可被空气氧化为I
2
,故甲同学提出假设:该反
应条件下空气将I
-
氧化为I
2
,使实验Ⅰ中溶液棕黄色变深。甲同学设计实
验:
,20
min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是
(写出两条)。
(5)
乙同学查阅资料可知
:FeCl
3
与
KI
的反应体系中还存在
I
-
+I
2
,
呈棕
褐色。依据资料从平衡移动原理解释实验
Ⅱ
中
20 min
后溶液红色变浅的
原因
:
。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl
3
与KI的反应、I
-
与
I
2
的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证
该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液
体系,具体实验方案为
。
解析 (1)证明有I
2
生成,加入的试剂为淀粉溶液或CCl
4
。
(2)Fe
3+
与I
-
发生氧化还原反应,该反应的离子方程式为2Fe
3+
+2I
-
2Fe
2+
+I
2
。
(3)取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L
-1
KSCN溶液,溶液变红
色,说明KI过量的前提下溶液中仍含铁离子,说明反应不能进行到底,证明
反应为可逆反应。
(4)在酸性较强的条件下,I
-
可被空气氧化为I
2
,故甲同学认为该反应条件下
空气将I
-
氧化为I
2
,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:向试管
中加入5 mL 0.1 mol·L
-1
KI溶液和2滴淀粉溶液,加酸调至pH=5,结果20 min
内溶液不变蓝,证明此条件下I
-
不可被空气氧化为I
2
,导致溶液不变蓝的因
素可能是
c
(I
-
)低、
c
(H
+
)低等原因。
(5)乙同学查阅资料可知隐藏反应I
-
+I
2
,依据资料从平衡移动原理解
释实验Ⅱ中20 min后溶液红色变浅的原因是三价铁把碘离子氧化后,碘单
质又溶解在碘化钾溶液中。
(6)丙同学针对20 min后的实验现象提出时间变量问题,为验证平衡需要时
间,丙同学用4支试管进行实验。得到了颜色由浅到深的四个红色溶液体
系,具体实验方案为向1支试管中加入2 mL 0.1 mol·L
-1
KI溶液,再滴加0.1
mol·L
-1
FeCl
3
溶液2~3滴,滴加2滴0.1 mol·L
-1
KSCN溶液,之后每间隔5 min另
取1支试管重复上述实验,观察4支试管中溶液颜色的变化。
答案 (1)淀粉溶液或CCl
4
(2)2Fe
3+
+2I
-
2Fe
2+
+I
2
(3)实验Ⅱ的实验现象证明KI过量(或Fe
3+
不足量)的情况下仍有Fe
3+
剩余,说
明正反应不能进行到底
(4)向试管中加入5 mL 0.1 mol·L
-1
KI溶液和2滴淀粉溶液,加酸调至pH=5
c
(I
-
)低、
c
(H
+
)低
(5)由于I
-
+I
2
,使
c
(I
2
)减小,2Fe
3+
+2I
-
2Fe
2+
+I
2
正向移动,
c
(Fe
3+
)减小,
Fe
3+
+3SCN
-
Fe(SCN)
3
逆向移动,红色变浅
(6)向第1支试管中加入2 mL 0.1 mol·L
-1
KI溶液,再滴加0.1 mol·L
-1
FeCl
3
溶液
2~3滴,滴加2滴0.1 mol·L
-1
KSCN溶液,之后每间隔5 min另取1支试管重复上
述实验,观察4支试管中溶液颜色的变化
思路分析 实验Ⅰ中发生2Fe
3+
+2I
-
2Fe
2+
+I
2
反应,因为I
-
过量,所以生成
的碘单质又溶于KI溶液(I
-
+I
2
),20分钟后溶液颜色变深。本题突破点
是资料(FeCl
3
与KI的反应体系中还存在I
-
+I
2
,
呈棕褐色)、甲同学实
验结果和实验Ⅱ显红色。