- 2021-08-24 发布 |
- 37.5 KB |
- 19页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习电化学基础作业(全国通用)(6)
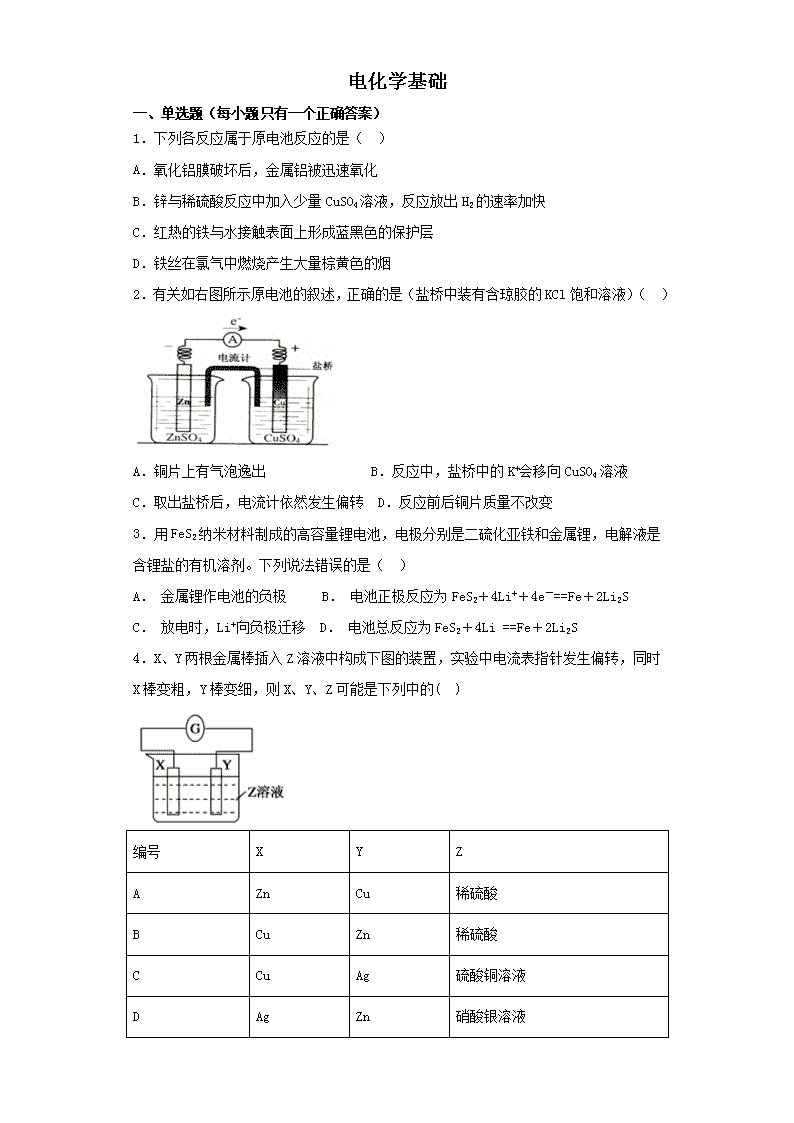
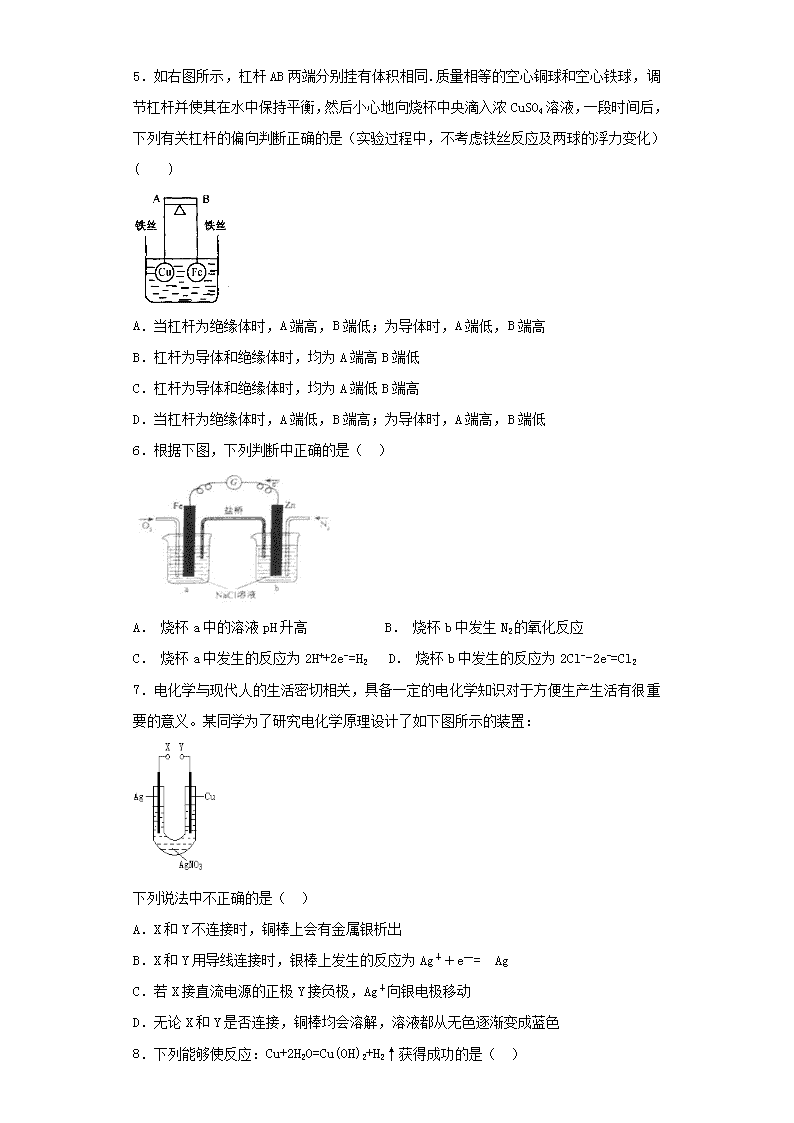
电化学基础 一、单选题(每小题只有一个正确答案) 1.下列各反应属于原电池反应的是( ) A.氧化铝膜破坏后,金属铝被迅速氧化 B.锌与稀硫酸反应中加入少量CuSO4溶液,反应放出H2的速率加快 C.红热的铁与水接触表面上形成蓝黑色的保护层 D.铁丝在氯气中燃烧产生大量棕黄色的烟 2.有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( ) A.铜片上有气泡逸出 B.反应中,盐桥中的K+会移向CuSO4溶液 C.取出盐桥后,电流计依然发生偏转 D.反应前后铜片质量不改变 3.用FeS2纳米材料制成的高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂。下列说法错误的是( ) A. 金属锂作电池的负极 B. 电池正极反应为FeS2+4Li++4e-==Fe+2Li2S C. 放电时,Li+向负极迁移 D. 电池总反应为FeS2+4Li ==Fe+2Li2S 4.X、Y两根金属棒插入Z溶液中构成下图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( ) 编号 X Y Z A Zn Cu 稀硫酸 B Cu Zn 稀硫酸 C Cu Ag 硫酸铜溶液 D Ag Zn 硝酸银溶液 5.如右图所示,杠杆AB两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) A.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 B.杠杆为导体和绝缘体时,均为A端高B端低 C.杠杆为导体和绝缘体时,均为A端低B端高 D.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 6.根据下图,下列判断中正确的是( ) A. 烧杯a中的溶液pH升高 B. 烧杯b中发生N2的氧化反应 C. 烧杯a中发生的反应为2H++2e-=H2 D. 烧杯b中发生的反应为2Cl--2e-=Cl2 7.电化学与现代人的生活密切相关,具备一定的电化学知识对于方便生产生活有很重要的意义。某同学为了研究电化学原理设计了如下图所示的装置: 下列说法中不正确的是( ) A.X和Y不连接时,铜棒上会有金属银析出 B.X和Y用导线连接时,银棒上发生的反应为Ag++e—= Ag C.若X接直流电源的正极Y接负极,Ag+向银电极移动 D.无论X和Y是否连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 8.下列能够使反应:Cu+2H2O=Cu(OH)2+H2↑获得成功的是( ) A. Cu与稀H2SO4发生反应 B. 铜一锌合金在潮湿的空气中发生反应被腐蚀 C. 用铜片作阴、阳电极,电解氯化钠溶液 D. 用铜片作阴、阳电极,电解硫酸溶液 9.下图是锌和铜形成的原电池,某实验兴趣小组做完实验后,在读书卡片上写下了一些记录,其中描述合理的是( ) 卡片:NO:28 日期:2018.6.27 实验后的记录: ①Zn为阳极,Cu为阴极; ②H+向负极移动; ③电子流动方向Zn→Cu; ④Cu极有H2产生; ⑤若有1 mol电子流过导线,则产生H2为0.5 mol; ⑥正极电子反应式:Zn-2e-==Zn2+。 A.①②③ B.③④⑤ C.④⑤⑥ D.②③④ 10.某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )。 A.用铜片、铅笔芯作电极插入稀硫酸中 B.用两个铜片作电极插入硝酸银溶液中 C.用锌片、铜片作电极插入番茄中 D.用铜片、铁片作电极插入酒精中 11.分析如图所示的四个原电池装置,其中结论正确的是( ) A.①②中Mg作为负极,③④中Fe作为负极 B.③中Fe作为负极,电极反应为Fe-2e-=Fe2+ C.④中Cu作为正极,电极反应式为2H++2e-=H2↑ D.②中Mg作为正极,电极反应式为6H2O+6e-=6OH-+3H2↑ 12.利用下图装置电解硫酸铜溶液,下列说法正确的是( ) A.b电极上发生氧化反应 B.该装置能将化学能转变成电能 C.电解质溶液中Cu2+从b电极向a电极迁移D.若a为铜,则a的电极反应式为:Cu-2e-=Cu2+ 13.关于如图所示装置的叙述正确的是( ) A.铜是阳极,铜片上有气泡产生 B.铜离子在铜片表面被氧化 C.电子从锌片经外电路流向铜片 D.正极附近的SO42-离子浓度逐渐增大 14.关于原电池的下列说法中,不正确的是 ( ) A.在负极上发生氧化反应 B.化学性质较活泼的金属为负极 C.在外电路上电子由负极流向正极 D.是由电能转化为化学能的装置 15.锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( ) A. 整个反应过程中,氧化剂为O2 B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH- C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应 D. 通空气时,铜被腐蚀,表面产生Cu2O 二、填空题 16.在医疗上常使用一种热敷袋,袋内盛装的主要成分是:铁屑、碳粉、木屑、食盐、水等。热敷袋使用之前用塑料袋封装,使之与空气隔绝。使用时,打开塑料袋让空气进入,轻揉热敷袋,就会放出热量。使用完后,会发现袋内有许多铁锈生成。试填写下列空白: (1)热敷袋放出的热量来源于_____________________________。 (2)铁屑、碳粉、食盐、水混合后,发生化学变化的原理是_____________________。 (3)写出使用热敷袋的过程中发生的电极反应式和有关的化学方程式: 负极:____________,正极:____________,总反应:___________________。 17.自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。 (1)漂白粉是常用的一种消毒剂,制备过程的化学方程式为 。漂白粉不能与家庭中常用的洁厕剂(一种酸性液体,主要含HCl)混合使用,否则容易造成人体中毒,其原因是(用有关的离子方程式表示) 。 (2)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应可用离子方程式表示为 。 (3)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应式是 。 18.已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。 (1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。 (2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。 (3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”) (4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。 a.各U形管中产生的气体的体积 b.各U形管中阳极质量的减少量 c.各U形管中阴极质量的增加量 19.ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。 (2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。 a.NaOH b.Zn c.Fe d.NH3·H2O 20.(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:) 序号 电压/V 阳极现 检验阳极产物 I x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2 II a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+、无Cl2 III b>x>0 无明显变化 无Fe3+、无Cl2 (1)用KSCN溶液检验出Fe3+的现象是_______。 (2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式_____。 (3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____性。 (4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下: 序号 电压/V 阳极现象 检验阳极产物 IV a>x≥c 无明显变化 有Cl2 V c>x≥b 无明显变化 无Cl2 ①NaCl溶液的浓度是________mol/L。 ②IV中检测Cl2的实验方法:____________________。 ③与II对比,得出的结论(写出两点):___________________。 三、推断题 21. A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。 回答下列问题: (1)B的化学式: 。 (2)写出反应⑦的离子方程式 。 (3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式 。 (4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在 (填“阴、阳”)极附近溶液由无色变为红色,其原因是 。 22.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题。 (1)请写出反应①的化学方程式:_________________。 (2)检验D溶液中Y离子的方法是___________。 (3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式____________。 (4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是______________。 (5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为____________。 四、实验题 23.全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的1/10,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。 (1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为 ▲ 。 (2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母) (3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。 ①为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是 、 。 ②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性;(b) 。 ③准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = 。 ④在本实验中,下列情况会使测定结果n偏大的是 。(填字母) a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3·nH2O 24.某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: 查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题: (1) 操作①的名称是 ; (2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有 。 (3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为 , 操作④相关的化学方程式为 。 (4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中, 。 (填写操作与现象),则证实滤液中含有NH4+。 (5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。 限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液; 限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器 请画出实验装置图,并作相应标注,同时写出正极方程式 五、计算题 25.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、 足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: ①列式计算电极b上生成的气体在标准状态下的体积是多少? ②电极c的质量变化多少克? 26.常温下电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化) ⑴图中曲线________(填Ⅰ或Ⅱ)表示阳极产生气体的变化; ⑵求NaCl和CuSO4的物质的量浓度; ⑶求t2时所得溶液的H+的物质的量浓度。 参考答案 1.B 【解析】 试题分析:氧化铝膜破坏后,金属铝被迅速氧化,这属于化学反应,故A不能选;锌与稀硫酸反应中加入少量CuSO4溶液,其中锌置换出铜,形成了锌铜原电池,使得反应放出H2的速率加快,所以B正确;红热的铁与水接触表面上形成蓝黑色的保护层,这属于化学反应;故C不能选;铁丝在氯气中燃烧产生大量棕黄色的烟,这属于化学反应,故D不能选。 考点:原电池反应 点评:本题考查了有关现象的解释,贴近高考,有一定的综合性,本题是一道不错的选择题,难度适中。 【答案】B 【解析】 试题分析:A、铜的金属性弱于锌,铜是正极,溶液中的铜离子放电,不会产生气体,A错误;B、原电池中阳离子向正极移动,B正确;C、取出盐桥后,不能构成原电池,电流计不会发生偏转,C错误;D、铜片上铜离子放电析出铜,质量增加,D错误,答案选B。 考点:考查原电池原理的判断 3.C 【解析】试题分析:A. 金属锂是活泼金属,作电池的负极,A正确;B. 电池正极是二硫化亚铁得到电子,发生还原反应,电极反应为FeS2+4Li++4e-==Fe+2Li2S,B正确;C. 放电时,Li+向正极迁移,C错误;D. 根据以上分析可知电池总反应为FeS2+4Li ==Fe+2Li2S,D正确,答案选C。 考点:考查新型电源判断 4.D 【解析】首先由题中所给信息(X棒变粗,Y棒变细)可知X棒是正极,Y棒是负极,Y比X活泼,所以选项A、C均错;再看电解质溶液,B选项中硫酸里的H+在正极X棒上得电子生成氢气,X棒不会变粗;只有D选项符合,D选项中负极Y棒Zn失电子生成Zn2+,Y棒变细,Ag+在正极X棒上得电子生成Ag附着在X棒上使其变粗。 5.A 【解析】略 6.A 【解析】试题分析:A.烧杯a中通入氧气,是正极,氧气得到电子转化为氢氧根,因此溶液pH升高,A正确;B.烧杯b中锌是负极,锌失去电子发生氧化反应,B错误;C.烧杯a中发生的反应为O2+2H2O+4e—=4OH—,C错误;D.烧杯b中发生的反应为Zn—2e—=Zn2+,D错误,答案选A。 考点:考查原电池原理的应用 7.C 【解析】 试题分析:X和Y不连接时,铜可以置换出银单质,A选项正确;X和Y用导线连接时,Ag做正极,Cu作负极,B选项正确;若X接直流电源的正极Y接负极,Ag做阳极,Cu作阴极,Ag+向铜电极移动,C选项错误;无论X和Y是否连接,铜都会失去电子变成铜离子,D选项正确。 考点:考查电化学的知识。 8.C 【解析】金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,在反应Cu+2H2O═Cu(OH)2 ↓+H2↑中,失电子的是金属铜,金属铜作阳极材料,其他导电的物质做阴极材料,在阴极上应该是水中的氢离子得电子的反应,可以用硫酸钠等来做电解质。 A、 铜的活沷性比氢弱,Cu与稀H2SO4不发生反应,故A错误。B、用铜片作阴、阳电极,电解氯化铜溶液,阳极失电子生成铜离子,阴极铜离子得到电子析出铜,故B错误;C、 用铜片作阴、阳电极,电解氯化钠溶液,可实现该反应,故C正确;D、用铜片作阴、阳电极,电解硫酸溶液,发生Cu+2H+=Cu2++H2↑,故D错误;故选C。 9.B 【解析】在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,则锌上负极,铜上正极,溶液中的氢离子在正极得到电子,产生氢气,①②⑥是错误的,③④⑤正确,答案选B。 10.C 【解析】要构成原电池,除要形成闭合回路外,还需要有两个活动性不同的电极材料,其中一个电极要能与电解质溶液发生自发的氧化还原反应。A项,铜和石墨与稀硫酸均不反应;B项,电极材料相同;D项,酒精是非电解质;C 项,一些水果中含有有机酸,可作电解质溶液。 11.D 【解析】 试题分析:A、②中Mg 与氢氧化钠不发生氧化还原反应,铝能与氢氧化钠反应,所以铝是负极,镁是正极,A项错误;B、铁在浓硝酸中钝化,铜与浓硝酸反应,铁做正极,B项错误;C、铁的活泼性强,所以铁作负极,C项错误;D、②中Mg 与氢氧化钠不发生氧化还原反应,铝能与氢氧化钠反应,所以铝是负极,镁是正极,D项正确;答案选D。 考点:考查原电池 12.D 【解析】 试题分析:A、b电极为阴极,发生还原反应,错误;B、电解把电能转变为化学能,错误;C、根据电流的方向可推出,Cu2+从a电极向b电极迁移,错误;D、若a为铜,铜作阳极,失去电子,电极反应式为:Cu-2e-= Cu2+,正确。 考点:本题考查电极原理。 13.C 【解析】 试题分析:本题考查原电池原理。含有盐桥的铜锌原电池中,较活泼的金属锌作负极,失电子发生氧化反应,电极反应为Zn - 2e- = Zn2+;较不活泼的金属铜作正极,正极上得电子发生还原反应,电极反应式Cu2+ + 2e-=Cu;电子从负极沿导线流向正极。A、铜是正极,电极反应式为Cu2+ + 2e-=Cu,铜片上有金属铜析出,错误;B、铜离子在铜片表面得电子,被还原,错误;C、电子从锌片经外电路流向铜片,正确;D、盐桥中的阴离子向硫酸锌溶液中迁移,阳离子向硫酸铜溶液中迁移,正极附近的SO42-离子浓度基本不变,错误。 考点:考查原电池原理。 14.D 【解析】在原电池中负极方式氧化反应,正极方式还原反应,电子通过导线从负极流向正极。原电池是把化学能转化为电能氮装置,电解池才是把电能转化为化学能的装置,答案选D。 15.C 【解析】A,根据题意,该电池通过一种复杂的铜腐蚀“现象”产生电力,放电过程中消耗Cu2O,由此可见通入空气Cu腐蚀生成Cu2O,由放电反应推知Cu极电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,Cu2O又被还原成Cu,整个过程中Cu相当于催化剂,氧化剂为O2, A项正确;B,放电时正极的电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,B项正确;C,放电时负极电极反应式为Li-e-=Li+,电路中通过0.1mol电子生成0.1molLi+,Li+透过固体电解质向Cu极移动,反应中消耗O2物质的量为=0.025mol,在标准状况下O2的体积为0.025mol22.4L/mol=0.56L,C项错误;D,放电过程中消耗Cu2O,由此可见通入空气Cu腐蚀生成Cu2O,D项正确;答案选C。 16.(1)铁屑被氧化;(2)铁屑、碳与氯化钠溶液组成原电池,碳作正极,铁作负极,加快铁的氧化;(3)2Fe-4e-=2Fe2+,O2+2H2O+4e-=4OH-,2Fe+O2+2H2O=2Fe(OH)2、4Fe(OH)2+2H2O+O2=4Fe(OH)3、Fe(OH)3Fe2O3·xH2O。 【解析】 试题分析:(1)构成原电池,铁作负极,碳作正极,发生吸氧腐蚀,因此热量来自于铁的被氧化;(2)发生吸氧腐蚀,铁作负极,碳作正极,氧气得电子,氯化钠溶液作电解质,构成吸氧腐蚀;(3)电极反应式为:负极:2Fe-4e-=2Fe2+,正极:O2+2H2O+4e-=4OH-,总反应是:2Fe+O2+2H2O=2Fe(OH)2、4Fe(OH)2+2H2O+O2=4Fe(OH)3、Fe(OH)3Fe2O3·xH2O。 考点:考查吸氧腐蚀、原电池的应用、电极反应式的书写等知识。 17.(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl-+ClO-+2H+=Cl2↑+H2O (2)3ClO-+2Fe(OH)3+4OH-=3Cl-+2FeO42-+5H2O (3)3Zn-6e-+10OH-=2ZnO22-+ZnO+5H2O 【解析】 试题分析:(1)工业上制备漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。漂白粉具有强氧化性,在酸性溶液中能把氯离子氧化为氯气,氯气有毒,容易造成人体中毒,有关的离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O。 (2)在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁制备高铁酸钾,其中铁元素的化合价从+3价升高到+6价,失去3个电子,氯元素的化合价从+1价降低到-1价,得到2个电子,依据电子得失守恒可知该反应的离子方程式为3ClO-+2Fe(OH)3+4OH-=3Cl-+2FeO42-+5H2O。 (3)原电池的负极失去电子,发生氧化反应,则根据方程式可知负极是锌失去电子,电极反应式为3Zn-6e-+10OH-=2ZnO22-+ZnO+5H2O。 考点:考查氧化还原反应及电极反应式的书写 18. 负 PbO2+4H++SO42-+2e-=PbSO4+2H2O 减小 2H++2e-=H2↑ 0.4 Cu-2e-=Cu2 + 不变 B 【解析】试题分析:(1)当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g,说明铁作阳极,银作阴极,阴极连接原电池负极,所以A是负极,B是正极,正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,放电过程中消耗硫酸,硫酸溶液的密度随浓度减小而减小,故电解的密度减小; (2)银作阴极,电解稀硫酸时,阴极上氢离子放电生成氢气,电极反应式为2H++2e-═H2↑,生成氢气的质量=0.4mol/2×2g/mol=0.4g; (3)铜作阳极,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-═Cu2+,阴极上析出铜,所以该装置是电镀池,电解质溶液中铜离子浓度不变; (4)右边U形管不析出气体,左边U形管析出气体,所以稀硫酸析出气体体积大于硫酸铜溶液,a错误;当转移相等电子时,溶解金属的物质的量相等,铜的摩尔质量大于铁,所以右边U形管阳极减少的质量大于左边U形管阳极减少的质量,b正确;当转移相等电子时,析出物质的物质的量相等,但铜的摩尔质量大于氢气,所以左边U形管析出氢气的质量小于右边U形管析出铜的质量,c错误。 考点:考查电解原理及计算 19. (1)Zn(或锌) 正极 (2)锌与还原出来的铜构成铜锌原电池而加快锌的腐蚀 b 【解析】 试题分析:Zn(或锌)正极 , (2)锌与还原出来的铜构成铜锌原电池而加快锌的腐蚀。 考点:燃料电池 20.(1)溶液变为血红色 (2)2Cl--2e-=Cl2↑;2Fe2++Cl2=2Fe3++2Cl-; (3)还原 (4)①0.2②取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝 ③通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了Fe2+先于Cl-放电 【解析】试题分析:(1)铁离子与KSCN反应生成血红色络合物,故现象为溶液变为血红色; (2)Cl-在阳极放电,电解反应式为2Cl--2e-=Cl2↑,生成的氯气氧化Fe2+为Fe3+,方程式为:2Fe2++Cl2=2Fe3++2Cl-; (3)因为阳极产物无Cl2,又Fe2+具有还原性,故也可能是Fe2+在阳极放电,被氧化为Fe3+; (4)①因为为对比实验,故Cl-浓度应与电解FeCl2的相同,即为0.1mol/L ×2=0.2mol/L; ②检测氯气可以用淀粉碘化钾试纸,可取少量阳极附近的溶液,滴在淀粉KI试纸上,若试纸变蓝色,则说明有氯气存在; ③与II对比可知,IV中电解氯化亚铁时,电压较大a>x≥c时,氯离子放电产生氯气,即说明Fe3+可能是由氯气氧化亚铁离子得到;电压较小c>x≥b时,氯离子不放电,即还原性Fe2+>Cl-,同时也说明了铁离子也可能是由亚铁离子直接放电得到的。故结论为:①通过控制电压,证实了产生Fe3+的两种原因都成立;②通过控制电压,验证了Fe2+先于Cl-放电。 考点:本题考查铁离子的检验、电解原理、氯气的检验等知识。 21.(1)Na2O2 (2)Cl2+2OH-=Cl-+ClO-+H2O (3)2Na2O2+2H2O=4NaOH+O2↑、AlCl3+3NaOH=3NaCl+Al(OH)3↓ (4)阴极;在阴极由于H+得到电子产生氢气,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色 【解析】 试题分析:已知常温下A为固体单质,B为淡黄色粉末,则B是过氧化钠,因此A是钠,C是氧气。E在常温下为液体,则E是水,过氧化钠与水反应生成氢氧化钠和氧气,因此D是氢氧化钠。钠与水反应生成氢氧化钠和氢气,因此F是氢气。J可用作杀菌消毒剂,J是由I单质气体和氢氧化钠反应生成,实验I是氯气,J是次氯酸钠,所以G是氯化氢,H是氯化钠。 (1)根据以上分析可知B是过氧化钠,化学式为Na2O2。 (2)氯气与氢氧化钠溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。 (3)过氧化钠溶于水生成氢氧化钠和氧气,氢氧化钠能与氯化铝反应生成氢氧化铝沉淀,所以向AlCl3溶液中加入少量固体过氧化钠的化学方程式为2Na2O2+2H2O=4NaOH+O2↑、AlCl3+3NaOH=3NaCl+Al(OH)3↓。 (4)惰性电极电解氯化钠溶液,阴极由于H+得到电子产生氢气,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色。 考点:考查无机框图题的判断 22.(1)Fe2O3+2Al2Fe+Al2O3 (2)取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变血红色,则证明有Fe3+ (3)2Al+2OH-+2H2O===2AlO2-+3H2↑ (4)2FeSO4+H2SO4+2NaNO2===2Fe(OH)SO4+Na2SO4+2NO↑ (5)54 g 【解析】 试题分析:已知X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,说明A为Fe2O3,X为铝,它们通过铝热反应生成氧化铝(B)和铁(单质Y);D与Fe反应生成E,则试剂b为盐酸,D、E分别是氯化铁和氯化亚铁。据此回答: (1)反应①是铝与氧化铁发生铝热反应,化学方程式为Fe2O3+2Al2Fe+Al2O3 (2) 检验D(FeCl3 )溶液中Y(Fe3+)离子的方法是取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变血红色,则证明有Fe3+ (3)Al与NaOH溶液反应生成偏铝酸钠和氢气,化学反应方程式为2Al+2OH-+2H2O===2AlO2-+3H2↑。 (4)若试剂b为硫酸,则E为FeSO4(铁的化合价为+2价)→Fe(OH)SO4(铁的化合价为+3价),而NaNO2(氮的化合价为+3价)→NO(氮的化合价为+2价),根据电子得失守恒、质量守恒定律配平,反应化学方程式为2FeSO4+H2SO4+2NaNO2===2Fe(OH)SO4+Na2SO4+2NO↑。 (5)阳极反应:2O2--4e- =O2↑,33.6 L氧气的物质的量为1.5mol,转移电子数为6 mol,阴极反应:Al3++3e-=Al,可以得到2 mol的Al,质量为2 mol×27 g·mol-1=54g. 考点:考查物质的推断,铁、铝及其化合物的性质,铝热反应,化学方程式的书写,电解的有关计算。 23.共12分。 (1)2Fe + O2+ 2H2O =2Fe(OH)2(2分) (2)d(2分) (3) ①浓NaOH溶液(1分) 浓硫酸(1分) ②通入混合气体一段时间(2分) ③2(2分) ④ a(2分) 24.(1)溶解 (2)坩埚,C(碳) (3)二氧化锰(MnO2) 2H2O22H2O+O2↑ (4)加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近,试纸变蓝色 (5) 正极方程式:Cu2+ + 2e- = Cu 【解析】 试题分析:(1) 普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。把混合物加入水中搅拌使NH4Cl、ZnCl2等容易溶解的物质充分溶解,而MnO2不能溶解于水。以便于混合物的分离。因此操作①的名称是溶解。(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、坩埚、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质含有碳单质。将黑色固体放入盛有过氧化氢的水溶液中,看到产生大量的气体。该操作④的化学方程式为2H2O22H2O+O2↑(4)检验铵根离子 NH4+的方法是取少许滤液于试管加入浓氢氧化钠溶液并加热,将湿润的红色石蕊试纸置于试管口附近,试纸变为蓝色,证实滤液中含有NH4+。(5)证明Cu、Zn活动性强弱的实验装置图碱答案。其中正极电极式为Cu2+ + 2e- = Cu;负极电极式为Zn-2e-=Zn2+。 考点:考查普通锌锰电池的黑色物质成分的确定及Zn、Cu活动性强弱的比较的实验设计的知识。 25.(1)2.8L。(2)16g 【解析】①丙中为K2SO4,相当于电解水,设电解的水的质量为x,由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为=0.125mol,标况下的体积为0.125×22.4=2.8L;②整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e-=Cu,可知转移0.5mol电子生成的m(Cu)=×64=16g。 26.(1)Ⅱ (2)c(NaCl)=0.1mol/L;c(CuSO4)= 0.1mol/L (3)0.1mol/L 【解析】(1 )电解池中阳极失去电子,阴极得到电子,所以根据离子的放电顺序可知,阴极首先是铜离子放电,吸出铜单质,然后是氢离子放电,生成氢气。阳极首先是氯离子是放电,生成氯气,然后是OH-放电生成氧气。所以曲线Ⅱ是表示阳极产生气体的变化。 (2)根据图像可知生成的氯气是224ml,物质的量是0.01mol,转移电子是0.02mol。则氯化钠是0.02mol,所以浓度是c(NaCl)=0.02mol÷0.2L=0.1mol/L;t2时铜离子恰好放电完毕,此时生成氧气是336ml-224ml=112ml,物质的量是0.005mol,则转移电子是0.02mol,所以根据电子的得失守恒可知,析出铜是0.02mol。因此硫酸铜是0.02mol,浓度是c(CuSO4)=0.02mol÷0.2L=0.1mol/L。 (3)根据(2)可知,在生成0.005mol氧气的同时,溶液中生成氢离子是0.02mol,所以浓度是0.02mol÷0.2L=0.1mol/L。查看更多