- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山西省朔州市怀仁某校2018-2019学年高一上学期期中考试化学试卷
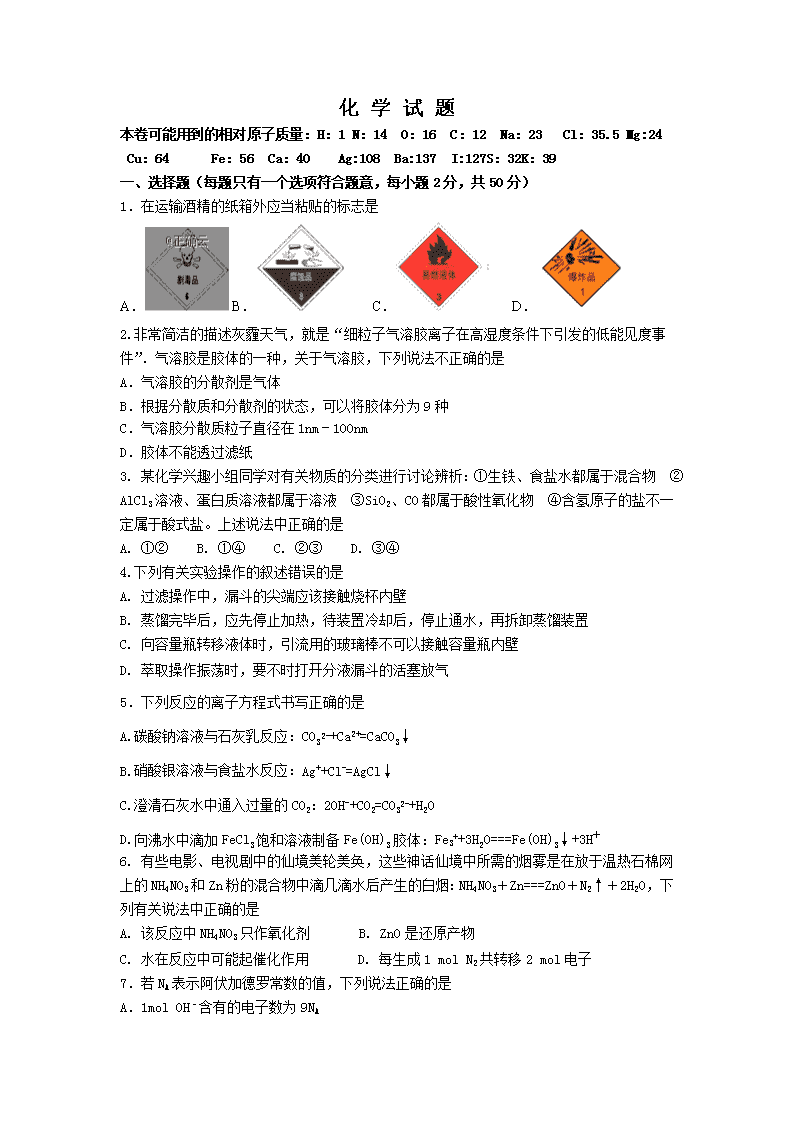
化 学 试 题 本卷可能用到的相对原子质量:H:1 N:14 O:16 C:12 Na:23 Cl:35.5 Mg:24 Cu:64 Fe:56 Ca:40 Ag:108 Ba:137 I:127S:32K:39 一、 选择题(每题只有一个选项符合题意,每小题2分,共50分) 1.在运输酒精的纸箱外应当粘贴的标志是 A. B. C. D. 2.非常简洁的描述灰霾天气,就是“细粒子气溶胶离子在高湿度条件下引发的低能见度事件”.气溶胶是胶体的一种,关于气溶胶,下列说法不正确的是 A.气溶胶的分散剂是气体 B.根据分散质和分散剂的状态,可以将胶体分为9种 C.气溶胶分散质粒子直径在1nm﹣100nm D.胶体不能透过滤纸 3. 某化学兴趣小组同学对有关物质的分类进行讨论辨析:①生铁、食盐水都属于混合物 ②AlCl3溶液、蛋白质溶液都属于溶液 ③SiO2、CO都属于酸性氧化物 ④含氢原子的盐不一定属于酸式盐。上述说法中正确的是 A. ①② B. ①④ C. ②③ D. ③④ 4.下列有关实验操作的叙述错误的是 A. 过滤操作中,漏斗的尖端应该接触烧杯内壁 B. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 C. 向容量瓶转移液体时,引流用的玻璃棒不可以接触容量瓶内壁 D. 萃取操作振荡时,要不时打开分液漏斗的活塞放气 5.下列反应的离子方程式书写正确的是 A.碳酸钠溶液与石灰乳反应:CO32-+Ca2+=CaCO3↓ B.硝酸银溶液与食盐水反应:Ag++Cl-=AgCl↓ C.澄清石灰水中通入过量的CO2:2OH-+CO2=CO32-+H2O D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O===Fe(OH)3↓+3H+ 6. 有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是在放于温热石棉网上的NH4NO3和Zn粉的混合物中滴几滴水后产生的白烟:NH4NO3+Zn===ZnO+N2↑+2H2O,下列有关说法中正确的是 A. 该反应中NH4NO3只作氧化剂 B. ZnO是还原产物 C. 水在反应中可能起催化作用 D. 每生成1 mol N2共转移2 mol电子 7.若NA表示阿伏加德罗常数的值,下列说法正确的是 A.1mol OH﹣含有的电子数为9NA B.标准状况下,NO2和N2O4的混合物23g中含有NA个氧原子 C.常温常压下,2.8gN2和2.24L CO所含电子数均为1.4NA D.标准状况下,22.4 L 乙醇中含有NA个乙醇分子 8.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.0.1 mol•L﹣1的Na2CO3溶液:K+、Ba2+、NO3-、Cl﹣ B.0.1 mol•L﹣1FeCl3溶液:K+、NH4+、I﹣、OH﹣ C.强酸性溶液:CO32﹣、NH4+、Cl﹣、Na+ D.能使酚酞变红的溶液中:K+、Na+、SO42-、CH3COO﹣ 9.下列反应必须加入氧化剂才能实现的是 A.CH4→CO2 B.KMnO4→K2MnO4 C.SO2→SO32﹣ D.H2O2→O2 10.同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是 A.甲与乙的相对分子质量之比等于x:y B.等质量的甲与乙的分子个数之比等于x:y C.同温同压下甲与乙的密度之比等于x:y D.同温同体积下等质量的甲与乙的压强之比等于y:x 11.下列除去杂质方法正确的是 A.除去CO2中混有的CO:用浓NaOH溶液洗气 B.除去BaCO3固体中混有的BaSO4:加过量稀盐酸后,过滤、洗涤 C.除去KNO3溶液中混有的NaCl:蒸发结晶 D.除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤 12.某溶液中大量存在五种离子:NO3﹣、SO42﹣、Fe3+、H+、X,其物质的量之比为:n(NO3﹣):n(SO42﹣):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为 A.Al3+ B.Mg2+ C.Cl﹣ D.Ba2+ 13.已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+ Cr2(SO4)3+K2SO4+7H2O,③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.下列结论正确的是 A.①②③均是氧化还原反应 B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2 C.反应②中氧化剂与还原剂的物质的量之比为6:1 D.反应③中0.1mol还原剂共失去电子数为1.2×1022 14.研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的是 A.维生素C能将+5价砷氧化成As2O3 B.维生素C具有还原性 C.致人中毒过程中+5价砷发生还原反应 D.青菜中含有维生素C 15.已知M2On2﹣离子可与R2﹣离子作用,R2﹣ 被氧化为R单质,M2On2﹣的还原产物中,M为+3价;又如c(M2On2-)=0.3mol/L的溶液100mL可与c(R2﹣ )=0.6mol/L的溶液150mL恰好完全反应,则n值为 A.4 B.5 C.6 D.7 16. 某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是 A.Na2CO3 NaCl NaOH B.NaOH NaCl Na2CO3 C.NaCl NaOH Na2CO3 D.NaCl Na2CO3 NaOH 17.质量分数为a%的氨水,物质的量浓度为c1 mol•L﹣1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L﹣1,则c1和c2的数值关系是 A.c2=2c1 B.c2>2c1 C.c2<2c1 D.无法确定 18.已知某饱和氯化钠溶液的体积为V mL,密度为ρ g•mL﹣1,质量分数为w,物质的量浓度为c mol•L﹣1,溶液中所含NaCl的质量为m g.下列选项正确的是 A.该温度下NaCl的溶解度S= g B.溶液中溶质的物质的量浓度c(NaCl)= mol•L﹣1 C.溶液中溶质的物质的量浓度c(NaCl)= mol•L﹣1 D.溶液中溶质的质量分数w=% 19.某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中 A.一定有SO42﹣ B.可能有SO42﹣或Ag+ C.一定无Ag+ D.还可能有CO32﹣ 20.下列对实验操作分析错误的是 A.配制0.1mol/L NaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的量浓度偏低 B.NH4NO3溶解吸热,若配制0.5mol/L NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则所得溶液的物质的量浓度偏高 C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的量浓度偏高 D.配制一定物质的量浓度溶液时,若定容中不小心加水超过刻度线,立刻将超出的水吸出,则所得溶液的物质的量浓度偏低 21.常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是 A.硫酸溶液的体积为25 mL B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 C.d时刻溶液中c(OH-)=0.05mol·L-1 D.溶液的导电能力:c查看更多
相关文章
- 当前文档收益归属上传用户