- 2021-08-24 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省启东市2020届高三下学期期初考试化学试题
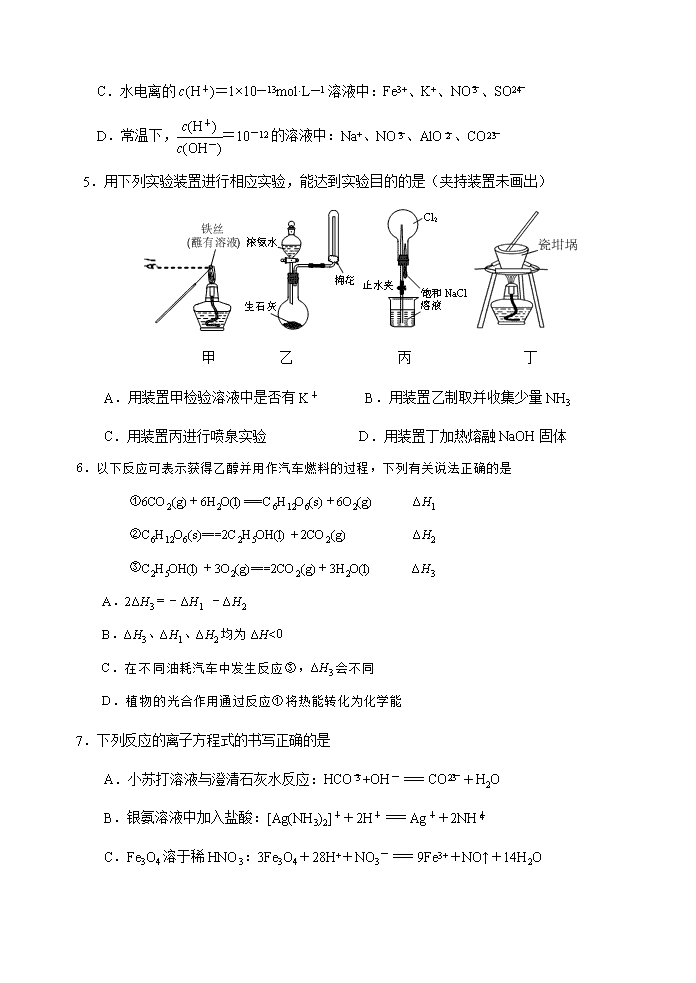
2019-2020高三第二学期期初学生素质调研测试 高三化学试卷 可能用到的相对原子质量:H1 C 12 N 14 O 16 Mg 24 Fe 56 S 32 Cl 35.5 选择题(共40分) 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 1. 节约资源、保护环境,共同守护我们赖以生存的地球是每个人的责任。下列做法值得 提倡的是 A.推进垃圾分类处理 B.将秸秆就地焚烧 C.加快开采化石燃料 D.使用含磷洗涤剂 2.用化学用语表示2H2S+3O22SO2+2H2O中的相关微粒,其中正确的是 A.H2S的结构式:H-S-H B.H2O的比例模型: C.中子数为18的硫原子:S D.S的结构示意图: 3.下列有关物质性质与用途具有对应关系的是 A.Al2O3熔点很高,可用作耐高温材料 B.浓硫酸具有脱水性,可用于干燥氯气 C.FeCl3溶液显酸性,可用于蚀刻印刷电路 D.SiO2具有导电性,可由于制作光导纤维 4.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.澄清透明溶液中:Al3+、NH、CO、NO B.能使石蕊变红的溶液:Fe2+、Na+、NO、SO C.水电离的c(H+)=1×10—13mol·L—1溶液中:Fe3+、K+、NO、SO D.常温下,=10-12的溶液中:Na+、NO、AlO、CO 5.用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出) 甲 乙 丙 丁 A.用装置甲检验溶液中是否有K+ B.用装置乙制取并收集少量NH3 C.用装置丙进行喷泉实验 D.用装置丁加热熔融NaOH固体 6.以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是 ①6CO2(g)+6H2O(l)===C6H12O6(s)+6O2(g) ΔH1 ②C6H12O6(s)===2C2H5OH(l)+2CO2(g) ΔH2 ③C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH3 A.2ΔH3=-ΔH1 -ΔH2 B.ΔH3、ΔH1、ΔH2均为ΔH<0 C.在不同油耗汽车中发生反应③,ΔH3会不同 D.植物的光合作用通过反应①将热能转化为化学能 7.下列反应的离子方程式的书写正确的是 A.小苏打溶液与澄清石灰水反应:HCO+OH-=CO+H2O B.银氨溶液中加入盐酸:[Ag(NH3)2]++2H+=Ag++2NH C.Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O D.向硫酸氢钠溶液滴加氢氧化钡溶液至中性:H++ SO+Ba2++ OH-=H2O+BaSO4↓ 8.短周期主族元素X、Y、Z、W、Q原子序数依次增大, X、Z同主族且与Y处于不同周期,Y、W同主族且W的原子序数是Y的两倍,以下说法正确的是 A.原子半径:r(W)>r(Z)>r(Y)>r(X) B.由Y、Z组成的化合物中可能含共价键 C.W元素最高价氧化物对应的水化物的酸性比Q强 D.Y的简单气态氢化物的热稳定性比W的弱 9.在给定的条件下,下列选项所示的物质间转化均能实现的是 A. B. C. D. 10.一种可充电锂-空气电池的工作原理如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是 A.放电时,多孔碳材料电极为负极 B.放电时,外电路电子由多孔碳材料电极流向锂电极 C.充电时,电解质溶液中Li+向多孔碳材料区迁移 D.充电时,电池总反应为Li2O2-x 2Li +(1﹣)O2 不定项选择题:本题包括5小题,每小题4分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.下列说法正确的是 A.2NO(g) + 2CO(g) =N2(g) + 2CO2 (g)在常温下可自发进行,则该反应的ΔH>0 B.一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3) C.向0.1 mol·L-1CH3COONa溶液中加入少量水,溶液中比值增大 D.Na2O2与足量的水反应生成0.2 mol O2,转移电子数目为0.8×6.02×1023 12.黄檀内酯是一种具有抗肿瘤、抗菌、抗氧化等生物活性的天然化合物,可由香兰素为原料合成(如下图所示)。 下列说法正确的是 A.①、②分子中碳原子一定都处于同一平面 B.①、②均能与浓溴水反应 C.化合物①能与NaHCO3反应产生CO2 D.1mol化合物②最多只能与3molNaOH反应 13.根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 结论 A 向久置Na2SO3溶液中,加入足量稀硝酸,再加入足量BaCl2溶液,出现白色沉淀 久置Na2SO3已部分被氧化 B C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性 反应生成了乙烯 KMnO4溶液,紫红色褪去 C 常温下,向浓度均为0.1 mol·L-1的CuSO4和MgSO4的混合溶液中逐滴滴加NaOH溶液,先生成蓝色沉淀 Ksp[Cu(OH)2<Ksp[Mg (OH)2] D 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 非金属性:S>C 14.25℃时,将0.1mol·L—1NaOH溶液逐滴滴加到20mL0.1mol·L—1H2SO3溶液中,所得溶 液的pH与滴加NaOH的体积关系如右图所示。下列指定溶液浓度关系说法正确的是 已知:pKa =-lgKa,25℃时H2SO3的 pKa1=1.85,pKa2=7.19。 A.a点所得溶液中: c(H2SO3)>c(Na+)>c(H+)>c(HSO) B.b点所得溶液中: 2c(SO)+ c(H2SO3)<c(Na+) C.c点所得溶液中: =10-2.67 D.d点所得溶液中: c(OH)= c(HSO)+ 2c(H2SO3) + c(H+) 15.700℃时,向容积为1 L的恒容密闭容器中充入一定量的CO和H2,发生如下反应: CO(g)+2H2(g)CH3OH(g),反应过程中测定的部分数据见下表: 反应时间/min n(CO)/mol n(H2)/ mol 0 0.30 0.60 20 0.10 30 0.20 下列说法正确的是 A.反应在20 min内的平均速率为v(H2)=0. 04mol·L-1·min-1 B.保持其他条件不变,升高温度,平衡时c(CH3OH)= 0.15 mol·L-1,则反应的ΔH<0 C.保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 molCH3OH,达到新平衡前v(正)<v(逆) D.相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率小于 非选择题(共80分) 16.(12分)MnSO4·H2O在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、SiO2等杂质)制备,部分工艺流程如下: H2SO4 MnO2 氨水 MnF2 NH4HCO3和 氨水的混合物 高铁菱 锰矿 酸浸 氧化 调pH 除杂 MnCO3··· MnSO4•H2O 沉锰 滤渣2 滤渣1 滤渣3 相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol·L—1计算): 金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ 开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 (1)“氧化”时发生反应的离子方程式为 ▲ 。 (2)“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有 ▲ 。 (3)“除杂”过程中加入MnF2的目的是 ▲ 。 (4)“沉锰”过程中发生反应的化学方程式为 ▲ 。 (5)MnSO4在水中的溶解度与温度关系如右图。 由MnCO3获得较纯净的MnSO4·H2O晶体的 方法是:将MnCO3溶于适量的稀硫酸,控制温 度在80 ℃~90 ℃之间蒸发结晶, ▲ ,得到 MnSO4·H2O晶体,洗涤、烘干。晶体通常采 用减压烘干的原因是 ▲ 。 17.(15分)化合物H是一种抗血栓药物,其合成路线流程图如下: (1)A中的官能团名称为 ▲ (写两种)。 (2)C + G → H 的反应类型为 ▲ 。 (3)环状分子E 的分子式为C5H8O2,写出E的结构简式: ▲ 。 (4)写出同时满足下列条件的C的一种同分异构体的结构简式 ▲ 。 ①含有苯环和一种含氧官能团,能与FeCl3溶液发生显色反应; ②分子中有三键,有一个手性碳原子,有5种不同化学环境的氢。 (5)已知: 写出以(显碱性,易被氧化)、ClCH2CH2COCl、ClCH2COCl为原料制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 ▲ 。 18.(12分) 以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量: 将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用MgCO3调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。 (1)30.00mL 2.500 mol·L−1的稀硫酸至少能溶解原料的质量为 ▲ 。 (2)加MgCO3调节pH促进Fe3+水解,写出总反应的离子方程式为 ▲ 。 (3)已知:Ksp[Fe(OH)3]=1.0×10−39,Ksp[Mg(OH)2]=1.0×10−12。 室温下,若溶液中c(Mg2+)=0.01mol·L−1,欲使溶液中的c(Fe3+)≤1×10−6mol·L−1,需调节溶液pH范围为 ▲ 。 (4)常采用下列方法测定结晶硫酸镁中Mg2+的含量: 已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2−)形成配合物 ②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+ 步骤1: 准确称取得到的硫酸镁晶体6.00g加入过量的EDTA,配成100mL pH在9~10之间溶液A 步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.20mol·L−1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL 步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.20 mol·L−1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为 30.00mL。 计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程)。 ▲ 。 19.(15分)工业上以浓缩海水(含较高浓度的Br-)为原料提取溴的部分流程如下: 已知:3Br2+3CO=5Br-+BrO+3CO2↑。 图甲 图乙 (1)实验室制取纯净氯气部分装置如图甲,装置E的作用是 ▲ 。 (2)反应釜2中发生反应的离子方程式为 ▲ 。 (3)实验室用图乙所示装置模拟流程中的部分过程。 ①通入热空气的作用是 ▲ 。 ②烧杯C中所盛溶液是 ▲ 。 ③烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是 ▲ 。 (4)对反应后烧瓶B中的溶液进行如下实验,请补充完整相关实验步骤。 限选用的试剂为:稀硫酸、四氯化碳、澄清石灰水。 ①检验烧瓶B的溶液中是否含有CO。 取烧瓶B中的溶液适量,加入试管中,再加入过量的稀硫酸酸化; ▲ 。 ②从反应后烧瓶B溶液中提取溴单质。 向烧瓶B中加入过量的稀硫酸酸化; ▲ 。 20.(14分)烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热 点。 (1)工业上可以采用“质子膜电解槽”对烟气进行脱硫脱硝,其工艺如图甲所示: 图甲 ①“NaOH溶液吸收装置”SO2主要反应的化学方程式为 ▲ 。 ②电解的主要目的是 ▲ ;阴极的电极反应式为 ▲ 。 ③“高价氮的化合物”中NO2在反应器中发生化合反应的化学方程式为 ▲ 。 (2)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的NO2与活性焦炭 反应生成N2和CO2,当生成1 mol N2时,转移的电子数为 ▲ mol。 n(NO2)/n(NO) 去除率% 图乙 (3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0. 05 mol·L−1的Ca(OH)2乳浊液中,发生的反应为: 3NO2 + 2OH-=NO +2NO+ H2O; NO+NO2+2OH-=2NO+H2O。 改变n(NO2)/n(NO),NOx的去除率如图乙所示。 ①当n(NO2)/ n(NO)大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是 ▲ 。 ②O3和NO发生的主要反应为:NO + O3=NO2 + O2。保持NO的初始浓度不变,改变n(O3) / n(NO),将反应后的混合气体通入0.05mol·L−1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则n(O3) / n(NO)合适的值约为 ▲ 。 a.0.4 b.0.6 c.1.2 21.(12分)FeCl3溶液中的Fe3+可用KSCN溶液检验,还可与苯酚发生显色反应,用于酚羟基的检验。 (1)Fe3+基态核外电子排布式为 ▲ 。 (2)与SCN-互为等电子体且为非极性分子的化学式为 ▲ 。(填化学式)。 (3)苯酚中碳原子与氧原子的轨道杂化类型分别是 ▲ ;1mol苯酚分子中含有的σ 键的数目为 ▲ 。 图甲 图乙 (4)普鲁士蓝俗称铁蓝,结构如图甲所示(K+未画出),平均每两个立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为 ▲ 。 (5)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)。查看更多