高中化学第2章化学反应速率和化学平衡第3节化学平衡第5课时化学平衡图象等效平衡课后提能层级练新人教版选修4 2
第五课时 化学平衡图象 等效平衡
课后提能 层级练
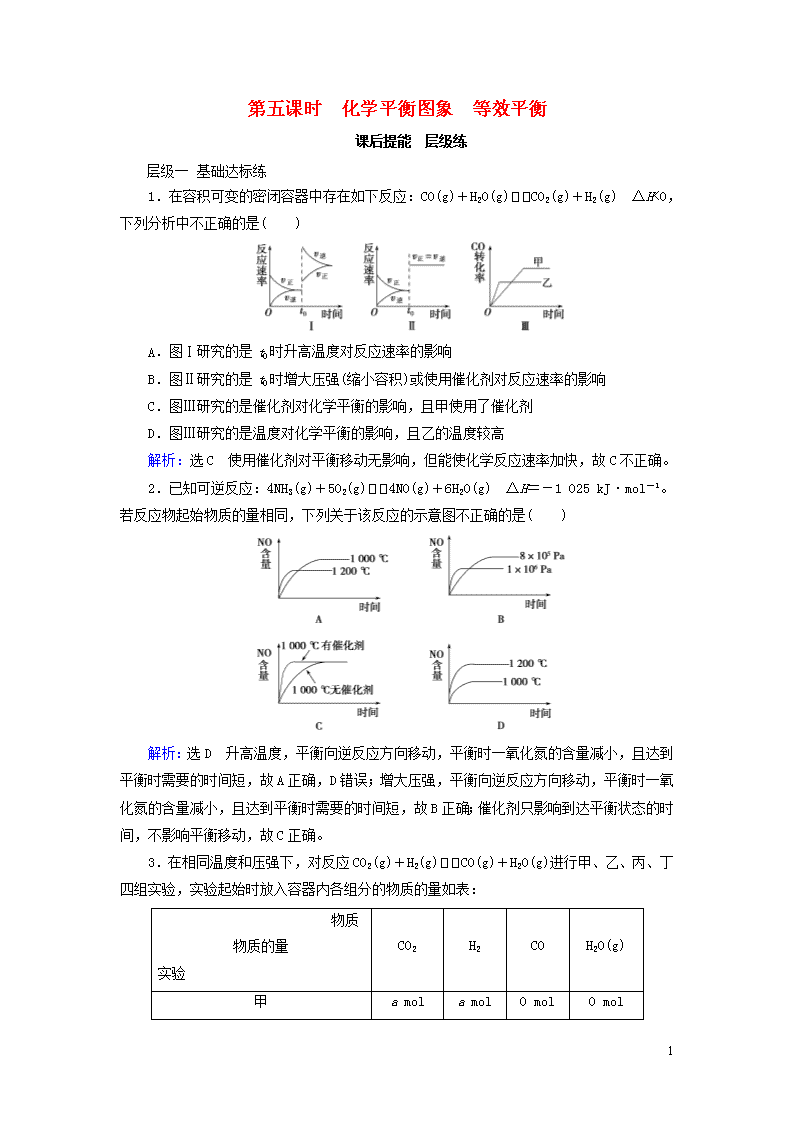
1.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
解析:选C 使用催化剂对平衡移动无影响,但能使化学反应速率加快,故C不正确。
2.已知可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
解析:选D 升高温度,平衡向逆反应方向移动,平衡时一氧化氮的含量减小,且达到平衡时需要的时间短,故A正确,D错误;增大压强,平衡向逆反应方向移动,平衡时一氧化氮的含量减小,且达到平衡时需要的时间短,故B正确;催化剂只影响到达平衡状态的时间,不影响平衡移动,故C正确。
3.在相同温度和压强下,对反应CO2(g)+H2(g)CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量如表:
物质的量
实验
CO2
H2
CO
H2O(g)
甲
a mol
a mol
0 mol
0 mol
12
乙
2a mol
a mol
0 mol
0 mol
丙
0 mol
0 mol
a mol
a mol
丁
a mol
0 mol
a mol
a mol
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
解析:选A 根据所给数据,甲、丙为等效平衡,则其中n(CO)相等。乙相当于甲平衡后,再加入a mol CO2,平衡右移,n(CO)增大,丁把CO、H2O折合成反应物相当于2a mol CO2、a mol H2,和乙等效,所以乙=丁>丙=甲。
4.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
解析:选D 因为容器绝热,所给反应的正反应为放热反应,容器Ⅰ的温度升高,容器Ⅱ的温度降低,故反应速率Ⅰ中比Ⅱ中快,A项错误;由于容器Ⅲ中加入的反应物多,放出的热量也多,容器内温度比Ⅰ高,故二者的平衡常数不同,B项错误;因容器Ⅰ的温度高,故相当于平衡逆向移动,CO的物质的量比容器Ⅱ中多,C项错误;如果容器Ⅰ和容器Ⅱ在温度相同的情况下达到平衡,CO、CO2转化率之和等于1,但容器Ⅰ的温度升高,平衡逆向移动,CO的转化率降低,容器Ⅱ温度降低,CO2的转化率也降低,D项正确。
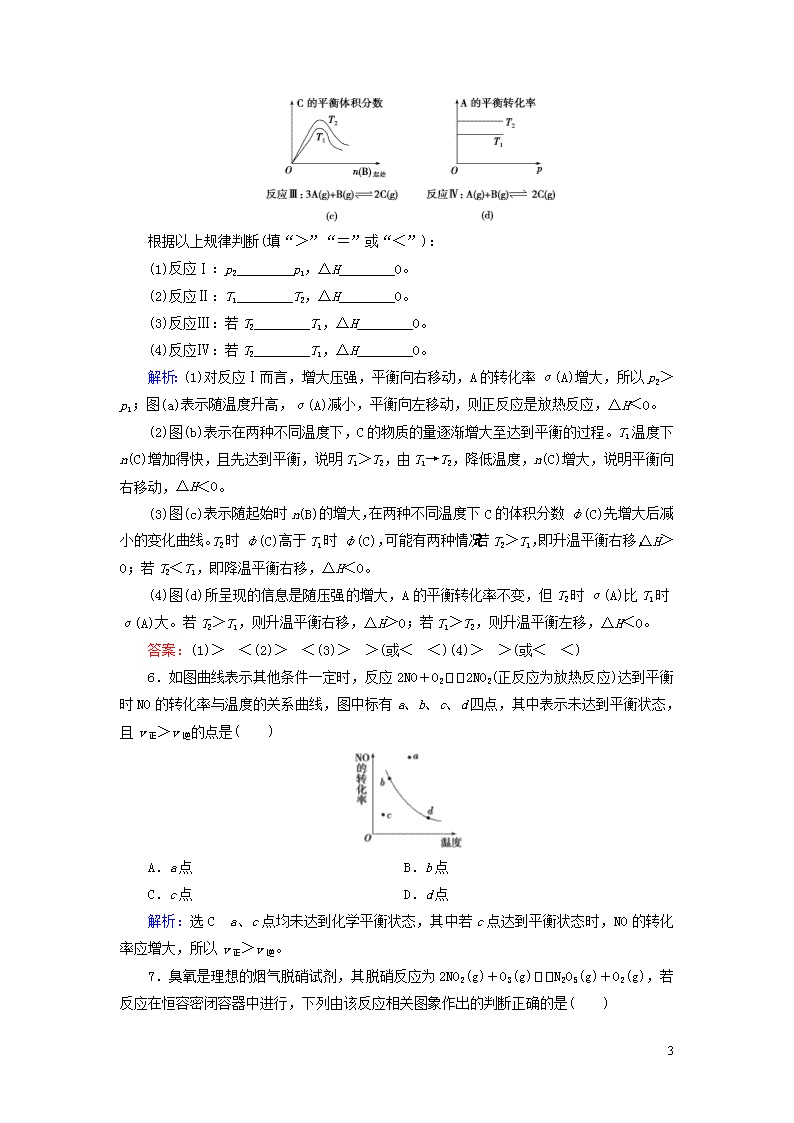
5.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):
12
根据以上规律判断(填“>”“=”或“<”):
(1)反应Ⅰ:p2________p1,ΔH________0。
(2)反应Ⅱ:T1________T2,ΔH________0。
(3)反应Ⅲ:若T2________T1,ΔH________0。
(4)反应Ⅳ:若T2________T1,ΔH________0。
解析:(1)对反应Ⅰ而言,增大压强,平衡向右移动,A的转化率α(A)增大,所以p2>p1;图(a)表示随温度升高,α(A)减小,平衡向左移动,则正反应是放热反应,ΔH<0。
(2)图(b)表示在两种不同温度下,C的物质的量逐渐增大至达到平衡的过程。T1温度下n(C)增加得快,且先达到平衡,说明T1>T2,由T1→T2,降低温度,n(C)增大,说明平衡向右移动,ΔH<0。
(3)图(c)表示随起始时n(B)的增大,在两种不同温度下C的体积分数φ(C)先增大后减小的变化曲线。T2时φ(C)高于T1时φ(C),可能有两种情况:若T2>T1,即升温平衡右移,ΔH>0;若T2<T1,即降温平衡右移,ΔH<0。
(4)图(d)所呈现的信息是随压强的增大,A的平衡转化率不变,但T2时α(A)比T1时α(A)大。若T2>T1,则升温平衡右移,ΔH>0;若T1>T2,则升温平衡左移,ΔH<0。
答案:(1)> <(2)> <(3)> >(或< <)(4)> >(或< <)
6.如图曲线表示其他条件一定时,反应2NO+O22NO2(正反应为放热反应)达到平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )
A.a点 B.b点
C.c点 D.d点
解析:选C a、c点均未达到化学平衡状态,其中若c点达到平衡状态时,NO的转化率应增大,所以v正>v逆。
7.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
12
A
升高温度,平衡常数减小
B
0~3 s内,反应速率为v(NO2)=0.2 mol·L-1
C
t1时仅加入催化剂,平衡正向移动
D
达平衡时,仅改变x,则x为c(O2)
解析:选A A项,从能量变化的图象分析,该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,正确;B项,依据化学反应速率的计算公式:v(NO2)==0.2 mol·L-1·s-1,单位不对,错误;C项,催化剂会同等程度地改变正、逆反应速率,所以加入催化剂,平衡不移动,错误;D项,增大c(O2),平衡逆向移动,NO2的转化率降低,错误。
8.已知图一表示的是可逆反应CO(g)+H2(g)C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
A.若图一t2时改变的条件是增大压强,则反应的ΔH增大
B.图一t2时改变的条件可能是升高了温度或增大了压强
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
解析:选B 改变压强不会改变焓变,A错误;升温、增大压强,v逆均小于v正,B正确;图二t1时改变的条件应是压缩体积,C错误;增大压强,2NO2N2O4平衡右移,总物质的量减小,平均相对分子质量增大,D错误。
12
9.N2O5是硝酸的酸酐,它也是一种新型的绿色硝化剂。一定温度下N2O5有如下反应:
2N2O5(g)4NO2(g)+O2(g) ΔH>0
反应达平衡后,改变以下图象中横坐标所表示的条件,其变化情况正确的是( )
解析:选A 该反应温度升高时,平衡向正反应方向移动,故平衡常数增大,反应物浓度降低,A项正确,B项不正确;增大压强,平衡逆向移动,v正、v逆都增大,平均相对分子质量增大,C、D项均不正确。
10.某化学科研小组研究合成氨:N2(g)+3H2(g)2NH3(g) ΔH<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图象,以下对应选项中正确的是( )
A.甲对应的是在t1时恒压条件下,通入NH3
B.乙对应的是氨气在恒容不同温度下的百分含量
C.丙对应的是在恒容条件下,反应速率与温度的关系
D.丁对应的是N2转化率与温度(T1>T2)、压强的关系
解析:选B 恒压条件下充入NH3,平衡不移动,v正=v逆,与题给图象甲不符,故A项不正确;T2温度反应先平衡,反应速率大,故T2>T1,升高温度,平衡向吸热方向移动,即逆向移动,NH3%减小,与题给图象乙相符,故B项正确;图丙中v正和v逆相交表示v正=v逆,此时反应达到平衡,升高温度,平衡向吸热方向移动,v正
0,D错误。
12.在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
容器
甲
乙
丙
反应物投入量
1 mol N2、3 mol H2
2 mol N2、6 mol H2
2 mol NH3
NH3的浓度/mol·L-1
c1
c2
c3
反应的能量变化
放出Q1 kJ
放出Q2 kJ
吸收Q3 kJ
体系压强/Pa
p1
p2
p3
反应物转化率
α1
α2
α3
A.2p1=2p3p2,A错误;丙容器中加入2 mol NH3,最后达到和甲相同的平衡状态,若平衡不移动,则转化率α1+α3=1;乙容器投入2 mol N2、6 mol H2,相当于增大压强,平衡正向移动,转化率增大,所以转化率α2+α3>1,C错误;甲投入1 mol N2、3 mol H2,丙中投入2 mol NH3,则甲与丙是完全等效的,根据盖斯定律可知,甲与丙的反应的能量变化之和为92.4 kJ,故Q1+Q3=92.4,D正确。
13.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g) 2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是( )
A.平均相对分子质量
B.SO3(g)的转化率
C.c(SO3)/c(SO2)
D.c2(SO3)/[c2(SO2)·c(O2)]
解析:选B 本题可采取等效假设法分析,假设在原容器上增加一个相同的容器(两容器有隔板),保持温度不变,向增加的容器中充入相同体积的SO3(g),则可建立与原平衡一样的平衡,此时A、B、C、D各项的值均不变,然后抽掉隔板,将容器压缩至原容器大小,则压强增大,平衡逆向移动,气体的总物质的量减小,但总质量不变,因此平均相对分子质量增大;SO3(g)的转化率减小;c(SO2)、c(SO3)均增大,但c(SO3)增大的程度比c(SO2)增大的程度大,则c(SO3)/c(SO2)增大;c2(SO3)/[c2(SO2)·c(O2)]可看作该反应的平衡常数的倒数,而平衡常数只与温度有关,则不发生变化。
14.已知2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2 ;(丙)2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
解析:选B 因为反应2SO2(g)+O2(g)2SO3(g)在恒温、恒容的条件下进行。根据等效平衡的原理可知,甲与丙最后达到平衡时SO2、O2、SO3的物质的量、容器内的压强、SO2
12
与O2的比值都相同;乙相当于在甲容器达到平衡后,将容器的体积瞬间扩大为原来的2倍。设甲达到平衡时容器内的压强为p甲,此时容器内瞬间压强减小为p甲/2,此时平衡向逆反应方向移动,气体的物质的量增加,SO3的质量减小,所以容器内气体的压强增大,则p乙>p甲/2,则2p乙>p甲=p丙,SO3的质量m甲=m丙>2m乙,A错、B对;当甲容器达到平衡后瞬间将容器体积扩大2倍,平衡向逆反应方向移动,但是生成的SO2与O2的物质的量之比为2∶1,这与开始两者加入的物质的量之比相同,所以在此过程中SO2与O2的物质的量之比一直是2∶1不变,C错;甲与丙为等效平衡,但达到平衡时,甲容器中SO2的转化率与丙容器中SO3的转化率不一定相等,即Q甲不一定等于Q丙,D错。
1.有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g)2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________ mol(从下列各项中选择,只填字母,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________ mol。
A.小于m B.等于m
C.在m~2m之间 D.等于2m E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始时应加入________ mol N2和________ mol H2。
解析:(1)由于甲容器定容,达到平衡时,甲、乙两容器压强相等,乙的容积应该为甲的两倍,生成的NH3的物质的量应该等于2m mol。当甲、乙两容器的体积相等时,相当于将建立等效平衡后的乙容器压缩,故乙中NH3的物质的量大于2m mol。
(2)当乙的容积为甲的一半时,要建立与甲一样的平衡,只有乙中的投入量是甲的一半才行,故乙中应该投入N2为(1-0.5) mol=0.5 mol,H2为(1.5-1.5) mol=0 mol。
答案:(1)D E(2)0.5 0
2.(1)对于反应:2NO(g)+O2(g)2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
①比较p1、p2的大小关系:________。
12
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”或“减小”)。
(2)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
①反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________ mol·L-1·s-1;反应的平衡常数K1为________。
②100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a.T__________(填“大于”或“小于”)100 ℃,判断理由是
________________________________________________________________。
b.列式计算温度T时反应的平衡常数K2:__________________________。
③温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是______________________。
解析:(1)①该反应正反应方向是气体物质的量减小的反应,增大压强,平衡正向移动,即压强越大,NO的转化率越大,根据题图可知,相同的温度下,压强为p1时的NO转化率小于压强为p2时的转化率,故p10;由图示知60 s时该反应达到平衡,消耗N2O4为0.100 mol·L-1-0.040 mol·L-1=0.060 mol·L-1,根据v=可知:v(N2O4)==0.001 0 mol·L-1·s-1;求平衡常数可利用三段式:
N2O4(g)2NO2(g)
起始量/mol·L-1 0.100 0
转化量/mol·L-1 0.060 0.120
平衡量/mol·L-1 0.040 0.120
12
K1===0.36。
②100 ℃时达平衡后,改变反应温度为T,c(N2O4)降低,说明平衡N2O4(g)2NO2(g)向正反应方向移动,根据勒夏特列原理,温度升高,平衡向吸热的方向移动,即向正反应方向移动,故T>100 ℃;由c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡,可知此时消耗N2O4为0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1,
由三段式:
N2O4(g)2NO2(g)
起始量/mol·L-1 0.040 0.120
转化量/mol·L-1 0.020 0.040
平衡量/mol·L-1 0.020 0.160
K2===1.28。
③温度T时反应达到平衡后,将反应容器的容积减小一半,压强增大,平衡会向气体体积减小的方向移动,该反应逆反应为气体体积减小的反应,故平衡向逆反应方向移动。
答案:(1)①p2>p1 ②减小(2)①大于 0.001 0 0.36 ②a.大于 反应正方向吸热,反应向吸热方向进行,故温度升高 b.平衡时,c(NO2)=0.120 mol·L-1+0.002 0 mol·L-1·s-1×10 s×2=0.160 mol·L-1,c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1,K2==1.28 ③逆反应 将反应容器的容积减小一半,即增大压强,当其他条件不变时,增大压强,平衡向气体物质化学计量数减小的方向移动,即向逆反应方向移动
3.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇:CO(g)+2H2(g)CH3OH(g)。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________。
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
容器
反应物投入的量
反应物
的转化率
CH3OH
的浓度
能量变化(Q1、
Q2、Q3均大于0)
甲
1 mol CO和2 mol H2
α1
c1
放出Q1 kJ热量
12
乙
1 mol CH3OH
α2
c2
吸收Q2 kJ热量
丙
2 mol CO和4 mol H2
α3
c3
放出Q3 kJ热量
则下列关系正确的是________(填字母)。
A.c1=c2 B.2Q1=Q3
C.2α1=α3 D.α1+α2=1
E.该反应若生成1 mol CH3OH,则放出(Q1+Q2) kJ热量
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________ (填“正”或“逆”)反应方向移动。
解析:(1)从反应开始到平衡的10 min内,CO的浓度减小0.75 mol·L-1,故用H2浓度变化表示平均反应速率v(H2)=×2=0.15 mol·L-1·min-1。
(2)甲和乙属于等效平衡,只是起始反应方向不同,所以有c1=c2和α1+α2=1,该反应若生成1 mol CH3OH,则放出(Q1+Q2) kJ热量;丙相当于将甲的压强增大一倍,增大压强,平衡CO(g)+2H2(g)CH3OH(g)右移,但可逆反应不可能完全转化,故有α1<α3<2α1和Q1p2>p1 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提高CO的转化率,而反应③为气体分子数不变的反应,而生成CO的量不受压强影响。故增大压强时,有利于CO的转化率提高
12