- 2021-08-24 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习10化学反应中的能量变化课件(18张)
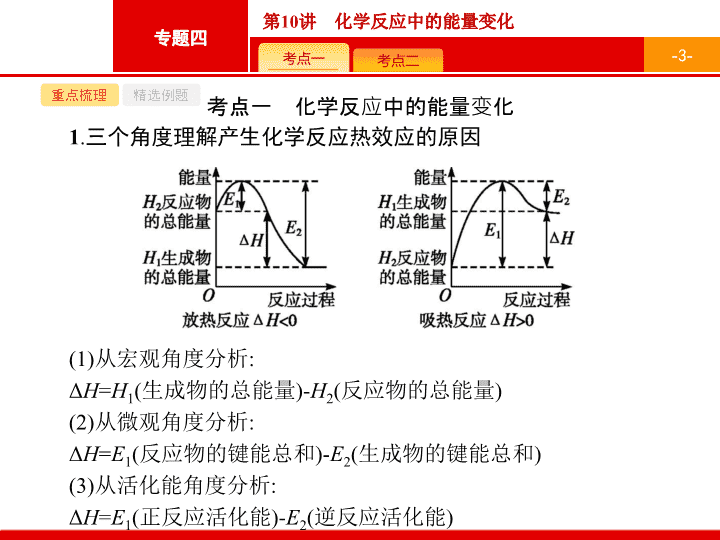
专题四 化学反应原理 第 10 讲 化学反应中的能量变化 考点一 化学反应中的能量变化 1 . 三个角度理解产生化学反应热效应的 原因 (1) 从宏观角度分析 : Δ H = H 1 ( 生成物的总能量 )- H 2 ( 反应物的总能量 ) (2) 从微观角度分析 : Δ H = E 1 ( 反应物的键能总和 )- E 2 ( 生成物的键能总和 ) (3) 从活化能角度分析 : Δ H = E 1 ( 正反应活化能 )- E 2 ( 逆反应活化能 ) - 3 - 重点梳理 精选例题 - 4 - 重点梳理 精选例题 2 . 两种重要的 反应热 - 5 - 重点梳理 精选例题 (2018·4· 浙江选考 ) 氢卤酸的能量关系如图所示 , 下列说法正确的是 ( ) A. 已知 HF 气体溶于水放热 , 则 HF 的 Δ H 1 <0 B. 相同条件下 ,HCl 的 Δ H 2 比 HBr 的小 C. 相同条件下 ,HCl 的 (Δ H 3 +Δ H 4 ) 比 HI 的大 D. 一定条件下 , 气态原子生成 1 mol H—X 键放出 a kJ 能量 , 则该条件下 Δ H 2 = a kJ· mol -1 答案 解析 解析 关闭 A 项 ,Δ H 1 为 HX 从溶液变成气体吸收的能量 , 即 Δ H 1 >0, 错误 ;B 项 ,Cl 的非金属性比 Br 的强 , 故稳定性 :HCl>HBr, 对应的 Δ H 2 更大 , 错误 ;C 项 ,HI 的 (Δ H 3 +Δ H 4 ) 与 HCl 的相等 , 错误 ;D 项 ,Δ H 2 即为 H—X 键能 ,Δ H 2 = a kJ· mol -1 , 正确。 答案 解析 关闭 D - 6 - 重点梳理 精选例题 跟踪训练 1 . 已知 Zn(s)+H 2 SO 4 (aq ) ZnSO 4 (aq )+H 2 (g) Δ H <0, 则下列叙述不正确的是 ( ) A. 该反应的 Δ H 值与反应物用量无关 B. 该反应的化学能可以转化为电能 C. 反应物的总能量高于生成物的总能量 D. 该反应中反应物的化学键断裂放出能量 , 生成物的化学键形成吸收能量 答案 解析 解析 关闭 A 项 ,Δ H 值与反应方程式的计量数有关 , 与反应物的用量无关 , 正确 ;B 项 , 该反应可以设计为原电池 , 正确 ;C 项 , 该反应为放热反应 , 正确 ;D 项 , 化学键断裂吸收能量 , 化学键形成放出能量 , 错误。 答案 解析 关闭 D - 7 - 重点梳理 精选例题 2 . 已知 1 g 氢气完全燃烧生成液态水时放出热量 143 kJ,18 g 水蒸气变成液态水放出 44 kJ 的热量。其他相关数据如下表 : 则表中 x 为 ( ) A.920 B.557 C.463 D.188 答案 解析 解析 关闭 答案 解析 关闭 - 8 - 重点梳理 精选例题 规律小结 从两个角度理解放热反应和吸热反应 (1) 从反应物和生成物的总能量相对大小的角度分析 反应物的总能量之和大于所有生成物的总能量之和为放热反应 ; 反应物的总能量之和小于所有生成物的总能量之和为吸热反应。 (2) 从反应热的量化参数 —— 键能的角度分析 - 9 - 重点梳理 精选例题 考点二 热化学方程式 1 . 热化学方程式书写的 “ 四步 ” - 10 - 重点梳理 精选例题 2 . 热化学方程式正误判断的 “ 五审 ” - 11 - 重点梳理 精选例题 (2018· 宁波高三检测 )Na 2 CO 3 (aq) 与盐酸反应过程中的能量变化示意图如下 , 下列选项正确的是 ( ) - 12 - 重点梳理 精选例题 答案 解析 解析 关闭 答案 解析 关闭 - 13 - 重点梳理 精选例题 跟踪训练 1 .(2018· 杭州统测 ) 依据叙述 , 写出下列反应的热化学方程式。 (1) 用 N A 表示阿伏加德罗常数的值 , 在 C 2 H 2 ( 气态 ) 完全燃烧生成 CO 2 和液态水的反应中 , 每有 4 N A 个电子转移时 , 放出 450 kJ 的热量 , 其热化学方程式为 。 (2) 已知拆开 1 mol H—H 键、 1 mol N—H 键、 1 mol N ≡ N 键分别需要的能量是 436 kJ 、 395 kJ 、 940 kJ, 则 N 2 与 H 2 反应生成 NH 3 的热化学方程式为 。 - 14 - 重点梳理 精选例题 - 15 - 重点梳理 精选例题 - 16 - 重点梳理 精选例题 2 . 已知化学反应 A 2 (g)+B 2 (g ) 2AB(g ) 的能量变化如图所示 , 请写出该反应的热化学方程式 : 。 答案 : A 2 (g)+B 2 (g ) 2AB(g ) Δ H =+( a - b ) kJ· mol -1 解析 : 由图可知 , 生成物总能量高于反应物总能量 , 故该反应为吸热反应 ,Δ H =+( a - b ) kJ· mol -1 。 - 17 - 重点梳理 精选例题 规律小结 热化学方程式书写 “ 七 ” 注意 (1) 注明反应条件 : 反应热与测定条件 ( 温度、压强等 ) 有关。若反应是在 25 ℃ 、 101 kPa 下进行的 , 可不注明。 (2) 注明物质状态 : 常用 s 、 l 、 g 、 aq 分别表示固体、液体、气体、溶液。 (3) 注意符号单位 :Δ H 应包括 “+” 或 “-” 、数字和单位 (kJ · mol -1 ) 。 (4) 注意守恒关系 : ① 原子守恒和得失电子守恒 ; ② 能量守恒 (Δ H 与化学计量数相对应 ) 。 - 18 - 重点梳理 精选例题 (5) 区别于普通方程式 : 一般不注 “↑”“↓”“ 点燃 ” 以及 “ 加热 ” 等。 (6) 注意热化学方程式的化学计量数 : 热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量 , 可以是整数 , 也可以是分数。且化学计量数必须与 Δ H 相对应 , 如果化学计量数乘以某一数值 , 则 Δ H 也要乘以相同数值。 (7) 同素异形体转化的热化学方程式除了注明状态外 , 还要注明物质名称。查看更多