- 2021-08-24 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省郑州市第一〇六中学2018-2019学年高二上学期第一次月考化学试卷
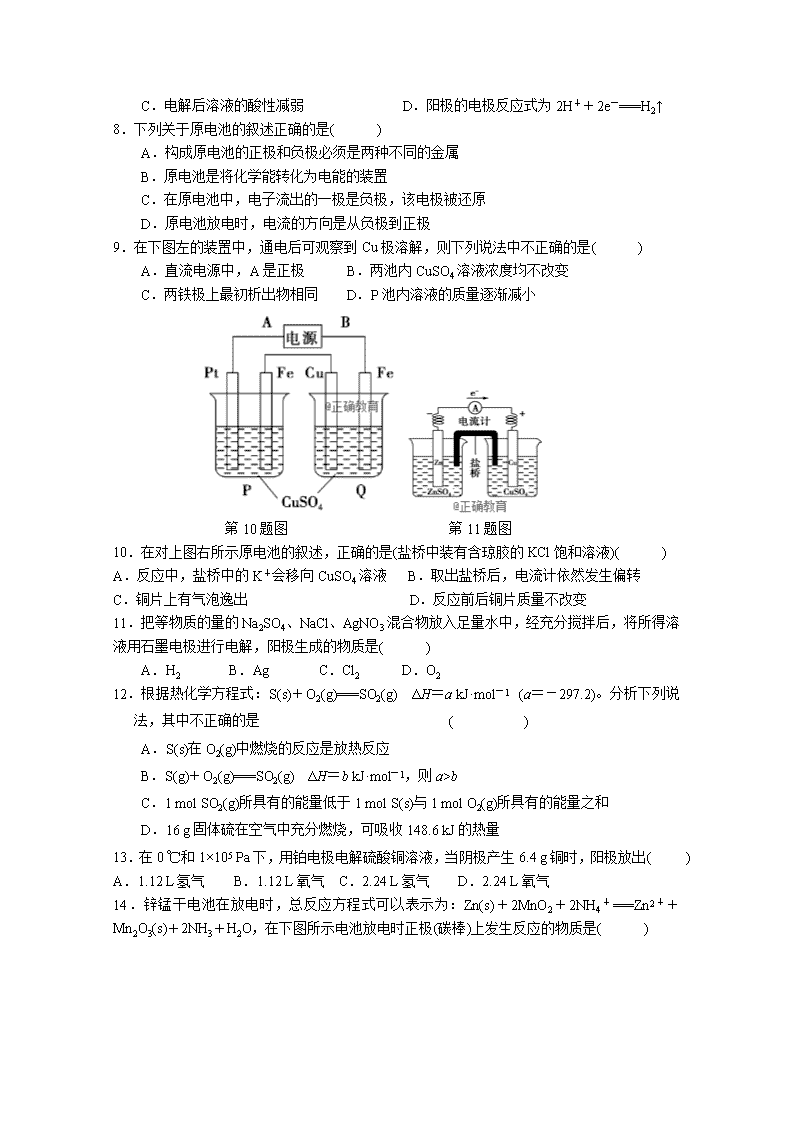
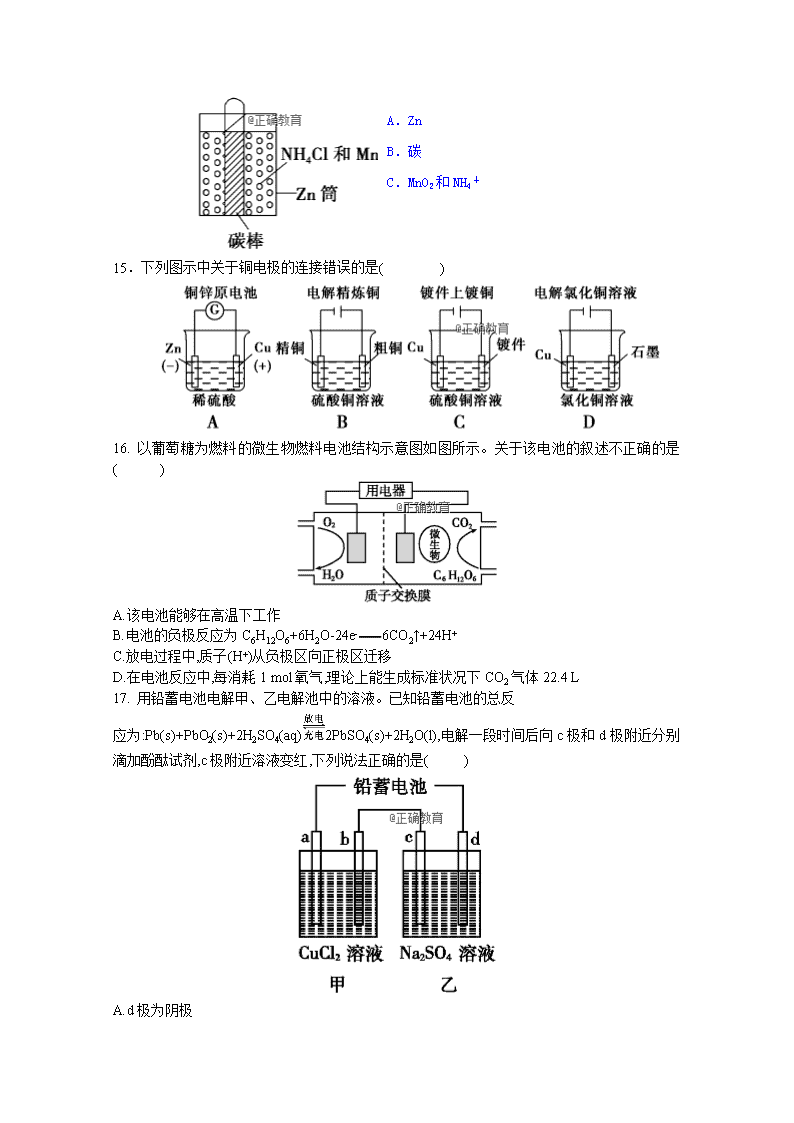
郑州106中学 2018年9月 月考化学试题 (可能用到的相对原子质量H:1 N:17 Cu:64 ) 一、 选择题(每小题只有一个选项符合题意,每小题3分,共51分) 1.下列反应中,反应产物的总焓大于反应物的总焓的是( ) A.氢气在氧气中燃烧 B.铁丝在氧气中燃烧 C.硫在氧气中燃烧 D.焦炭在高温下与水蒸气反应 2.热化学方程式C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ·mol-1表示( ) A.碳和水反应吸收131.3 kJ能量 B.1 mol碳和1 mol水反应生成一氧化碳和氢气并吸收131.3 kJ热量 C.1 mol固态碳和1 mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJ D.1个固态碳原子和1分子水蒸气反应吸收131.3 kJ热量 3.已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ(b>0),则乙炔燃烧的热化学方程式正确的是( ) A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1 B.C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=2b kJ·mol-1 C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1 D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=b kJ·mol-1 4.已知热化学方程式: ①C(金刚石,s)+O2(g)===CO2(g) ΔH1 ②C(石墨,s)+O2(g)===CO2(g) ΔH2 ③C(石墨,s)===C(金刚石,s) ΔH3=1.9 kJ·mol-1 下列说法正确的是( ) A.石墨转化成金刚石的反应是吸热反应 B.金刚石比石墨稳定 C.ΔH3=ΔH1-ΔH2 D.ΔH1>ΔH2 5.已知下列热化学方程式: Zn(s)+O2(g)===ZnO(s) ΔH1=-351.1 kJ·mol-1 Hg(l)+O2(g)===HgO(s) ΔH2=-90.7 kJ·mol-1 由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( ) A.-441.8 kJ·mol-1 B.-254.6 kJ·mol-1 C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1 6.下列关于电解池的叙述中,正确的是( ) A.电解池中的闭合回路仅是由电子的定向移动形成的 B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 C.在电解质溶液中,阴离子向阴极移动,阳离子向阳极移动 D.相同时间内,阳离子在阴极上得到电子与阴离子在阳极上失去电子的总数相等。 7.用石墨电极电解某酸溶液时,在相同条件下,阴、阳两极收集到的气体的体积比是2∶1,则下列结论正确的是( ) A.阴极一定是H2,阳极一定是O2 B.该酸可能是盐酸 C.电解后溶液的酸性减弱 D.阳极的电极反应式为2H++2e-===H2↑ 8.下列关于原电池的叙述正确的是( ) A.构成原电池的正极和负极必须是两种不同的金属 B.原电池是将化学能转化为电能的装置 C.在原电池中,电子流出的一极是负极,该电极被还原 D.原电池放电时,电流的方向是从负极到正极 9.在下图左的装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是( ) A.直流电源中,A是正极 B.两池内CuSO4溶液浓度均不改变 C.两铁极上最初析出物相同 D.P池内溶液的质量逐渐减小 第10题图 第11题图 10.在对上图右所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( ) A.反应中,盐桥中的K+会移向CuSO4溶液 B.取出盐桥后,电流计依然发生偏转 C.铜片上有气泡逸出 D.反应前后铜片质量不改变 11.把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( ) A.H2 B.Ag C.Cl2 D.O2 12.根据热化学方程式:S(s)+O2(g)===SO2(g) ΔH=a kJ·mol-1 (a=-297.2)。分析下列说法,其中不正确的是 ( ) A.S(s)在O2(g)中燃烧的反应是放热反应 B.S(g)+O2(g)===SO2(g) ΔH=b kJ·mol-1,则a>b C.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 13.在0 ℃和1×105 Pa下,用铂电极电解硫酸铜溶液,当阴极产生6.4 g铜时,阳极放出( ) A.1.12 L氢气 B.1.12 L氧气 C.2.24 L氢气 D.2.24 L氧气 14.锌锰干电池在放电时,总反应方程式可以表示为:Zn(s)+2MnO2+2NH4+===Zn2++Mn2O3(s)+2NH3+H2O,在下图所示电池放电时正极(碳棒)上发生反应的物质是( ) A.Zn B.碳 C.MnO2和NH4+ D.Zn2+和NH3 15.下列图示中关于铜电极的连接错误的是( ) 16. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述不正确的是( ) A.该电池能够在高温下工作 B.电池的负极反应为C6H12O6+6H2O-24e-6CO2↑+24H+ C.放电过程中,质子(H+)从负极区向正极区迁移 D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4 L 17. 用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反 应为:Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( ) A.d极为阴极 B.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+S(aq)+2e-PbSO4 (s)+2H2O (l) C.若利用甲池精炼铜,b极应为粗铜 D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) 二、填空题(共49分) 18.写出下列反应的热化学方程式: (1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量: ________________________________________________________________________ (2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量: ________________________________________________________________________ 19.将0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为 ________________________________________________________________________ 又已知:H2O(l)===H2O(g) ΔH=44 kJ·mol-1,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是________kJ。 20.用石墨作电极电解下列溶液①稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4溶液 ⑤KOH溶液 (1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号)__________,其阳极的电极反应式都是_________________________________________________, 阴极的电极反应式都是_________________________________________________, 总反应的化学方程式都是_________________________________________________。 (2)阴极、阳极都有气体产生,其中溶液酸性增强的是____________________。 (填序号)。 (3)一个电极析出金属,另一个电极逸出刺激性气味气体的是_______(填序号), 其阳极的电极反应式是___________________________________________。 21.如下图所示,甲、乙为相互串联的两电解池。 试回答: (1)乙池中Fe电极为 极。若在乙池中滴入少量酚酞试液,开始电解一段时间后,铁电极附近呈 色。 (2)甲池若为精炼铜(假设粗铜的组成是均匀的,且其中活泼和不活泼的成份均存在)的装置,则电解质溶液可以是 ;通过一段时间后,A电极增重12.8g,则乙池石墨电极放出的气体在标准状况下的体积为 。 22.(1)下列反应中,在理论上可设计成原电池的化学反应是________(填序号),理由是_____________________________________________________。 A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0 B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(l)+8H2O(l) ΔH>0 C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0 D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0 (2)电解原理在化学工业中有着广泛的应用,现将你设计的 原电池通过导线与右图中电解池相连,其中,a为电解液, X和Y是两块电极板,则: ① 若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时, 检验Y电极反应产物的方法是__________________________________________。 ②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程Y电极极的电极反应式是___________________________________________________________________。 23.(12分)认真观察下列装置,回答下列问题: (1)装置B中PbO2上发生的电极反应为 。 (2)装置A中总反应的离子方程式为 。 (3)若装置E的目的是在铜上镀银,则X为 ,极板N的材料为 。 (4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为 (标准状况)。 答案 1.D 2.C 3.A 4.A 5.D 6.D 7.A 8.B 9.B 10.A 11.D 12.D 13.B 14.C 15.C 16.A 17.C查看更多