专题06 化学反应速率和化学平衡-备战2021年高考化学之纠错笔记系列(原卷版)
专题 06 化学反应速率和化学平衡
易错点 1 混淆化学反应速率的表示方法
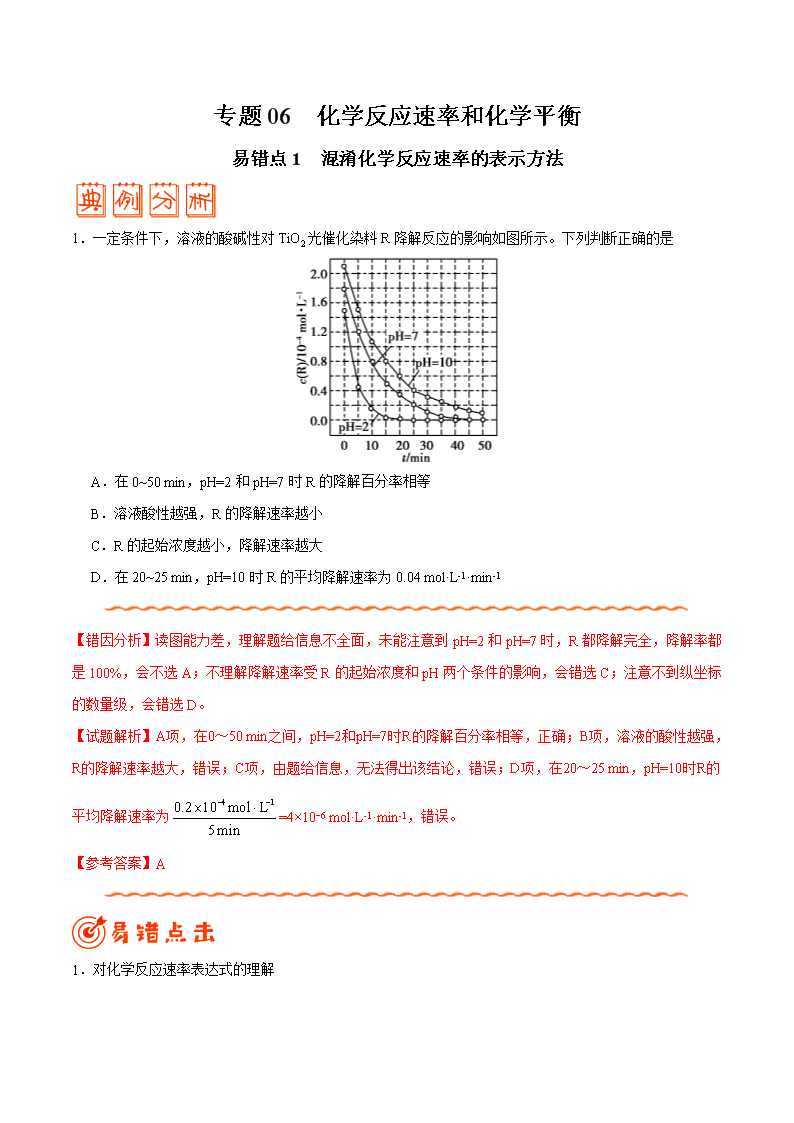
1.一定条件下,溶液的酸碱性对 TiO2 光催化染料 R 降解反应的影响如图所示。下列判断正确的是
A.在 0~50 min,pH=2 和 pH=7 时 R 的降解百分率相等
B.溶液酸性越强,R 的降解速率越小
C.R 的起始浓度越小,降解速率越大
D.在 20~25 min,pH=10 时 R 的平均降解速率为 0.04 mol·L-1·min-1
【错因分析】读图能力差,理解题给信息不全面,未能注意到 pH=2 和 pH=7 时,R 都降解完全,降解率都
是 100%,会不选 A;不理解降解速率受 R 的起始浓度和 pH 两个条件的影响,会错选 C;注意不到纵坐标
的数量级,会错选 D。
【试题解析】A项,在0~50 min之间,pH=2和pH=7时R的降解百分率相等,正确;B项,溶液的酸性越强,
R的降解速率越大,错误;C项,由题给信息,无法得出该结论,错误;D项,在20~25 min,pH=10时R的
平均降解速率为
4 10.2 10 mo
i
l
n
L
5m
=4×10−6 mol·L-1·min-1,错误。
【参考答案】A
1.对化学反应速率表达式的理解
2.化学反应速率的计算方法
(1)利用基本公式:v= c
t
=
·
n
V t
。
(2)利用速率之比=化学计量数之比=各物质浓度的变化量(Δc)之比=各物质物质的量的变化量(Δn)之比。
(3)“三段式”法计算模板
例如:反应 mA+nB pC
起始浓度/(mol/L) a b c
转化浓度/(mol/L) x nx
m
px
m
t 时刻浓度/(mol/L) a−x b− nx
m
c+ px
m
)
计算中注意以下量的关系:[来源:学科网]
①对反应物:c(起始)−c(转化)=c(某时刻);
②对生成物:c(起始)+c(转化)=c(某时刻)。
注意:理解化学反应速率概念应注意的“三点”
(1)平均速率和瞬时速率:中学化学中,通常所说的化学反应速率一般是指平均速率,即某段时间内的平
均反应速率,而不是某时刻的瞬时速率。
(2)化学反应速率越快不等于化学反应现象越明显,如某些中和反应。
(3)同一反应中,同一时间段内用不同物质的物质的量浓度变化表示的反应速率,数值可能不同,但意义
相同,其数值之比等于化学方程式中对应物质的化学计量数之比。
1.一定温度下,向容积为 2 L 的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如
图所示,对该反应的推断合理的是
A.该反应的化学方程式为 3B+4D 6A+2C
B.反应进行到 1 s 时,v(A)=v(D)
C.反应进行到 6 s 时,B 的平均反应速率为 0.05 mol·L-1·s-1
D.反应进行到 6 s 时,各物质的平均反应速率相等
易错点 2 不理解外界条件对反应速率的影响实质
2.下列说法错误的是
A.已知在 T ℃时,反应 2A(g)+B(g) 3C(g) ΔH>0 的正反应速率表示为 v,若降低温度,逆
反应速率减小
B.在恒容容器中发生反应 N2(g)+3H2(g) 2NH3(g),若往容器中充入 He,正逆反应的速率均不变
C.当一定量的锌粉和 4 mol·L-1 的过量盐酸反应时,为了减慢反应速率,又不影响产生 H2 的总量,可向
容器中加入一些水或硝酸钠溶液
D.对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
【错因分析】如果不明白外界因素对化学反应速率的影响,不能抓住影响反应速率的实质(是浓度变化引
起的,还是加入催化剂引起的),将会错解。如:本题选项 B,若分不清恒压条件和恒容条件下向容器中充
入不反应的气体,导致反应物和生成物浓度的变化情况,则会陷入解题误区。
【试题解析】选项A,温度降低,正、逆反应速率均减小,A正确;在恒容容器中充入不反应的气体,反应
物和生成物的浓度均不发生变化,正、逆反应速率均不变,B正确;选项C,若能使溶液中氢离子的浓度减
小,反应速率将减小,因此可以加入一些水,但是不能加入硝酸钠溶液,因为在酸性条件下,硝酸根离子
将与锌粉发生氧化还原反应,生成氮的氧化物,从而使生成氢气的量减少,C项错。
【参考答案】C
外界条件对化学反应速率的影响
中学化学反应速率的实质是某段时间内的平均反应速率,在外界条件不变时,对于可逆反应,化学反
应速率一般是由小变大,再变小,最终达到平衡状态。外界条件对化学反应速率及化学平衡的影响:
(1)增大反应物浓度,瞬时,正反应速率增大,逆反应速率不变,正反应速率大于逆反应速率,平衡
向正反应方向移动,达到新平衡;减小生成物浓度,瞬时,逆反应速率减小,正反应速率不变,正反应速
率大于逆反应速率,平衡向正反应方向移动,达到新平衡。
(2)增大压强,正、逆反应速率都增大,气体分子数多的一边的速率增大的程度较大;减压时,气体
分子数多的一边的速率减小的程度较大。
(3)升温,吸热和放热反应的速率都增大,吸热反应速率增大的程度较大;降温,吸热反应速率减小
的程度较大。
(4)使用催化剂时,同倍数、同时增大正、逆反应速率,正、逆反应速率始终相等。
2.向某密闭容器中加入 0.15 mol·L-1 A、0.05 mol·L-1 C 和一定量的 B 三种气体。一定条件下发生反应,各
物质浓度随时间变化如图中甲图所示[t0~t1 时 c(B)未画出,t1 时 c(B)增大到 0.05 mol·L-1]。乙图为 t2 时刻
后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若 t4 时改变的条件为减小压强,则 B 的起始物质的量浓度为___mol·L-1。
(2)若 t5 时改变的条件是升温,此时 v(正)>v(逆),若 A 的物质的量减少 0.03 mol 时,容器与外界的热
交换总量为 a kJ,写出反应的热化学方程式:___________________________________。
(3)t3 时改变的某一反应条件可能是________(填字母)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v(正)________v(逆)(填“>”“=”或“<”)。
易错点 3 对化学平衡状态的理解不透彻
3.在一个不传热的固定容积的密闭容器中,可逆反应 mA(g)+nB(g) pC(g)+qD(g),当 m、n、p、q 为任
意整数时,下列说法一定能说明反应已达到平衡的是
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
【错因分析】反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、百分含量不变,由此衍生出来
的各种量不变。需要注意的是,选择判断的物理量,随着反应的进行发生变化,当该物理量由变量变为定
值时,说明可逆反应达到平衡状态。若不清楚有可能存在 m+n=p+q,体系压强始终不变,则易错选①,若
不清楚反应速率之比始终存在 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q,与是否达到平衡状态无关,易错选⑤。
【试题解析】本题考查了化学平衡状态的判断,注意把握化学平衡状态判断的角度,特别是正逆反应速率
的关系,为易错点。①如果该反应是一个反应前后气体体积不变的可逆反应,则体系的压强始终不变,所
以不能根据压强判断反应是否达到平衡状态,故错误;②体系的温度不再改变,正逆反应速率相等,所以
能据此判断该反应达到平衡状态,故正确;③各组分的物质的量浓度不再改变,该反应达到平衡状态,故
正确;④当该反应达到平衡状态,各组分的质量分数不再改变,故正确;⑤当反应速率vA∶vB∶vC∶vD=m∶
n∶p∶q,不能据此判断该反应是否达到平衡状态,故错误;⑥单位时间内m mol A断键反应等效于p mol C
形成,同时p mol C也断键反应,故正确;故选B。
【参考答案】B
化学平衡状态的判断
达到化学平衡状态的标志:v 正=v 逆,平衡混合物中各组成成分的含量保持不变。“v 正=v 逆”是化学平衡的
本质特征,即反应体系中同一物质的消耗速率和生成速率相等。各组分的含量不变,是指各组分的浓度、
质量分数、体积分数(有气体参加的可逆反应)、反应物的转化率等均保持不变。
判断某一可逆反应是否达到平衡状态的“等价标志”:[来源:学#科#网]
(1)对于反应前后气体体积不等的反应,当恒温、恒容时,压强不变、气体的平均相对分子质量不变,
或恒温、恒压时,体积不变、混合气体的密度不变,说明反应处于平衡状态。
(2)对于有颜色的物质参加的反应,体系颜色不变,说明反应处于平衡状态。
(3)对于吸热或放热反应,绝热体系的温度不变,说明反应处于平衡状态。
注意化学反应速率与化学平衡的区别和联系:
化学反应速率 v 是表示在一定条件下,某一化学反应进行的快慢程度的物理量,它不仅涉及化学 反应
的实际进行步骤,同时也与物质的微观状况有密切的联系。而化学平衡是指可逆反应进行的方向和限度的
问题,只考虑物质的宏观状况就可以解决问题,与反应的实际步骤无关,只与反应的初始状态和最终状态
有关。两者虽属于不同的范畴,但它们之间有联系:对于一个可逆反应,当 v 正=v 逆时,即达到化学平衡;
而当 v 正≠v 逆时,就表示该可逆反应未达到平衡或原平衡被破坏。
3.可逆反应:2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成 n mol O2 的同时生成 2n mol NO2
②单位时间内生成 n mol O2 的同时生成 2n mol NO
③用 NO2、NO、O2 表示的反应速率的比为 2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
易错点 4 混淆平衡移动和转化率的关系
4.在一定条件下,体积不变的密闭容器中,发生可逆反应 2SO2(g)+O2(g) 2SO3(g) ΔH<0,达到平衡
后,当单独改变下列条件后,有关叙述正确的是
A.使用催化剂,此反应的ΔH 仍保持不变
B.增大 O2 浓度,SO2 的平衡转化率减小
C.降低温度,化学平衡常数减小
D.升高温度,SO2 的转化率一定增大
【错因分析】改变温度时,反应物的转化率可根据平衡移动方向来判断,若正反应是吸热反应,升高温度,
平衡正向移动,则转化率是增大的,若正反应是放热反应,升高温度,平衡逆向移动,则转化率是减小的,
本题中若不能根据反应的热效应判断温度升高时,化学平衡的移动方向,则易误选 D 项。
【试题解析】A项,使用催化剂不能改变反应的ΔH,A项正确;B项,增大O2浓度,平衡正向移动,SO2的
平衡转化率增大,B错误;C项,降低温度,平衡正向移动,化学平衡常数增大,C错误;升高温度,平衡
逆向移动,SO2的转化率一定减小,D错误。
【参考答案】A
若把化学平衡向正反应方向移动与原料转化率的提高等同起来,则会造成错误。化学平衡向正反应方向移
动时,反应物的转化率可能增大,也可能不变或减小。具体有以下两种情况:
(1)当可逆反应达平衡后,不增大反应物的浓度,而是通过改变温度、压强或减小生成物的浓度使平衡正
向移动,这时反应物的转化率一定增大。
(2)若不改变其他条件,只增大反应物的浓度,使平衡正向移动,则反应物的转化率不一定增大,必须根
据具体反应具体分析,如对于反应物是两种或两种以上的气体反应,当增大某一种气体反应物的浓度,平
衡正向移动,可使其他反应物的转化率增大,而自身的转化率是减小的。
4.反应 X(g)+Y(g) 2Z(g) ΔH<0,达到平衡时,下列说法不正确的是
A.减小容器体积,平衡不移动,X 的转化率不变
B.增大 c(X),X 的转化率减小
C.保持容器体积不变,同时充入 0.1 mol X 和 0.2 mol Y,X 的转化率增大
D.加入催化剂,正反应速率增大,Z 的产率增大
易错点 5 不会正确运用图像解化学平衡问题
5.[2016 四川]一定条件下,CH4 与 H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始 2
4
(H O)
)(CH
n
n =Z,
在恒压下,平衡时 CH4 的体积分数 (CH4)与 Z 和 T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变ΔH>0
B.图中 Z 的大小为 a>3>b
C.图中 X 点对应的平衡混合物中 2
4
(H O)
)(CH
n
n
=3
D.温度不变时,图中 X 点对应的平衡在加压后 (CH4)减小
【错因分析】注意图中三条线分别是指不同的 2
4
(H O)[ ](CH )
nZ n
时 CH4 的体积分数与温度的关系,本图除了表示
温度对平衡的影响外,还表示浓度对平衡的影响,解答本题需要先确定一个变量,讨论另一个变量与 CH4
的体积分数的关系,否则将无从下手。
【试题解析】A、从图分析,随着温度升高甲烷的体积分数逐渐 减小,说明升温平衡正向移动,则正反应为
吸热反应,故正确;B、 2
4
(H O)
)(CH
n
n
的比值越大,则甲烷的体积分数越小,故a<3
0
回答下列问题:
(1)反应①的化学平衡常数 K 表达式为________;图 1 中能正确反映平衡常数 K 随温度变化关系的曲线为
________(填曲线标记字母),其判断理由是________________________________。
图 1
(2)合成气组成 n(H2)/n(CO+CO2)=2.60 时,体系中的 CO 平衡转化率(α)与温度和压强的关系如图 2 所示。
α(CO)值随温度升高而________(填“增大”或“减小”),其原因是___________;图 2 中的压强由大到小为
________,其判断理由是______________。
图 2
易错点 6 解化学平衡计算类试题方法错误
6.在 373 K 时,把 0.5 mol N2O4 通入体积为 5 L 的真空密闭容器中,立即出现红棕色气体。反应进行到 2 s
时,NO2 的浓度为 0.02 mol·L-1。在 60 s 时,体系达到平衡状态,此时容器内的压强为开始时的 1.6 倍。
下列说法正确的是
A.前 2 s 以 N2O4 的浓度变化表示的平均反应速率为 0.01 mol·L-1·s-1
B.在 2 s 时体系内的压强为开始时的 1.1 倍
C.平衡时体系内含 N2O4 0.25 mol
D.平衡时,N2O4 的转化率为 40%
【错因分析】在运用三段式解答本题时一定要注意各量的单位要一致,若理不清平衡时与起始时量的关系,
不会运用题设条件“此时容器内的压强为开始时的 1.6 倍”,导致无法准确计算。
【试题解析】N2O4 和 NO2 之间存在如下转化关系:
N2O4(g) 2NO2(g)
前 2 s 时
N2O4 (g) 2 NO2 (g)
起始(mol) 0.5 0
转化(mol) 0.05 0.02×5
2 s 时(mol) 0.5−0.05 0.02×5
v(N2O4)= 0.05 mol
2 s 5 L =0.005 mol·L-1·s-1,气体的总物质的量为 0.5 mol−0.05 mol+0.02 mol·L-1×5 L=0.55 mol。
2 s 时体系内的压强与开始时的压强之比为 p2 s∶p 始=0.55∶0.5=1.1∶1。
60 s 达到平衡时,设有 x mol N2O4 反应。则有
N2O4 (g) 2NO2(g)
起始(mol) 0.5 0
转化(mol) x 2x
平衡(mol) 0.5−x 2x
平衡时,气体总的物质的量为 0.5 mol-x mol+2x mol=(0.5+x)mol,所以有 0.5 mol
0.5 mol
x
=1.6,解得 x=0.3。
平衡体系中含 0.2 mol N2O4,N2O4 的转化率为 0.3 mol
0.5 mol ×100%=60%。
【参考答案】B
“三段式法”解答化学平衡计算题
(1)步骤
①写出有关化学平衡的化学方程式。
②确定各物质的起始、转化、平衡时的量(物质的量或物质的量浓度)。
③根据已知条件建立等式关系并做解答。
(2)方法:如 mA(g)+nB(g) pC(g)+qD(g),令 A、B 起始物质的量浓度分别为 a mol·L−1、b mol·L−1,
达到平衡后消耗 A 的物质的量浓度为 mx mol·L−1。
mA(g)+nB(g) pC(g)+qD(g)
起始物质的量
浓度(mol·L−1) a b 0 0
变化物质的量
浓度(mol·L−1) mx nx px qx
平衡物质的量
浓度(mol·L−1) a−mx b−nx px qx
K= ( ) ( )
( ) ( )
p q
m n
px qx
a mx b nx
说明:
①反应物:c(平)=c(始)−c(变);生成物:c(平)=c(始)+c(变)。
②各物质的转化浓度之比等于化学方程式中化学计量数之比。
③转化率= 反应物转化的浓度
反应物起始的浓度
×100%。
6.某恒定温度下,在一个 2 L 的密闭容器中充入 A 气体,B 气体,测得其浓度为 2 mol/L 和 1 mol/L;且发
生如下反应:
3A(g)+2B(g) 4C(?)+2D(?)
已知“?”代表 C、D 状态未确定;反应一段时间后达到平衡,测得生成 1.6 mol C,且反应前后压强比为 5∶
4,则下列说法中正确的是
①该反应的化学平衡常数表达式为:K=
4 2
3 2
(C) (D)
(A) (B)
c c
c c
②此时 B 的转化率为 35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加 C 的量,A、B 转化率不变
A.①② B.②③ C.①④ D.③④
易错点 7 不会灵活运用化学平衡常数
7.利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收 CO,能达到保护环境和能源再利用的目的,反应方程式为
Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
温度/℃ 15 50 100
化学平衡常数 5×104 2 1.9×10‒5
下列说法正确的是
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)3]Ac·CO Cu(NH3)2Ac+CO+NH3 的平衡常数为 0.5
C.保持其他条件不变,减小压强,CO 的转化率减小
D.醋酸二氨合铜溶液的浓度大小对 CO 的吸收没有影响
【错因分析】若不能利用化学平衡常数与温度的关系分析反应的热效应,易错选 A;若不明白逆反应的化
学平衡常数与正反应的化学平衡常数互为倒数,易错选 B。
【试题解析】A 项,据表可知温度升高,化学平衡常数减小,说明正反应是放热反应,错误;B 项,15 ℃
时,Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO 的化学平衡常数为 5×104,则其逆反应的化学平衡常数
为 2×10‒5,错误;C 项,该反应的正反应是气体体积缩小的反应,减小压强,平衡逆向移动,CO 的转化率
减小,正确;D 项,增大醋酸二氨合铜溶液的浓度,平衡正向移动,有利于 CO 的吸收,错误。
【参考答案】C
有关化学平衡常数类试题解题技巧
1.考生要能正确书写出化学平衡常数。以可逆反应 mA(g)+nB(g) pC(g)+qD(g)为例,K=
C Dp q
m n
c c
c A c B
。
要注意三点:
(1)各物质的浓度必须是平衡浓度,固体、纯液体或水溶液中水的浓度不列入平衡常数的表达式。
(2)反应方向的改变或化学计量系数的增大或减小,平衡常数均发生改变。
(3)K 不随反应物或生成物浓度的改变而改变,仅随温度的改变而改变,可通过温度变化后,K 值的变化
情况,判断出反应放热或吸热,如反应 N2(g)+3H2(g) 2NH3(g),温度升高,平衡常数 K 减小,说明
平衡向逆反应方向移动,表明正反应放热。
2.考生要能正确应用化学平衡常数。
(1)推断反应进行的程度:一定温度下,K 越大,反应进行的程度越大,反应物的转化率越大;反之,K
越小,表示反应进行的程度和反应物的转化率越小。
(2)判断反应是否达到化学平衡状态:一定温度下,若 Qc=K,说明化学反应达到平衡状态;若 Qc<K,说
明反应向正反应方向进行;反之,则说明反应向逆反应方向进行。
7.在一定温度下,向 2 L 体积固定的密封容器中加入 1 mol HI,发生反应:2HI(g) H2(g)+I2(g) ΔH>0,
测得 H2 的物质的量随时间变化如表,下列说法正确的是
t/min 1 2 3
n(H2)/mol 0.06 0.1 0.1
A.2 min 内的 HI 的分解速度为 0.05 mol·L−1·min−1
B.该温度下,反应的平衡常数 K= 1
16
,平衡时 HI 的转化率为 20%
C.该温度下的平衡常数为 K1,温度升高 10℃后平衡常数为 K2,则 K1>K2
D.达平衡后其他条件不变,压缩容器体积,平衡不移动,c(HI)不变
易错点 8 不能区分“等效平衡”和“等同平衡”
8.在体积恒定的密闭容器Ⅰ中,充入 3 mol A 和 1 mol B 发生反应 3A(g)+B(g) xC(g),维持温度不变,
向与容器Ⅰ体积相同的密闭容器Ⅱ中充入 1.2 mol A、0.4 mol B、0.6 mol C,达到平衡后两容器中压强、
C 的体积分数均相同,则 x 值是
A.1 B.2 C.3 D.4
【错因分析】若不能区分“等效平衡”和“等同平衡”易误选 D,解题时宜抓住 3 个变量,即体积分数、
物质的量、浓度,若是“等同平衡”三者皆相同,若是“等效平衡”,则体积分数一定相同,物质的量、浓
度可能会同比例发生变化。
【试题解析】相同温度下,达到平衡时,容积相同的密闭容器Ⅰ和Ⅱ中的压强相同,说明两容器中气体的
物质的量相同,又由于两容器中C的体积分数相同,故两容器中C的物质的量相同。两容器中A、B的物质的
量之比均等于化学方程式中的化学计量数之比,故平衡时两容器中A、B的物质的量分别相等,即两容器中
的平衡完全等效,用“一边倒法”将容器Ⅱ中的起始物质均转化为反应物可知:1.2 mol+3×0.6 mol/x=3 mol、
0.4 mol+0.6 mol/x=1 mol,解得x=1。
【参考答案】A
等效平衡与等同平衡的异同
条件 等效条件 结果
恒温恒容:反应前后气体体积不相
等 的 可 逆 反 应 , aA(g) + bB(g)
cC(g)[Δn(g)≠0]
投料换算成相同物质表示的物质
的量相同→回归定值
两次平衡时各组分百分含量、n、c
均相同→完全相同→等同平衡
恒温恒容:反应前后气体体积相等
的 可 逆 反 应 , aA(g) +
bB(g) cC(g)[Δn(g)=0]
投料换算成相同物质表示的物质
的量等比例→回归定比
两次平衡时各组分百分含量相同,
n、c 同比例变化→等效平衡
恒温恒压:所有有气体参加的可逆
反应
投料换算成相同物质表示的物质
的量等比例→回归定比
两次平衡时各组分百分含量相同、
c 相同,n 同比例变化→等效平衡
8.在温度、容积相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有
关数据如下[已知 X(g)+3Y(g) 2Z(g) ΔH=−Q kJ·mol−1]:
容器 甲 乙 丙
反应物投入量 1 mol X、3 mol Y 2 mol Z 4 mol Z
Z 的浓度(mol·L− 1) c1 c2 c3
反应的能量变化 放出 a kJ 吸收 b kJ 吸收 c kJ
体系压强(Pa) p1 p2 p3
反应物转化率 α1 α2 α3
下列说法正确的是
A.2c1>c3 B.a+b=Q C.2p2v 逆
向正反应方向移
动
减小反应物的浓度 减小 不变 v 正<v 逆
向逆反应方向移
动
增大生成物的浓度 不变 增大 v 正<v 逆
向逆反应方向移
动
减小生成物的浓度 不变 减小
v 正>v 逆 向正反应方向移
动
压强(通过
改 变 体 积
使 压 强 变
m+n>p+q
增 大 压
强
增大 增大 v 正>v 逆
向正反应方向移
动
减 小 压 减小 减小 v 正<v 逆 向逆反应方向移
化) 强 动
m+nv 逆
向正反应方向移
动
m+n=p+q
增 大 压
强
增大 增大 v 正=v 逆 平衡不移动
减 小
压强
减小 减小 v 正=v 逆 平衡不移动
容积不变充入 He 不变 不变 v 正=v 逆 平衡不移动
压 强 不 变
充入 He
m+n>p+q 减小 减小 v 正<v 逆
向逆反应方向移
动
m+n=p+q 减小 减小 v 正=v 逆 平衡不移动
m+n<p+q 减小 减小 v 正>v 逆
向正反应方向移
动
温度
ΔH<0
升 高 温
度
增大 增大 v 正<v 逆
向逆反应方向移
动
降 低 温
度
减小 减小 v 正>v 逆
向正反应方向移
动
ΔH>0
升 高 温
度
增大 增大 v 正>v 逆
向正反应方向移
动
降 低
温度
减小 减小 v 正<v 逆
向逆反应方向移
动
催化剂
使用正催化剂 增大 增大 v 正=v 逆 平衡不移动
使用负催化剂 减小 减小 v 正=v 逆 平衡不移动
浓度、压强和温度对平衡移动影响的几种特殊情况:
(1)改变固体或纯液体的量,对平衡无影响。
(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
(3)对于反应前后气体体积无 变化的反应,如 H2(g)+I2(g) 2HI(g),压强的改变对平衡无影响。但
增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。
(4)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度相当于
增大(减小)压强。
(5)在恒容容器中,当改变其中一种气态物质的浓度时,必然会引起压强的改变,在判断平衡移动的方向和
物质的转化率、体积分数变化时,应灵活分析浓度和压强对化学平衡的影响。
3.化学平衡图像的理解
(1)速率−时间图像
根据 v−t 图像,可以很快地判断出反应进行的方向,根据 v 正、v 逆的变化情况,可以推断出外界条件的改变
情况。
以合成氨反应为例:N2(g)+3H2(g) 2NH3(g) ΔH<0。
条件 c(N2)增大 c(H2)减小 c(NH3)增大
v-t 图像
平衡移动方向 正反应方向移动 逆反应方向移动 逆反应方向移动
条件 C(NH3)减小 增大压强 减小压强
v-t 图像
平衡移动方向 正反应方向移动 正反应方向移动 逆反应方向移动
条件 升高温度 降低温度 使用催化剂
v-t 图像
平衡移动方向 逆反应方向移动 正反应方向移动 不移动
(2)其他常见的化学平衡图像
①浓度−时间图
此类图像能说明平衡体系中各组分在反应过程中的浓度变化情况。如 A+B AB 的反应情况如图。
②总反应速率−时间图像
Zn 与足量盐酸的反应,反应速率随时间变化的曲线如图所示。ab 段(v 渐增),因该反应为放热反应,
随反应的进行,温度增高,导致反应速率增大;bc 段(v 渐小),主要原因是随反应的进行,溶液中 c(H+)渐
小,导致反应速率减小。故分析时要抓住各阶段的反应特点,认真分析。
③含量−时间−温度图像
④含量−时间−压强图像
⑤含量−时间−有无催化剂
4.化学平衡图像题解题技巧
(1)“定一议二”原则
在化学平衡图像中,了解纵轴、横轴和曲线所表示的三个量的意义。在确定横轴所表示的量后,讨论
纵轴与曲线的关系,或在确定纵轴所表示的量后,讨论横轴与曲线的关系。
比如:反应 2A(g)+B(g) 2C(g)达到化学平衡时,A 的平衡转化率与压强和温度的关系如图 1 所示[A
的平衡转化率(α),横轴为反应温度(T)]。
图 1
定压看温度变化,升高温度曲线走势降低,说明 A 的转化率降低,平衡向逆反应方向移动,正反应是放
热反应。
定温看压强变化,因为此反应是反应后气体体积减小的反应,压强增大,平衡向正反应方向移动,A 的
转化率增大,故 p2>p1。
(2)“先拐先平数值大”原则
对于同一化学反应在化学平衡图像中,先出现拐点的反应先达到平衡状态,先出现拐点的曲线表示的温
度较高(如图 2 所示,α表示反应物的转化率)或压强较大[如图 3 所示,φ(A)表示反应物 A 的体积分
数]。
图 2 图 3
图 2:T2>T1,正反应放热。
图 3:p1 K3,p2> 2p3
C.v1< v3,α1(SO2 ) >α3(SO2 ) D.c2> 2c3,α2(SO3 )+α3(SO 2 )<1
3.[2017 江苏]H2O2 分解速率受多种因素影响。实验测得 70℃时不同条件下 H2O2 浓度随时间的变化如图所
示。下列说法正确的是
A.图甲表明,其他条件相同时,H2O2 浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液 pH 越小,H2O2 分解速率越快
C.图丙表明,少量 Mn 2+存在时, 溶液碱性越强,H2O2 分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对 H2O2 分解速率的影响大
4.[2017 天津]常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230℃时,该反应的平衡常
数 K=2×10−5。已知:Ni(CO)4 的沸点为 42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。
下列判断正确的是
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃
C.第二阶段,Ni(CO)4 分解率较低
D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO)
5.[2017 江苏]温度为 T1 时,在三个容积均为 1 L 的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2
(g) (正反应吸热)。实验测得:v 正= v(NO2)消耗=k 正 c2(NO2),v 逆=v(NO)消耗=2v(O2)消耗=k 逆 c2(NO)·c(O2),k 正、
k 逆为速率常数,受温度影响。下列说法正确的是
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B.达平衡时,容器Ⅱ中
2
2
O
NO
c
c
比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中 NO 的体积分数小于 50%
D.当温度改变为 T2 时,若 k 正=k 逆,则 T2> T1
6.某探究小组利用丙酮的溴代反应(CH3COCH3+Br2――→HCl CH3COCH2Br+HBr)来研究反应物浓度与反应速
率的关系。反应速率 v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下表实验
数据:
实验序号
初始浓度(c)/mol·L-1 溴颜色消失
所需时间(t)/sCH3COCH3 HCl Br2
① 0.80 0.20 0.001 0 290
② 1.60 0.20 0.001 0 145
③ 0.80 0.40 0.001 0 145
④ 0.80 0.20 0.002 0 580
分析表中实验数据得出的结论不正确的是
A.增大 c(CH3COCH3),v(Br2)增大
B.实验②和③的 v(Br2)相等
C.增大 c(HCl),v(Br2)增大
D.增大 c(Br2),v(Br2)增大
7.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫的危害。在恒容密闭容器中,CO 和 H2S 混合加热
生成羰基硫的反应为 CO(g)+H2S(g)===COS(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡
状态的是
A.正、逆反应速率都等于零
B.CO、H2S、COS、H2 的浓度相等
C.CO、H2S、COS、H2 在容器中共存
D.CO、H2S、COS、H2 的浓度均不再变化
8.在一定条件下,将 3 mol A 和 1 mol B 两种气体混合于固定容积为 2 L 的密闭容器中,发生如下反应:3A(g)
+B(g) xC(g)+2D(g)。2 min 末该反应达到平衡,生成 0.8 mol D,并测得 C 的浓度为 0.2 mol·L-1,
下列判断正确的是
A.平衡常数约为 0.3
B.B 的转化率为 60%
C.从反应开始至平衡,A 的平均反应速率为 0.3 mol·L-1·min-1
D.若混合气体的密度不变,则表明该反应达到平衡状态
9.如图表示恒容密闭器中,反应 X(g) 4Y(g)+Z(g) ΔH<0 在某温度时 X 的浓度随时间的变化曲线:
下列有关该反应的描述正确的是
A.8 min 时,反应停止
B.X 的平衡转化率为 85%
C.若升高温度,X 的平衡转化率将大于 85%
D.若降低温度,v 正和 v 逆将以同样程度减少
10.[2018 新课标 1 卷]采用 N2O5 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广
泛应用。回答下列问题
(1)1840 年 Devil 用干燥的氯气通过干燥的硝酸银,得到 N2O5。该反应的氧化产物是一种气体,其
分子式为___________。
(2)F.Daniels 等曾利用测压法在刚性反应器中研究了 25℃时 N2O5(g)分解反应:
其中 NO2 二聚为 N2O4 的反应可以迅速达到平衡。体系的总压强 p 随时间 t 的变化如下表所示(t=∞时,
N2O5(g)完全分解):
t/min 0 40 80 160 260 1300 1700 ∞
p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=−4.4 k J·mol−1
2NO2(g)=N2O4(g) ΔH 2=−55.3 kJ·mol−1
则反应 N2O5(g)=2NO2(g)+ 1
2
O2(g)的ΔH=_______ kJ·mol−1。
②研究表明,N2O5(g)分解的反应速率 2 5
3 12 10 ·minN Op kPa 。t=62 min 时,测得体系中
2Op pO2=2.9 kPa,则此时的
2 5N Op =________kPa,v=_______kPa·min−1。
③若提高反应温度至 35℃,则 N2O5(g)完全分解后体系压强 p∞(35℃)____63.1 kPa(填“大于”“等
于”或“小于”),原因是________。
④25℃时 N2O4(g) 2NO2(g)反应的平衡常数 Kp=_______kPa(Kp 为以分压表示的平衡常数,计算
结果保留 1 位小数)。
(3)对于反应 2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg 提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有 NO3
C.第二步中 NO2 与 NO3 的碰撞仅部分有效
D.第三步反应活化能较高
11.工业上可用乙苯催化脱氢方法制备苯乙烯:
(g) (g)+H2(g) ΔH1=+Q kJ·mol−1
(1)已知乙苯、苯乙烯的燃烧热分别为 a kJ·mol−1、b kJ·mol−1,则表示氢气燃烧热的
ΔH=________kJ·mol−1(用含有 Q、a、b 的表达式表示,其中 Q、a、b 均大于 0)。
(2)400 ℃时,在恒容密闭容器中,充入 5 mol 乙苯发生上述反应,反应达到平衡后容器内气体的压
强为 p1;若再充入 n mol 的乙苯,重新达到平衡后容器内气体的压强为 2p1,则 n_______5(填“>”“<”
或“=”)。
(3)在实际生产中,恒压下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙
苯的平衡转化率与水蒸气的用量、压强(p)的关系。
①加入水蒸气稀释剂能提高乙苯转化率的原因是___________________________。
②在实际生产过程中,控制反应温度为 900 K 的理由是___________________________。
③在 2p Pa、900 K,且 ( )
( )
n
n
水
乙苯 =8 时,混合气体中苯乙烯的体积分数为_____________。
④改变下列条件,能使乙苯的反应速率和转化率一定都增大的是__________(填标号)。
A.恒容时加入稀释剂水蒸气
B.压强不变,温度升至 1500 K
C.在容积和温度不变的情况下充入 Ar
D.选用催化效果更好的催化剂
(4)苯乙烯可催化氧化生成苯乙醛:2C6H5—CH=CH2+O2→2C6H5—CH2CHO,把该反应设计为碱性燃
料电池,还可获得电能,该电池负极的电极反应式为_____________________,若该电池消耗标
准状况下 11.2 L O2,理论上转移电子物质的量为_______mol。
12.在适当的条件下,将 CO2 转化为甲醇、甲醚等有机物,既可降低 CO2 造成的温室效应对环境的影响,
还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g) 2H2O(g) ΔH1=−484 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=−50 kJ/mol
则2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH<0,
测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) c(H2) c(CH3OCH3) c(H2O)
开始时 a b 0 0
10 s时 3 0.5 c 1.5
①若反应开始到10 s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的
方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转
化率为________。
( 3 ) 一 定 条 件 下 , 向 某 恒 容 密 闭 容 器 中 充 入 x mol CO2 和 y mol H2 , 发 生 的 反 应 为
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。
①下图 1 中能表示该反应的平衡常数 K 与温度 T 之间的变化关系曲线为______(填“a”或“b”),
其判断依据是__________________________________。
②若 x=2、y=3,测得在相同时间内不同温度下 H2 的转化率如图 2 所示,则在该时间段内,恰好
达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________