陕西省宁陕中学2020届高三下学期全仿真考试化学试题
宁陕中学2020届高三全仿真考试 化学试卷
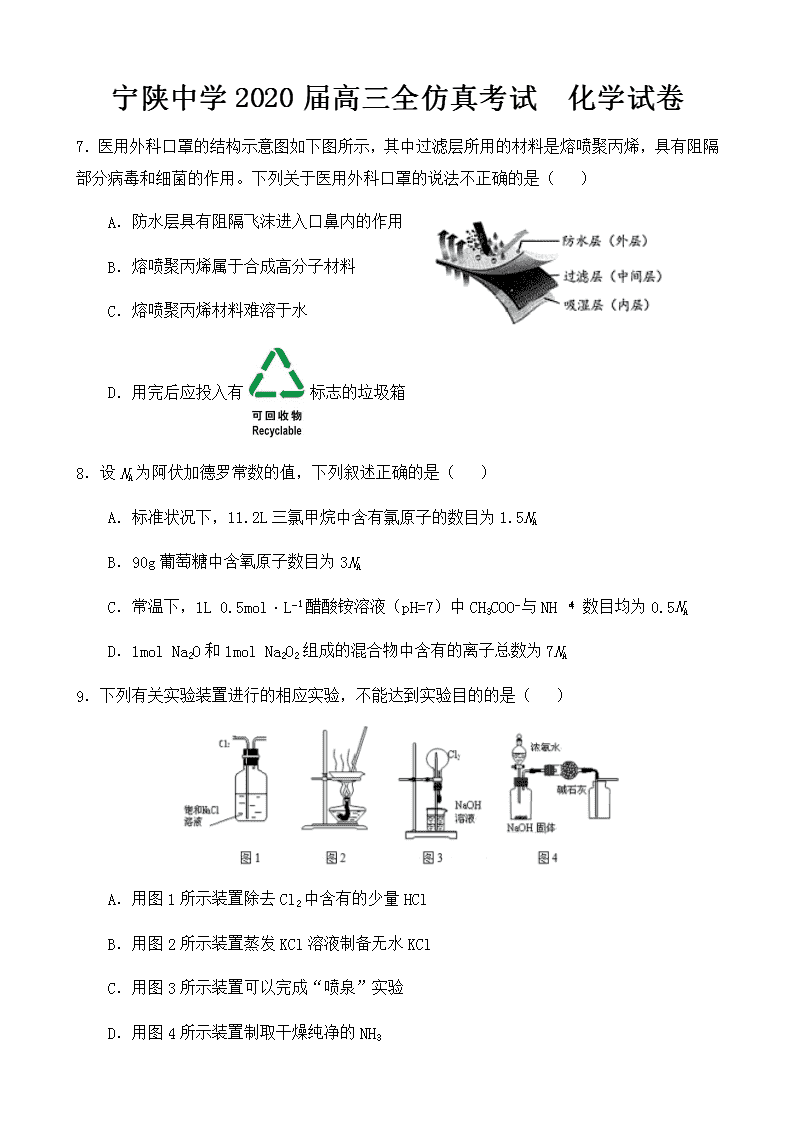
7.医用外科口罩的结构示意图如下图所示,其中过滤层所用的材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用。下列关于医用外科口罩的说法不正确的是( )
A.防水层具有阻隔飞沫进入口鼻内的作用
B.熔喷聚丙烯属于合成高分子材料
C.熔喷聚丙烯材料难溶于水
D.用完后应投入有标志的垃圾箱
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2L三氯甲烷中含有氯原子的数目为1.5NA
B.90g葡萄糖中含氧原子数目为3NA
C.常温下,1L 0.5mol·L−1醋酸铵溶液(pH=7)中CH3COO−与NH数目均为0.5NA
D.1mol Na2O和1mol Na2O2组成的混合物中含有的离子总数为7NA
9.下列有关实验装置进行的相应实验,不能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸发KCl溶液制备无水KCl
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取干燥纯净的NH3
10.我国中草药文化源远流长,通过临床试验,从某中草药中提取的有机物具有较好的治疗癌症的作用,该有机物的结构如图所示。下列说法中错误的是( )
A.分子式为C13H12O6
B.该有机物能发生取代反应、加成反应、氧化反应
C.1mol该有机物与NaOH反应最多消耗2mol NaOH
D.1mol该有机物与溴水反应最多消耗3mol Br2
11.前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是( )
A.A和B形成的化合物可作为耐火材料
B.A和C的氢化物的沸点:C>A
C.简单离子半径:E
Q
D.M点所示溶液中c(Na+)=c(R−)
26.苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。
回答下列问题:
(1)仪器X的名称是_________,冷却水应从_________(填“上口”或“下口”)通入。
(2)本实验中加入无水硫酸镁的目的是_________。从绿色化学角度考虑,萃取剂宜采用___(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法______(填“是”或“否”)正确,其理由是_______________。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是____________。
(5)本实验苯甲醇的产率为______%(计算结果保留一位小数)。
27.高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
已知:还原焙烧主反应为2MnO2+C2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热。
(2)步骤E中调节pH的范围为____________,其目的是______________________________。
(3)步骤G,温度控制在35℃以下的原因是____________________________________,若Mn2+恰好沉淀完全(当离子浓度≦10-5mol/L认为该离子沉淀完全)时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
(4)步骤D中氧化剂与还原剂的物质的量之比为__________;步骤C中的滤渣为__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中NO3-完全转化为NO2-);加入稍过量的硫酸铵,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
28.二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H
已知:CH3OCH3(g) CO(g)+H2(g)+CH4 (g) △H1
CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
H2(g)+1/2O2(g)=H2O (g) △H3
①则反应I的△H=____________________(用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当n(O2)/n(CH3OCH3)>0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。
A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C .n(O2)/n(CH3OCH3)>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
①t=400 s时,CH3OCH3的转化率为________(保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_________s-1;400 s时v(CH3OCH3)=_________kPa.s-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是________。
35.[化学——选修3:物质结构与性质](15分)
据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是______________________。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:__________________;用杂化轨道理论解释:____________________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为____________。
(5)锆晶胞如图1所示,1个晶胞含______个Zr原子;这种堆积方式称为_______________。
(6)镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
36.[化学——选修5:有机化学基础](15分)
两种重要的有机化工合成中间体F和Y可用甲苯为主要原料采用以下路线制得。
已知:
请回答下列问题:
(1)写出A的结构简式___________________。
(2)B→C的化学方程式是______________________________________。
(3)C→D的反应类型为___________________。
(4)1 mol F最多可以和_____________mol NaOH反应。
(5)在合成F的过程中,设计B→C步骤的目的是________________________________________。
(6)写出符合下列条件的一种A的同分异构体的结构简式____________________。
①苯环上只有两种不同化学环境的氢原子
②能发生银镜反应
(7) 以X和乙醇为原料通过3步可合成Y,请设计合成路线(无机试剂及溶剂任选)。
答案
题号
7
8
9
10
11
12
13
答案
D
B
D
C
B
D
B
26.【答案】(1)球形冷凝管 下口
(2) 干燥 B
(3) 否 电动搅拌器使不相溶的反应液混合均匀,加快反应速率
(4) 提高氯化苄在水中的溶解度,使反应物充分接触(或增大有效碰撞几率)
(5) 89.4
【解析】
(1)仪器X的名称是球形冷凝管,冷却水采用逆流的方式冷却效果较好,所以冷却水应从下口通入;由于苯甲醇的沸点较高,易液化,在蒸馏纯化操作中最适宜选用B仪器,有利于液体顺利流下;
(2)加入无水硫酸镁,利用其易水形成结晶水合物,达到干燥的目的;乙醇有刺激性,苯有毒,氯仿有麻醉作用,而乙酸乙酯有特殊香味,无毒,则从绿色化学角度考虑,萃取剂宜采用乙酸乙酯,故答案为B;
(3)不能用沸石代替电动搅拌器,因为使用电动搅拌器,除防暴沸,还可使不相溶的反应液混合均匀,加快反应速率;
(4)四乙基溴化铵易溶于水,而氯化苄不溶于水,易溶于四乙基溴化铵,则加入四乙基溴化铵,可提高氯化苄在水中的溶解度,使反应物充分接触,提高反应效率;
(5)10.0mL氯化苄的质量为11g,其物质的量为=mol,理论生成苯甲醇的质量为mol×108g/mol=9.39g,则苯甲醇的产率为=89.4%。
27.【答案】(1)坩埚 C、 Cu和CaSO4 (2) 1∶2
(3)3.7≤pH<8.1 使Fe3+转化为Fe(OH)3而除去,而不影响Mn2+
(4)减少碳酸氢铵的分解,提高原料利用率 2.2×10-11
(2) 取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
(3) 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 25%
【解析】
(1)高温焙烧物质应在坩埚中进行;根据分析可知滤渣为C、Cu和CaSO4;
(2)步骤D中MnO2被还原成Mn2+,化合价降低2价,Fe2+被氧化成Fe3+,化合价升高1价,根据得失电子守恒,氧化剂与还原剂的物质的量之比为1:2;
(3)此时溶液中的杂质主要为Fe3+,结合表中数据可知步骤E中调节pH的范围为3.7≤pH<8.3,其目的是使铁离子转化为氢氧化铁而除去,而不影响Mn2+;
(4)铵盐不稳定,受热易分解,所以步骤G中温度需控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;Mn2+恰好沉淀完全时可认为c(Mn2+)=10-5mol/L,Ksp(MnCO3)= c(Mn2+)·c(CO32-)=10-5×2.2×10-6=2.2×10-11;
(5)生成的MnCO3沉淀可能附着有硫酸盐,所以检验是否含有硫酸根即可确认沉淀是否洗涤干净,具体操作为:取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(6)①酸性K2Cr2O7具有强氧化性,可以把亚铁离子氧化成铁离子,自身被还原成Cr3+,根据电子守恒、电荷守恒和原子守恒可得离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②根据方程式6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可知剩余n(Fe2+)= 0.500 mol·L-1×0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的n(Fe2+)=0.500 mol·L-1×0.06L-0.015mol=0.015mol,根据方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可知n(Mn)=0.015mol,所以锰元素的质量分数为=25%。
28.【答案】△H1+△H2-2△H3 B 16% 4.4×10-4 1.65×10-2 4×104 增大反应物的压强 提高反应物的压强,化学反应速率加快
【解析】 (1) ①已知:i.CH3OCH3(g) CO(g)+H2(g)+CH4 (g) △H1
ii.CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
iiiH2(g)+1/2O2(g)=H2O (g) △H3
根据盖斯定律i+ii-iii×2得:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H=△H1+△H2-2△H3,
故答案为:△H1+△H2-2△H3;
②反应I:CH3OCH3(g)+1/2O2(g) 2CO(g)+3H2(g),由信息可知,过量的O2与H2发生副反应生成H2O,使H2的体积百分含量快速降低,A、C选项不能说明H2的体积百分含量快速降低,故选B;
故答案为:B;
(2)①设起始时CH3OCH3的物质的量为n,则
CH3OCH3(g)CO(g)+H2(g)+CH4(g),
起始量(mol) n 0 0 0
转化量(mol) nα n α n α nα
400 s时(mol)n- n α n α nα n α 总物质的量:n+2nα
根据等温等容条件下,压强之比等于物质的量之比,有=,解得α=0.16=16%;
由图象可知,当P(CH3OCH3)=10.0kPa时,v(CH3OCH3)=4.4×10-3kPa·s-1,
根据v(CH3OCH3)=kPn(CH3OCH3),n=1,则k=s-1=4.410-4 s-1;
由图象可知,400 s时P(CH3OCH3)=35.0kPa,则v(CH3OCH3)==1.65×10-2kPa.s-1。
故答案为:16%;4.410-4;1.6510-2;
②达到平衡时,测得体系的总压强P总= 121.6 kPa,设平衡转化率为α1,则
CH3OCH3(g)CO(g)+H2(g)+CH4(g),
起始量(mol) n 0 0 0
转化量(mol) nα1 nα1 nα1 nα1
平衡量(mol)n-nα1 nα1 nα1 nα1 总物质的量:n+2nα1
根据等温等容条件下,压强之比等于物质的量之比,有=,解得α1=0.96,
则平衡时CH3OCH3(g)、CO(g)、H2(g)、CH4(g)分压分别为1.67 kPa、39.98 kPa、39.98 kPa、39.98 kPa,则该反应的平衡常数Kp=4104kPa2
③除使用催化剂外,提高反应物的压强,能加快化学反应速率;
故答案为:4104;增大反应物的压强;提高反应物的压强,化学反应速率加快。
35.[化学——选修3:物质结构与性质](15分)
(1)A(2分)
(2)S原子半径小于Te,H—S键的键能较大(1分) H2S分子中S原子价层有2个孤电子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小(1分);CS2分子中C原子价层没有孤电子对,成键电子对之间排斥力相同且较小(1分)
H2S中S采用sp3杂化,CS2中C采用sp杂化(1分)
(3)正四面体(1分) 16(1分)
(4)AsBr3>AsCl3>AsF3(1分)
(5)6(1分) 六方最密堆积(1分)
(6)(2分) (2分)
【解析】(1)锌原子的第一电离能大于铜原子第一电离能,有①>③;铜的第二电离能大于锌的第二电离能,有④>②。锌的第二电离能大于第一电离能,②>①。故选A。
(2)从原子半径、键能角度分析气态氢化物的热稳定性。原子半径:r(S)<r(Te),键能:H-S>H-Te,所以H2S较稳定。H2S分子中S原子价层有2个孤电子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小;CS2分子中C原子价层没有孤电子对,成键电子对之间排斥力相同,呈直线形最稳定,键角较大。从杂化轨道角度解释,H2S中S采用sp3杂化,CS2中C采用sp杂化。
(3)[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,说明Cd2+采用sp3杂化,呈正四面体结构。配位键也是σ键。1 mol [Cd(NH3)4]2+含16 mol σ键。
(4)它们都是分子晶体,相对分子质量越大,范德华力越大,熔点越高。故熔点排序为AsBr3>AsCl3>AsF3。
(5)在六棱柱中,12个原子位于顶点、2个原子位于面心,3个原子位于体内。1个六棱柱含6个原子。这种堆积方式叫六方最密堆积。
(6)图2为体心立方堆积,3个镉原子位于体对角线且相切,1个晶胞含2个镉原子。设晶胞参数为a,d=,a= nm。设两镉原子最近核间距为x,(2x)2=3a2,
x= nm。设镉原子半径为r,则r= nm,φ==。
36.[化学——选修5:有机化学基础](15分)
(1)(2分)
(2)+(CH3CO)2O+CH3COOH(2分)
(3)氧化反应(2分)
(4)3(2分)
(5)氨基易被氧化,在氧化反应之前需先保护氨基(或其它合理答案也给分)(2分)
(6)、、(3分)
(7)(2分)
【解析】(1)从流程分析得出A为。
(2)乙酸酐与氨基反应形成肽键和乙酸。
(3)苯环上的甲基被氧化为羧基,为氧化反应。
(4)F分子中含有羧基、氨基和溴原子,其中羧基消耗1 mol氢氧化钠,溴原子水解得到酚羟基和HBr各消耗1 mol氢氧化钠,共消耗3 mol。
(5)在流程中先把氨基反应后又生成,显然是在保护氨基。
(6)由①得出苯环中取代基位置对称,由②得出含有醛基或甲酸酯基,还有1个氮原子和1个氧原子,故为、、。
(7)根据已知条件②需要把乙醇氧化为乙醛,然后与X反应再加热可得出产物。