高中化学人教版选修三章末综合测评1含解析
章末综合测评(一) 原子结构与性质
(时间45分钟,满分100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.下列有关物质结构的表述正确的是( )
A.次氯酸的电子式:H
B.二氧化硅的化学式:SiO2
C.硫原子的最外层电子排布式:2s22p4
D.钠离子的结构示意图:
【解析】 次氯酸的电子式应为,A错误;二氧化硅的化学式为SiO2,B正确;S是16号元素,其核外电子排布式为1s22s22p63s23p4,C错误;钠离子是钠原子失去了最外层的1个电子,其结构示意图为,D错误。
【答案】 B
2.下列说法错误的是( ) 【导学号:90990027】
A.ns电子的能量不一定高于(n-1)p电子的能量
B.6C的电子排布式1s22s22p违反了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
【解析】 A不正确,各能级能量的大小顺序为1s<2s<2p<3s<3p<4s<3d<4p<5s……ns电子的能量一定高于(n-1)p电子的能量;B违反了洪特规则;C原子2p能级有3个能量相同的原子轨道,最后2个电子应该以自旋方向相同的方式分布在2个不同的2p轨道上;C违反了能量最低原理,21Sc最后3个电子应先排满4s轨道,再排3d轨道,应为1s22s22p63s23p63d14s2;D违反了泡利原理,对于22Ti来说,3p能级共有3个轨道,最多可以排6个电子,不能排10个电子。
【答案】 A
3.A原子的结构示意图为。则x、y及该原子3p能级上的电子数分别为( )
A.18、6、4 B.20、8、6
C.18、8、6 D.15~20、3~8、1~6
【解析】 第三能层上有3s、3p、3d三个能级,因为第四能级上已经含有电子,故3s、3p能级上已经排满,3d能级可以排0~10个电子,故8≤y≤18,则20≤x≤30,只有B符合。
【答案】 B
4.具有下列电子排布式的原子中,半径最大的是( )
A.1s22s22p63s23p1 B.1s22s22p3
C.1s22s22p5 D.1s22s22p63s23p4
【解析】 根据A的电子排布式1s22s22p63s23p1,可推得该微粒是铝原子,用同样的方法可推断B是氮原子,C是氟原子,D是硫原子。根据原子半径变化规律可知r(Al)>r(S)>r(N)>r(F),所以Al的原子半径最大。
【答案】 A
5.下列关于价电子构型3s23p4的描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.常温下,可以与H2化合生成液态化合物
D.其电子排布图为
【解析】 由它的价电子构型3s23p4,可知该元素为S;常温下,不可以与H2化合;其电子排布图违背了洪特规则。
【答案】 B
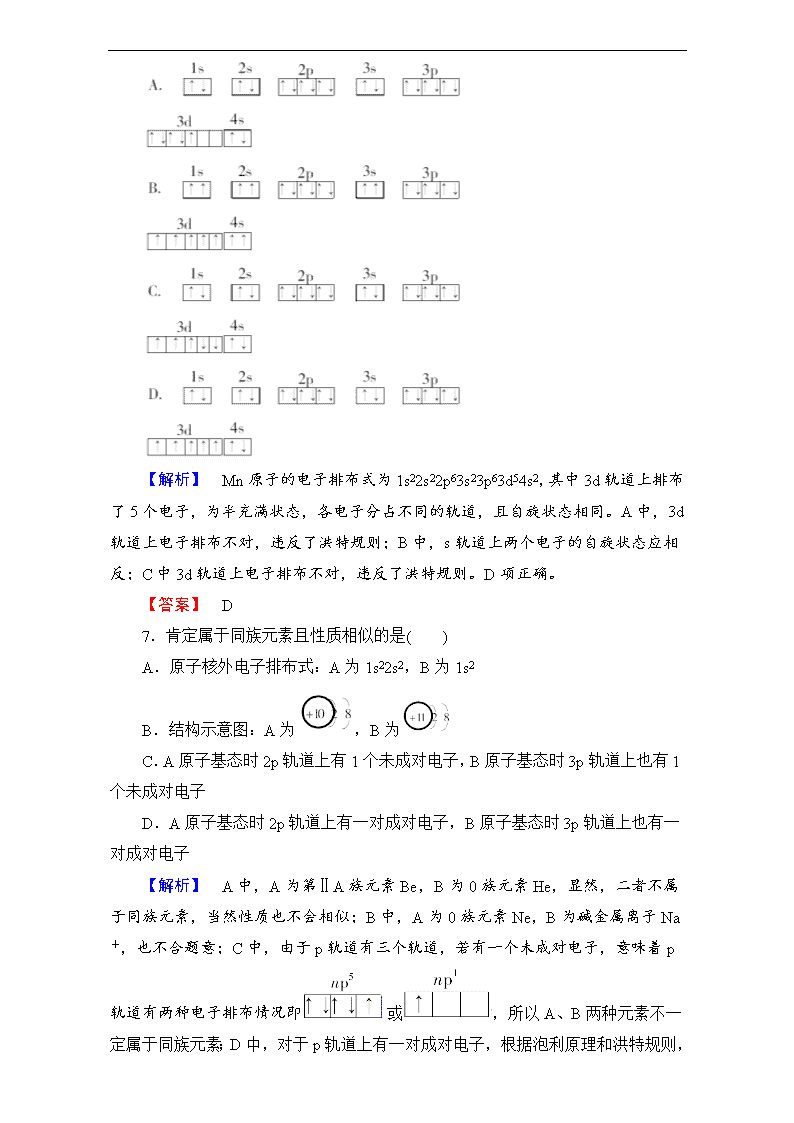
6.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是( )
【解析】 Mn原子的电子排布式为1s22s22p63s23p63d54s2,其中3d轨道上排布了5个电子,为半充满状态,各电子分占不同的轨道,且自旋状态相同。A中,3d轨道上电子排布不对,违反了洪特规则;B中,s轨道上两个电子的自旋状态应相反;C中3d轨道上电子排布不对,违反了洪特规则。D项正确。
【答案】 D
7.肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为,B为
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
【解析】 A中,A为第ⅡA族元素Be,B为0族元素He,显然,二者不属于同族元素,当然性质也不会相似;B中,A为0族元素Ne,B为碱金属离子Na+,也不合题意;C中,由于p轨道有三个轨道,若有一个未成对电子,意味着p轨道有两种电子排布情况即或
,所以A、B两种元素不一定属于同族元素;D中,对于p轨道上有一对成对电子,根据泡利原理和洪特规则,该轨道只能有一种电子排布方式:,所以A、B肯定属于同族元素。因此,答案为D。
【答案】 D
8.短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsn-1npn+1,下列说法不正确的是( ) 【导学号:90990028】
A.X元素的电负性大于Y
B.X元素的第一电离能大于Y
C.Y在周期表中位于第四周期第ⅤA族
D.原子半径Mg
c>d>b
B.电负性:a>b>d>c
C.原子序数:a>d>b>c
D.最高价含氧酸的酸性:c>d>a
【解析】 K层最多容纳2个电子,因此x=2,a原子有3个能层,最外层有4个电子,因此a为Si,由此可推知b为Na,c为N,d为P,故原子半径b>a>d>c,电负性c>d>a>b,原子序数是d>a>b>c,最高价含氧酸的酸性为c>d>a。只有D正确。
【答案】 D
10.A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是( )
A.四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等
C.元素A、C简单离子的半径大小关系为AC
【解析】 自然界中含量最多的元素为氧;由题意知B元素K层和L层电子数之和为10,则M层为8,N层为2,故B元素为钙;C是第三周期第一电离能最小的元素,为钠;第三周期中第一电离能最大的元素为氩。选项C中,A的简单离子O2-和C的简单离子Na+具有相同的电子层结构,根据核电荷数可知r(O2-)>r(Na+)。
【答案】 C
11.以下是A、B、C、D、E五种短周期元素的某些性质:
序号
A
B
C
D
E
最低负化合价
-4
-2
-1
-2
-1
电负性
2.5
2.5
3.0
3.5
4.0
下列判断正确的是( ) 【导学号:90990029】
A.C、D、E的氢化物的稳定性顺序为C>D>E
B.元素A的最外层轨道中无自旋方向相同的电子
C.元素B、C不可能形成化合物
D.与元素B处于同周期且在该周期中第一电离能最小的元素的单质能与H2O发生置换反应
【解析】 根据五种元素的电负性和最低负化合价,推知A为C、B为S、C为Cl、D为O、E为F。选项A,C、D、E的氢化物依次为HCl、H2O、HF,氢化物的稳定性顺序:HF>H2O>HCl。选项B,碳元素原子最外层电子排布式为2s22p2,2p能级上的两个电子分占两个p轨道,且自旋方向相同。选项C,S原子最外层有6个电子,Cl原子最外层有7个电子,它们之间可通过形成共价键,使两种原子均达到8电子稳定结构,形成的化合物有S2Cl2、SCl2等。选项D,此单质为Na,Na能与H2O发生置换反应生成NaOH和H2。
【答案】 D
12.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为
【解析】 由图示关系可推知:X为氦,Y为氟,M为氯,Z为硫。元素的电负性关系为:Y>M>Z,故A项不正确;离子半径关系为:S2->Cl->F-,故B项不正确;SCl2的电子式为,故C项正确;S元素基态原子最外层电子排布图为,故D项不正确。
【答案】 C
二、非选择题(本题包括4小题,共52分)
13.(14分)据下列表格,回答有关问题:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
一
二
a
b
c
d
三
e
f
g
h
i
j
k
l
(1)在上表中,第一电离能最小的元素是________(填元素名称,下同),电负性最大的元素是________。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是__________(填化学式,下同),碱性最强的是__________。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是________(填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)_______________________________________________________________。
(4)在e~k元素的原子中,原子半径最小的是______(填元素符号),其价电子排布式为______;未成对电子数最多的是_______(填元素符号),其最高价氧化物对应水化物的化学式为________;有两个未成对电子的元素是________(填元素符号);M层有两个空轨道的是________(填元素符号),其阳离子电子排布式为________。
(5)在上表所列的元素中,原子内电子所排布的能级数目相同的有________。
①a和b ②b和c ③f和g ④i和l
【解析】 (1)在a~l等几种元素中第一电离能最小的是碱金属元素钠,电负性最大的是氟元素。(2)非金属性最强的元素的最高价氧化物对应的水化物酸性最强,故酸性最强的是HClO4,金属性最强的元素的最高价氧化物对应的水化物碱性最强,故碱性最强的是NaOH。(3)Al2O3能与NaOH溶液反应,相应离子方程式为Al2O3+2OH-===2AlO+H2O。(4)e~k元素位于同一周期,且半径越来越小,故半径最小的是Cl,价电子排布式为3s23p5;未成对电子数最多的是P元素,共有3个未成对电子,其最高价含氧酸为H3PO4;有两个未成对电子的元素可能是Si元素(3s23p2)也可能是S元素(3s23p4);M层有两个空轨道的元素是Al,电子排布式为1s22s22p63s23p1,故其阳离子电子排布式为1s22s22p6。(5)①a是C元素,电子排布式为1s22s22p2,b是N元素,电子排布式为1s22s22p3,电子均排布在1s、2s、2p三个能级;②c是O元素,电子排布式为1s22s22p4,和N元素一样,电子均排布在1s、2s、2p三个能级;③f是Mg元素,电子排布式为1s22s22p63s2,电子排布在1s、2s、2p、3s四个能级;而g是Al元素,电子排布式为1s22s22p63s23p1,电子排布在1s、2s、2p、3s、3p五个能级;④i是P元素,电子排布式为1s22s22p63s23p3,l是Ar元素,电子排布式为1s22s22p63s23p6,电子均排布在1s、2s、2p、3s、3p五个能级。故选①②④。
【答案】 (1)钠 氟
(2)HClO4 NaOH
(3)g Al2O3+2OH-===2AlO+H2O
(4)Cl 3s23p5 P H3PO4 Si、S Al 1s22s22p6
(5)①②④
14.(14分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。 【导学号:90990030】
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B元素原子的核外p电子数比s电子数少1个
C元素原子的第一至第四电离能分别是
I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;
I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1
D原子核外所有p轨道全满或半满
E元素的主族序数与周期数的差为4
F是前四周期中电负性最小的元素
G在周期表的第七列
(1)B基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为该同学所画的电子排布图违背了______________________。
(3)G位于________族________区,价电子排布式为________。
(4)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因是______
________________________________________________________________________。
【解析】 (1)氮元素的最高能量电子为2p轨道上的电子,相应电子云有三种方向,呈哑铃形。(2)3s轨道的两个电子自旋方向相同,违反了泡利原理。(3)Mn原子的价电子排布式为3d54s2,最后填充的电子为3d轨道,故属于d区元素,处于第四周期ⅦB族。
【答案】 (1)3 哑铃 (2)泡利原理 (3)ⅦB d 3d54s2 (4)焰色反应 当基态原子的电子吸收能量后,电子会跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量
15.(12分)现有A、B、C、D、E、F六种元素,回答下列问题。
(1)A元素基态原子的最外层有3个未成对电子,次外层有8个电子,则A元素为_____。
(2)B-和C+的电子层结构都与氖相同,则B元素为__________,C元素为__________。
(3)D3+的3d能级为半充满,则D元素为________,其基态原子的电子排布式为______。
(4)写出3p能级上只有2个未成对电子的元素的价电子排布式:_________、__________。
(5)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E元素为__________,其基态原子的电子排布式为_______________________________。
(6)F元素的原子价电子排布式为3s23p2,则F元素在周期表中的位置是_____________。
【解析】 (1)A元素基态原子的最外层有8个未成对电子,次外层有2个电子,其电子排布式为1s22s22p63s23p3,所以A元素为15号元素即磷元素。
(2)B-和C+的电子层结构都与氖相同,氖元素的原子序数为10,则B元素为9号元素即氟元素;C元素为11号元素即钠元素。
(3)D3+的3d能级为半充满,则D3+的电子排布式为1s22s22p63s23p63d5,则D元素原子序数为26,则为26号元素铁元素,其基态原子的电子排布式为1s22s22p63s23p63d64s2或Ar]3d64s2。
(4)3p能级上只有2个未成对电子的元素,根据洪特规则,可以是3p能级上只有2个电子或者3p能级上有4个电子即价电子排布式为3s23p2或3s23p4。
(5)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E的基态原子的电子排布式为1s22s22p63s23p63d104s1或Ar]3d104s1,即为29号元素——铜元素。
(6)F元素的原子价电子排布式为3s23p2,则F元素为14号元素,即硅元素,在周期表中的位置是第三周期ⅣA族。
【答案】 (1)P (2)F Na (3)Fe Ar]3d64s2
(4)3s23p2 3s23p4 (5)Cu Ar]3d104s1
(6)第三周期ⅣA族
16.(12分)有A、B、C、D、E、F、G七种前四周期元素,G的原子序数最大。已知:A、B、C三种元素的原子次外层电子排布都是(n-1)s2(n-1)p6;D、E、F三种元素的原子序数分别等于A、B、C的最外层电子数;G元素原子的最外层电子数和A相同,内层电子排布均符合2n2;C的气态单质在标准状况下每升的质量为3.17 g;A与C能形成离子化合物AC,A离子比C离子少一个能层;E原子的最外电子层中p能级的电子数等于前一能层的电子总数。回答下列问题:
(1)上述元素的基态原子中,含有2个未成对电子的元素是__________(填元素符号);它们位于元素周期表的________区。
(2)A与D能形成离子化合物AD,则AD的电子式是______________。
(3)C元素基态原子的价电子排布式为______________________________________。
F元素基态原子最外层的电子排布图为________________________________________
________________________________________________________________________。
【解析】 由于A、B、C三种元素的原子次外层电子排布都是(n-1)s2(n-1)p6,说明A、B、C都在第三周期。由C的气态单质在标准状况下每升的质量为3.17 g,可求得单质C的摩尔质量为71 g·mol-1,即C是氯,F为氮。根据A与C能形成离子化合物AC,A离子比C离子少一个能层,说明A是钠,D为氢。根据G元素原子的最外层电子数和A相同,内层电子排布均符合2n2,且G的原子序数最大,说明G是铜。根据E原子的最外电子层中p能级的电子数等于前一能层的电子总数,说明E是碳,B为硫。
【答案】 (1)C、S p (2)Na+H]-
(3)3s23p5