- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省安平中学高一上学期第二次月考化学试题
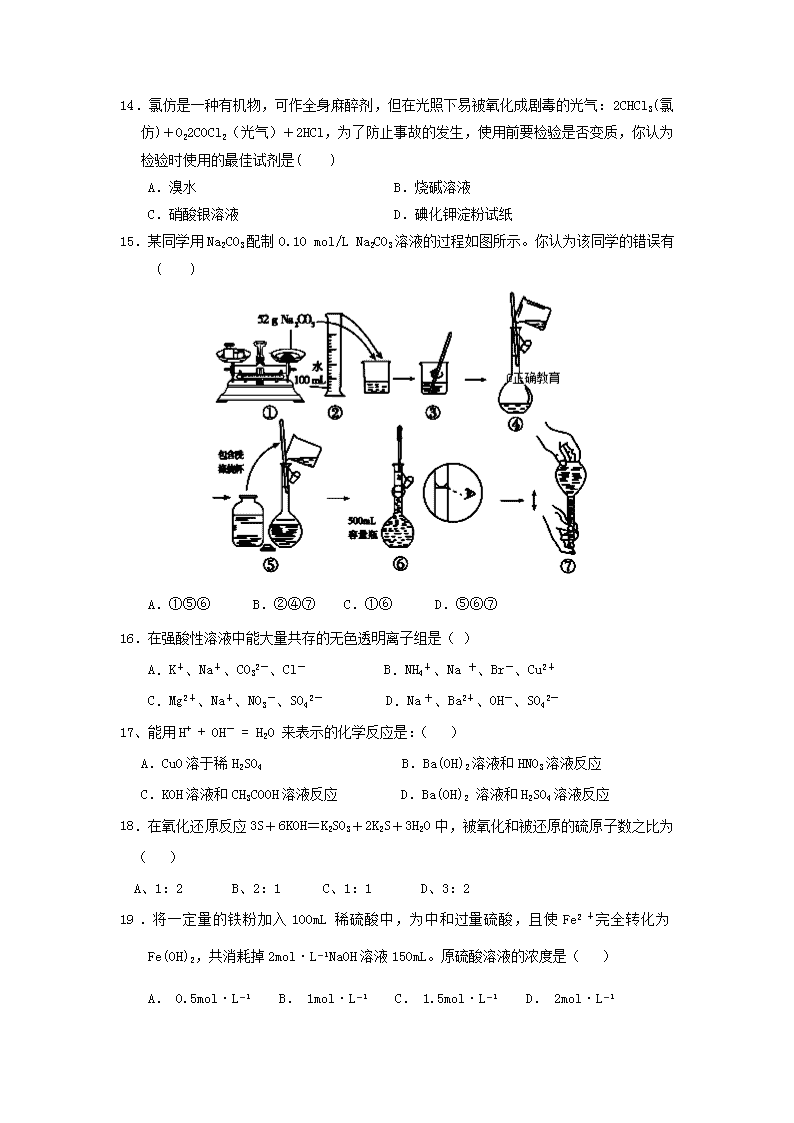
2018-2019学年河北省安平中学高一上学期第二次月考化学试题 试卷说明:1.考试时间90分钟,满分100分。 2. 将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用黑色签字笔答在答题卡上。 可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Ca-40 P-31 卷Ⅰ(选择题 共55分) 一、选择题:(共20小题,每小题2分,计40分。每小题只有一个选项正确) 1.下列物质属于电解质的是( ) A.Cu B.CO2 C.纯盐酸 D.BaSO4 2.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 ( ) A.CuO + H2 Cu + H2O B.2KMnO4K2MnO4 + MnO2 + O2↑ C.Fe2O3 + 3CO 2Fe + 2CO2 D.NaOH + HCl ==== NaCl + H2O 3.下列电离方程式中,正确的是 ( ) A.H2SO4=H2++SO42- B.Ba(OH)2=Ba2++OH- C.NaNO3=Na++NO3- D.MgSO4===Mg+2+SO 4.既有氧化性,又有还原性的粒子是 ( ) A.Fe B.Fe2+ C.Fe3+ D.Cu2+ 5.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容 量、④压强、⑤刻度线、⑥酸式或碱式这六项中的( ) A.②④⑥ B.③⑤⑥ C.①②④ D.①③⑤ 6.从2L物质的量浓度为的NaOH溶液中取出100mL溶液,下面关于这100mL溶液的叙述错误的是 A. 物质的量浓度为0.1 mol/L B. 物质的量浓度为1 mol/L C. 含NaOH 4 g D. 含NaOH 0.1 mol 7.关于容量瓶的使用,下列操作正确的是( ) A.使用前要检验容量瓶是否漏液 B.用蒸馏水冲洗后必须要将容量瓶烘干 C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 D.为了使所配溶液浓度均匀,定容结束后,手握瓶颈,左右振荡 8.下列溶液中Cl-浓度最小的是( ) A. 200mL 2mol/L MgCl2溶液 B. 300mL 2.5mol/L FeCl3溶液 C. 500mL 2.5mol/L NaCl溶液 D. 250mL 1mol/L AlCl3溶液 9、根据反应式: (1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性 从强到弱的顺序是 ( ) A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 10、吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称 为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是( ) A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂 11、下列反应中,SO2作为氧化剂而发生反应的是( ) A. 2SO2+O2 = 2SO3 B.SO2 + H2O = H2SO3 C.SO2 + 2H2S = 3S↓+ 2H2O D.SO2 + Cl2 + 2H2O = H2SO4 + 2HCl 12.已知M2O7x一+3S2一+14H+ ====2M3++3S↓+7H2O,则M2O7x一中的M的化合价为( ) A.+2 B.+3 C.+4 D.+6 13.配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( ) A.容量瓶使用前有少量蒸馏水 B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 C.在转移过程中有溶液撒在外面 D.定容时俯视刻度线 14.氯仿是一种有机物,可作全身麻醉剂,但在光照下易被氧化成剧毒的光气:2CHCl3(氯仿)+O22COCl2(光气)+2HCl,为了防止事故的发生,使用前要检验是否变质,你认为检验时使用的最佳试剂是( ) A.溴水 B.烧碱溶液 C.硝酸银溶液 D.碘化钾淀粉试纸 15.某同学用Na2CO3配制0.10 mol/L Na2CO3溶液的过程如图所示。你认为该同学的错误有( ) A.①⑤⑥ B.②④⑦ C.①⑥ D.⑤⑥⑦ 16.在强酸性溶液中能大量共存的无色透明离子组是( ) A.K+、Na+、CO32-、Cl- B.NH4+、Na 十、Br-、Cu2+ C.Mg2+、Na+、NO3-、SO42- D.Na十、Ba2+、OH-、SO42- 17、能用H+ + OH- = H2O 来表示的化学反应是:( ) A.CuO溶于稀H2SO4 B.Ba(OH)2溶液和HNO3溶液反应 C.KOH溶液和CH3COOH溶液反应 D.Ba(OH)2 溶液和H2SO4溶液反应 18.在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化和被还原的硫原子数之比为 ( ) A、1:2 B、2:1 C、1:1 D、3:2 19.将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L−1NaOH溶液150mL。原硫酸溶液的浓度是( ) A. 0.5mol·L−1 B. 1mol·L−1 C. 1.5mol·L−1 D. 2mol·L−1 20.将30mL0.5mol/L的NaOH溶液加水稀释到500mL,所得NaOH溶液的物质的量浓度为( ) A. 0.05mol/L B. 0.03mol/L C. 0. 3mol/L D. 0.5mol/L 二、选择题(共5小题,每小题3分,共15分,每小题有一个选项正确。) 21.下列溶液中,溶质的物质的量浓度不是l mol/L的是( ) A. 10 g NaOH固体溶解在水中配成250 mL溶液 B. 将80 g SO3溶于水并配成1L的溶液 C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 D. 标况下,将22. 4 L氯化氢气体溶于水配成1L溶液 22、下列离子反应方程式正确的是( ) A.NaHCO3溶液与NaOH溶液反应:HCO3- + OH- = CO32- + H2O B.硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ C.碳酸与氢氧化钠溶液反应:H+ + OH- = H2O D.盐酸与CaCO3反应:CO+2H+===H2O+CO2↑ 23.某溶液中只含、、、,其物质的量浓度比为:::5:5,若 的浓度为,则的浓度为 A. 2 mol/L B. 3 mol/L C. 4 mol/L D. 8 mol/L 24.V mL Al2(SO4)3溶液中含有Al3+ a g,取1/4V mL溶液稀释到4V mL,则稀释后溶液中SO42- 的物质的量浓度是( ) A.mol/L B.mol/L C.mol/L D.mol/L 25.在常温下,发生下列几种反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-根据上述反应, 判断下列结论错误的是( ) A.溶液中可发生:Z2+2A2+=2A3++2Z- B.Z2在①③反应中为还原剂 C.氧化性强弱的顺序为:XO4->Z2>B2>A3+ D.X2+是 XO4-的还原产物 卷II(非选择题 共45分) 三.填空题(共4小题,满分45分) 26、(12分) (1)写出下列物质在水溶液中的电离方程式 氯化铜______________ 硫酸铁______________ (2)写出下列反应的离子方程式: ①碳酸钡和盐酸溶液:_______________________________________________。 ②氢氧化钡溶液和硫酸溶液:__________________________________________。 ③铜片放入硝酸银溶液中:_____________________________________________。 (3)离子方程式Ca2++CO32-==CaCO3↓揭示了一类可溶性钙盐和可溶性碳酸盐反应的实质。请列举一例,以有关化学方程式表示。_____________________________________。 27. (10分) 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19 g·cm-3 HCl的质量分数:36.5% (1)该浓盐酸中HCl的物质的量浓度为_________mol·L -1 。 (2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是____。 A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl- 的数目 D.溶液的密度 (3)某学生取上述浓盐酸100mL, ①若加水稀释到500 mL,所得盐酸的物质的量浓度为________mol·L -1 。 ②若需使该溶液的质量分数变为原来的,应该加______mL蒸馏水。 ③若需使该溶液的物质的量浓度变为原来的,需加蒸馏水的体积______119mL(填“>”“<”或“=”)。 28.(16 分)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息回答下列问题: 5%葡萄糖注射液 500 mL 【性状】本品为无色或几乎无色的透明液体,味甜。 【规格】500mL 【贮藏】密封保存 (1)该注射液中葡萄糖的质量分数为 (2)葡萄糖的摩尔质量为 实验室欲配制480 mL上述物质的量浓度的葡萄糖溶液, (3)配制时应选用的容量瓶规格为 , 使用容量瓶的第一步操作是 。 (4)配制时(除容量瓶外)还需选用的玻璃仪器主要有 和试剂瓶。 (5)配制时有以下五个操作: ① 在天平上称出葡萄糖的固体,把它放在烧杯里,用适量的蒸馏水使它完全溶解。 ② 把制得的溶液小心地注入容量瓶中。 ③ 继续向容量瓶中加蒸馏水至液面距刻度线1 cm ~ 2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。 ④ 用少量蒸馏水洗涤烧杯和玻璃棒2 ~ 3次,每次洗涤的液体都小心转入容量瓶。 ⑤ 将容量瓶塞塞紧,充分摇匀。 请填写下列空白: 操作步骤的正确顺序为(填序号) 。 (6)以下操作会对溶液浓度造成怎样的影响?(填“偏高”、“偏低”、“无影响”)。 ①某同学定容时,观察液面俯视,对所配溶液浓度有何影响?会 ; ②若没有进行操作步骤④,所配溶液浓度将会 ; ③容量瓶未经干燥就配制溶液,溶液浓度 。 29、(7分)根据反应8NH3 + 3Cl2 = 6NH4Cl + N2,回答下列问题。 (1)氧化剂为__________(写化学式)。 (2)氧化剂与氧化产物的质量比__________。 (3)当生成28gN2时,被氧化的物质的质量是__________g,转移电子物质的量为_________。 安平中学2018-2019学年上学期第二次月考 高一化学试题答案 1 2 3 4 5 6 7 8 9 10 11 12 13 D C C B D A A C B A C D D 14 15 16 17 18 19 20 21 22 23 24 25 C C C B A C B C A C C B 26、(12分)每空2分 (1)CuCl2=Cu2+ + 2Cl- Fe2(SO4)3=2Fe3+ + 3SO42- (2)①BaCO3+2H+====Ba2++H2O+CO2↑ ②Ba2++2OH-+2H++====BaSO4↓+2H2O ③Cu+2Ag+====Cu2++2Ag (3)CaCl2+Na2CO3====CaCO3↓+2NaCl(或Ca(NO3)2+K2CO3====CaCO3↓+2KNO3) 27. (10分)每空2分 (1). 11.9 (2). )BD (3). 2.38 (4). 119 (5). < 28.(16分)除标注外每空2分 (1)5% (1分) (2)180g/mol (3)500mL(1分) 检漏 (4)玻璃棒 烧杯 胶头滴管 (5)1 2 4 3 5 (6)偏高 偏低 无影响 29.(7分)除标注外每空2分 (1)Cl2(1分) (2)213:28 (3)34 6 mol查看更多