- 2021-08-24 发布 |
- 37.5 KB |
- 24页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学反应与能量学案(全国通用)
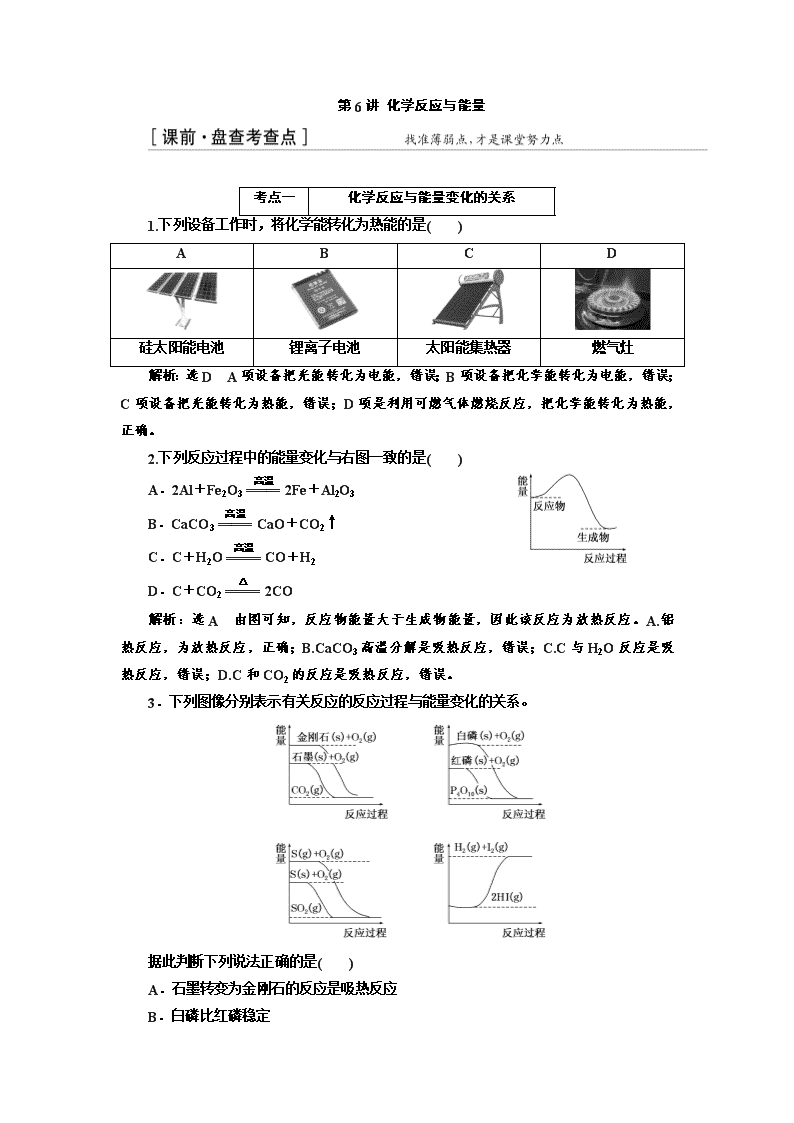
第6讲 化学反应与能量 考点一 化学反应与能量变化的关系 1.下列设备工作时,将化学能转化为热能的是( ) A B C D 硅太阳能电池 锂离子电池 太阳能集热器 燃气灶 解析:选D A项设备把光能转化为电能,错误;B项设备把化学能转化为电能,错误;C项设备把光能转化为热能,错误;D项是利用可燃气体燃烧反应,把化学能转化为热能,正确。 2.下列反应过程中的能量变化与右图一致的是( ) A.2Al+Fe2O32Fe+Al2O3 B.CaCO3CaO+CO2↑ C.C+H2OCO+H2 D.C+CO22CO 解析:选A 由图可知,反应物能量大于生成物能量,因此该反应为放热反应。A.铝热反应,为放热反应,正确;B.CaCO3高温分解是吸热反应,错误;C.C与H2O反应是吸热反应,错误;D.C和CO2的反应是吸热反应,错误。 3.下列图像分别表示有关反应的反应过程与能量变化的关系。 据此判断下列说法正确的是( ) A.石墨转变为金刚石的反应是吸热反应 B.白磷比红磷稳定 C.S(g)===S(s) ΔH>0 D.H2(g)+I2(g)2HI(g) ΔH>0 解析:选A 红磷的能量低,更稳定,B错;气态硫能量高,S(g)===S(s) ΔH<0,C错;D中反应为放热反应,ΔH<0,D错。 考点二 热化学方程式的书写与正误判断 4.氢气是人类最理想的能源。已知在25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( ) A.2H2+O2===2H2O ΔH=-571.6 kJ·mol-1 B.H2(g)+1/2O2(g)===H2O(g)ΔH=-285.8 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1 D.2H2(g)+O2(g)===2H2O(l)ΔH=+571.6 kJ·mol-1 解析:选C 放出热量142.9 kJ对应1 g氢气,即 mol氢气燃烧时的能量变化,此反应的热化学方程式可书写为H2(g)+O2(g)===H2O(l) ΔH=-142.9 kJ·mol-1,或H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1,或2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,化学计量数与ΔH应同时扩大或缩小相同倍数,C项正确。 5.下列热化学方程式正确的是( ) 选项 已知条件 热化学方程式 A H2的燃烧热为a kJ·mol-1 H2+Cl22HCl ΔH=-a kJ·mol-1 B 1 mol SO2、0.5 mol O2完全反应后,放出热量98.3 kJ 2SO2(g)+O2(g)2SO3(g) ΔH=-98.3 kJ·mol-1 C H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 ΔH=-114.6 kJ·mol-1 H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) D 31 g白磷比31 g红磷能量多b kJ P4(s)===4P(s) ΔH=-4b kJ·mol-1 解析:选D 选项A中符合已知条件的应是H2和O2反应,A错;ΔH应为-196.6 kJ·mol-1,B错;选项C中由于生成BaSO4沉淀,放出的热量大于114.6 kJ,C错。 6.化学反应N2+3H22NH3的能量变化如图所示,该反应的热化学方程式是( ) A.N2(g)+3H2(g)2NH3(l) ΔH=2(a-b-c) kJ·mol-1 B.N2(g)+3H2(g)2NH3(g) ΔH=2(b-a) kJ·mol-1 C.N2(g)+H2(g)NH3(l) ΔH=(b+c-a) kJ·mol-1 D.N2(g)+H2(g)NH3(g) ΔH=(a+b) kJ·mol-1 解析:选A 由题图可看出 mol N2(g)和 mol H2(g)转化成1 mol N和3 mol H时吸收a kJ热量,而1 mol N和3 mol H转化成1 mol NH3(g)时放出b kJ热量,1 mol N和3 mol H转化成1 mol NH3(l)时放出(b+c) kJ热量,故 mol N2(g)和 mol H2(g)转化成1 mol NH3(g)时放出(b-a) kJ热量, mol N2(g)和 mol H2(g)转化成1 mol NH3(l)时放出(b+c-a) kJ热量,放热反应的ΔH小于0,故只有A项正确。 7.已知:101 kPa时1 mol辛烷燃烧生成液态水时放出热量为5 518 kJ;强酸和强碱在稀溶液中发生反应生成1 mol H2O时放出的热量为57.3 kJ,则下列热化学方程式的书写正确的是( ) ①2C8H18(l)+25O2(g)===16CO2(g)+18H2O(g)ΔH=-11 036 kJ·mol-1 ②2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l)ΔH=-11 036 kJ·mol-1 ③H++OH-===H2O ΔH=-57.3 kJ·mol-1 ④2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1 A.①③ B.②③ C.②④ D.只有② 解析:选C 判断热化学方程式的书写时,要注意状态、ΔH单位、符号以及数值是否与前面的化学计量数相对应。①错在水的状态,应为液态;③错在没有标出是在水溶液中的反应及水的状态,正确的为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。 考点三 有关反应热的计算与比较 8.(2016·海南高考)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应: C57H104O6(s)+80O2(g)===57CO2(g)+52H2O(l) 已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热ΔH为( ) A.3.8×104 kJ·mol-1 B.-3.8×104 kJ·mol-1 C.3.4×104 kJ·mol-1 D.-3.4×104 kJ·mol-1 解析:选D 燃烧热指的是燃烧1 mol 可燃物生成稳定的氧化物所放出的热量。燃烧1 kg油酸甘油酯释放出热量3.8×104 kJ,则燃烧1 mol 油酸甘油酯释放出热量为×3.8×104 kJ=3.4×104 kJ,则得油酸甘油酯的燃烧热ΔH=-3.4×104 kJ·mol-1。 9.有关键能(破坏1 mol共价键吸收的能量)数据如表 化学键 Si—O O===O Si—Si 键能/(kJ·mol-1) X 498.8 176 晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)( ) A.34.6 B.460 C.832 D.920 解析:选B 由公式ΔH=E(反应物的键能之和)-E(生成物的键能之和)可得-989.2 kJ·mol-1=176 kJ·mol-1×2+498.8 kJ·mol-1-4×X,则X=460 kJ·mol-1。 10.在1 200 ℃时,天然气脱硫工艺中会发生下列反应 H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1 2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2 H2S(g)+O2(g)===S(g)+H2O(g) ΔH3 2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( ) A.ΔH4=(ΔH1+ΔH2-3ΔH3) B.ΔH4=(3ΔH3-ΔH1-ΔH2) C.ΔH4=(ΔH1+ΔH2-3ΔH3) D.ΔH4=(ΔH1-ΔH2-3ΔH3) 解析:选A 根据盖斯定律,由第一个反应×+第二个反应×-第三个反应× 2可得第四个反应,则ΔH4=ΔH1×+ΔH2×-ΔH3×2=(ΔH1+ΔH2-3ΔH3)。 11.(2016·河南名校联考)美国大推力运载火箭“太空发射系统”所需燃料为高能火箭燃料肼(H2N—NH2)。该物质在燃烧过程的能量变化如图所示。 已知: 化学键 N—N O===O NN N—H 断开1 mol共价键所需能量/kJ 154 500 942 a 下列判断错误的是( ) A.N2的稳定性强于O2的稳定性 B.N2H4在O2中燃烧的热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534 kJ·mol-1 C.表中的a=391 D.图示中的ΔH3=+3 286 kJ·mol-1 解析:选D A项,根据表中数据可知,断开1 mol N≡N键需吸收942 kJ热量,断开1 mol O===O键需吸收500 kJ热量,说明N2分子的稳定性强于O2分子的,正确。B项,根据图中反应物、生成物的总能量变化可知其热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1,正确。1 mol N2H4和1 mol O2断裂化学键所吸收的总能量ΔH3=2 752 kJ-534 kJ=2 218 kJ,即4a kJ·mol-1+154 kJ·mol-1+500 kJ·mol-1=2 218 kJ·mol-1,解得a=391,C项正确,D项错误。 12.(2016·苏北四市调研)已知: ①2H2(g)+O2(g)===2H2O(g) ΔH1 ②3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2 ③2Fe(s)+O2(g)===Fe2O3(s) ΔH3 ④2Al(s)+O2(g)===Al2O3(s) ΔH4 ⑤2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是( ) A.ΔH1<0,ΔH3>0 B.ΔH5<0,ΔH4<ΔH3 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 解析:选B 氢气的燃烧反应为放热反应,则ΔH1<0,铁的氧化反应为放热反应,ΔH3<0,A项错误;铝热反应为放热反应,ΔH5<0,由④-③=⑤得ΔH4-ΔH3=ΔH5<0,所以ΔH4<ΔH3,B项正确;由②+③得3H2(g)+O2(g)===3H2O(g),则ΔH2+ΔH3=ΔH1,C项错误;ΔH3=ΔH4-ΔH5,D项错误。 ⊙考查综合迁移应用能力 13.(1)已知: ①TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1 ②2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1 写出TiO2和焦炭、Cl2反应生成液态TiCl4和CO气体的热化学方程式:________________________________________________________________________。 (2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是 A.CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1 B.CH3OH(g)+O2(g)===CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1 由上述方程式可知,1 mol CH3OH完全燃烧生成H2O(l)时放出的热量________(填“大于”“等于”“小于”或“不能确定”)676. 7 kJ。已知水的汽化热为44 kJ·mol-1,则表示H2燃烧热的热化学方程式为____________________________________________________。 解析:(1)由①+②即可得到目标方程式。(2)气态水变为液态水要放出热量,故1 mol CH3OH完全燃烧生成H2O(l)时放出的热量应大于676.7 kJ。将可得:H2(g)+O2(g)===H2O(g) ΔH=-241.9 kJ·mol-1,由于水的汽化热为44 kJ·mol-1,所以表示H2燃烧热的热化学方程式为H2(g)+O2(g)===H2O(l) ΔH=-285.9 kJ·mol-1。 答案:(1)TiO2(s)+2C(s)+2Cl2(g)===TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1 (2)大于 H2(g)+O2(g)===H2O(l) ΔH=-285.9 kJ·mol-1 14.(2016·银川模拟)一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下: 回答下列问题: (1)SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=______________________。 (2)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。 已知:N2与O2生成NO的反应是吸热反应。请解释: ①随空/燃比增大,CO与CxHy的含量减少的原因是______________________________________________。 ②当空/燃比达到15后,NO减少的原因可能是______________________________。 (3)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________ mol C(碳)。 解析:(1)由图Ⅰ可知,O2(g)+2CO(g)===2CO2(g) ΔH=(-2×283)kJ·mol-1=-566 kJ·mol-1① 由图Ⅱ可知,S(s)+O2(g)===SO2(g)ΔH=-296 kJ·mol-1 ② ①-②得:SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=-566-(-296)=-270 kJ·mol-1。 (3)依据图示得到化学方程式为10Fe0.9O+CO2===C+3Fe3O4,则当1 mol缺铁氧化物[Fe0.9O]参与反应时,可生成0.1 mol C。 答案:(1)-270 kJ·mol-1 (2)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少 ②因为反应N2(g)+O2(g)2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NO减少 (3)0.1 考点一 化学反应与能量变化的关系 查看《课前自测诊断卷》考点一,有哪些题目做错,为课堂找到努力方向! 考点定位 基础送分考点 错因定位 不能正确理解能量变化图中各符号的含义而出错,如[诊断卷T2]。 1.记住解答能量变化图像题的“4关键” (1)从反应物至最高点的能量数值表示正反应的活化能,即E1; (2)从最高点至生成物的能量数值表示逆反应的活化能,即E2; (3)ΔH=E1-E2; (4)催化剂只能影响正、逆反应的活化能,而不能影响反应的ΔH。 2.防范化学反应能量变化中的易错点(正确的打“√”,错误的打“×”) (1)伴随着能量变化的物质变化都是化学变化(×) (2)反应C(s)+CO2(g)===2CO(g) ΔH>0,则反应物断裂化学键吸收的总能量低于反应物形成化学键放出的总能量(×) (3)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关(√) (4)使用催化剂能够降低化学反应的反应热(ΔH)(×) (5)在CO2中,Mg燃烧生成MgO和C,反应中化学能全部转化为热能(×) (6)2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的ΔH相等(×) (7)右图表示燃料燃烧反应的能量变化(×) (8)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定(√) (9)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH不同(×) 1.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 解析:选C 根据题图可知,状态Ⅰ的能量高于状态Ⅲ的能量,故该过程是放热反应,A错误;根据图中状态Ⅰ、Ⅱ、Ⅲ可以看出整个过程中CO中的化学键没有断裂,B错误;由状态Ⅲ可知,生成物是CO2,具有极性共价键,C正确;状态Ⅰ→状态Ⅲ表示CO与O反应的过程,D错误。 2.(2016·石门模拟)某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( ) A.两步反应均为吸热反应 B.三种化合物中C最稳定 C.加入催化剂会改变反应的焓变 D.整个反应的ΔH=E1-E2 解析:选B 根据图示可知第一步反应的反应物的能量比生成物的能量低,所以该步反应是吸热反应;而第二步反应中生成物的能量比反应物的能量低,该步反应是放热反应,A错误;根据图示可知三种化合物中C含有的能量最低,故其最稳定,B正确;加入催化剂会改变反应的活化能,但是不能改变反应物、生成物的能量,所以不能改变反应的焓变,C错误;整个反应的ΔH=E1+E3-E2-E4,D错误。 考点二 热化学方程式的书写与正误判断 查看《课前自测诊断卷》考点二,有哪些题目做错,为课堂找到努力方向! 考点定位 重要保分考点 错因定位 1.忽视热化学方程式和化学方程式的区别而错误。书写热化学方程式要注明各物质的聚集状态、ΔH的数值、符号、单位等要符合要求,如[诊断卷T4(A)、(D)]。 2.记不住相关概念而出现判断错误,如[诊断卷T5(A)]因不知燃烧热是何物,而出现错选。 1.练一练:夯实热化学方程式中的基础点 (1)适量的N2和O2完全反应,每生成23 g NO2吸收16.95 kJ热量。N2与O2反应的热化学方程式为______________________________________________________________。 (2)18 g葡萄糖与适量O2反应,生成CO2和液态水,放出280.4 kJ热量。葡萄糖燃烧的热化学方程式为______________________________________________________________。 (3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为____________________________________________________________________。 (4)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ________________________________________________________________________ ________________________________________________________________________。 (5)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。 CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ·mol-1 ① 2NO2(g)N2O4(g) ΔH2=-56.9 kJ·mol-1② 写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式:________________________________________________________________________。 答案:(1)N2(g)+2O2(g)===2NO2(g)ΔH=+67.8 kJ·mol-1 (2)C6H+6O2(g)===6H2O(l)+6CO2(g)ΔH=-2 804 kJ·mol-1 (3)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)ΔH=-1 427.2 kJ·mol-1 (4)NO2(g)+CO(g)===CO2(g)+NO(g)ΔH=-234 kJ·mol-1 (5)CH4(g)+N2O4(g)===N2(g)+CO2(g)+2H2O(g)ΔH=-810.1 kJ·mol-1 2.记一记:注意热化学方程式的书写与判断中的易错点 (1)未标明反应物或生成物的状态而造成错误。 (2)反应热的符号使用不正确,即吸热反应未标出“+”号,放热反应未标出“-”号,从而导致错误。 (3)漏写ΔH的单位,或者将ΔH的单位写为kJ,从而造成错误。 (4)反应热的数值与方程式的计量数不对应而造成错误。 (5)对燃烧热、中和热的概念理解不到位,忽略其标准是1 mol可燃物或生成1 mol H2O(l)而造成错误。 考向一 热化学方程式的正误判断 1.下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热) D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) 解析:选C 燃烧热要求可燃物的物质的量必须为1 mol,得到的氧化物必须是稳定的氧化物,即H2O的状态必须为液态,A项错误;中和反应是放热反应,ΔH应小于0,B项错误;热化学反应方程式要注明物质的聚集状态,D项错误。 2.下列热化学方程式书写正确的是( ) A.2SO2+O22SO3ΔH=-196.6 kJ·mol-1 B.H2(g)+O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ D.C(s)+O2(g)===CO2(g)ΔH=+393.5 kJ·mol-1 解析:选B A项未注明各物质的聚集状态,错误;C项ΔH的单位错误,应为kJ·mol-1;D项碳的燃烧为放热反应,ΔH<0,错误。 考向二 热化学方程式的书写 3.(1)(2015·天津高考节选)已知1 mol钠的单质在足量O2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:____________________________________________。 (2)(2015·安徽高考节选)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4 (s)放热21.6 kJ,该反应的热化学方程式是 ________________________________________________________________________。 (3)(2014·天津高考节选)由粗硅制纯硅过程如下: Si(粗)SiCl4SiCl4(纯)Si(纯) 在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:__________________________________________________________。 (4)(2014·安徽高考节选)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式为_______________________________________________________________。 答案:(1)2Na(s)+O2(g)===Na2O2(s)ΔH=-511 kJ·mol-1 (2)NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g)ΔH=-216.0 kJ·mol-1 (3)SiCl4(g)+2H2(g)Si(s)+4HCl(g)ΔH=+0.025a kJ·mol-1 (4)4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s)ΔH=-177.6 kJ·mol-1 考点三 有关反应热的计算与比较 查看《课前自测诊断卷》考点三,有哪些题目做错,为课堂找到努力方向! 考点定位 难点拉分考点 错因定位 1.判断物质所含化学键的数目错误,如[诊断卷T11(C)]确定N2H4中N—H键的数目错误。不能熟练运用盖斯定律计算反应的ΔH,如[诊断卷T10] 找不出前3个反应与第4个反应之间的关系。 2.比较反应热大小时只比较数值而忽视放热反应ΔH为“-”,如[诊断卷T12]。 1.填一填:练透基础问题 (1)H2(g)+O2(g)===H2O(g) ΔH1; H2O(g)===H2(g)+O2(g) ΔH2。 ΔH1与ΔH2的关系是:ΔH1=-ΔH2。 (2)2H2(g)+O2(g)===2H2O(g)ΔH1=-a kJ·mol-1 H2(g)+O2(g)===H2O(g) ΔH2=-b kJ·mol-1 则a、b之间的关系是:a=2b。 (3)已知H—H、O===O和O—H键的键能分别是436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则反应: 2H2(g)+O2(g)===2H2O(g) ΔH=-480_kJ·mol-1。 (4)已知:①C(s)+O2(g)===CO2(g) ΔH1 ②C(s)+H2O(g)===CO(g)+H2(g) ΔH2 ③H2(g)+O2(g)===H2O(g) ΔH3 ④CO(g)+O2(g)===CO2(g) ΔH4 则ΔH1=ΔH2+ΔH3+ΔH4。 2.判一判:完成对反应热的大小比较 (1)已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。 ①4P(红,s)+5O2(g)===2P2O5(s) ΔH1 ②4P(白,s)+5O2(g)===2P2O5(s) ΔH2 ΔH1ΔH2(填“>”“<”或“=”,下同) (2)①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH4 ②NaOH(aq)+H2SO4(浓)===Na2SO4(aq)+H2O(l) ΔH5 NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH6 ΔH3ΔH4;ΔH5ΔH6 3.记一记:记住反应热常见的计算方法 (1)根据“两个”公式计算反应热 ΔH=E(生成物的总能量)-E(反应物的总能量) ΔH=E(反应物的键能之和)-E(生成物的键能之和) (2)根据热化学方程式计算反应热 对于任意一个热化学方程式,焓变与反应物的物质的量成正比(Q=n·ΔH) (3)根据盖斯定律计算反应热 若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变可通过这几个化学反应焓变的加减而得到。 表示方法:,ΔH=ΔH1+ΔH2。 考向一 利用键能进行有关反应热(ΔH)的计算 1.(2015·全国卷Ⅰ节选)已知反应2HI(g)===H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________kJ。 解析:设1 mol HI(g)分子中化学键断裂吸收的能量为x,则2x-436 kJ-151 kJ=+11 kJ,x=299 kJ。 答案:299 2.(2015·全国卷Ⅱ节选)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下: ①CO(g)+2H2(g)CH3OH(g) ΔH1 ②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2 ③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3 回答下列问题: 已知反应①中相关的化学键键能数据如下: 化学键 HH CO C )O HO CH E/(kJ·mol-1) 436 343 1 076 465 413 由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。 解析:根据键能与反应热的关系可知,ΔH1 =反应物的键能之和-生成物的键能之和=(1 076 kJ·mol-1+2×436 kJ·mol-1)-(413 kJ·mol-1×3+343 kJ·mol-1+465 kJ·mol-1)=-99 kJ·mol-1。根据盖斯定律,由②-①可得:CO2(g)+H2(g)CO(g)+H2O(g),ΔH3=ΔH2-ΔH1=(-58 kJ·mol-1)-(-99 kJ·mol-1)=+41 kJ·mol-1。 答案:-99 +41 备考锦囊 反应热与键能的关系 反应热ΔH=E1-E2或ΔH=E4-E3,即ΔH等于反应物的键能总和减去生成物的键能总和,或生成物具有的总能量减去反应物具有的总能量。 考向二 利用能量变化图计算反应热(ΔH) 3.一定条件下,化学反应2H2+O2===2H2O的能量变化如图所示,则反应的热化学方程式可表示为( ) A.H2(g)+O2(g)===H2O(g)ΔH=(a+b)kJ·mol-1 B.2H2(g)+O2(g)===2H2O(g)ΔH=2(b-a)kJ·mol-1 C.H2(g)+O2(g)===H2O(l)ΔH=(b+c-a)kJ·mol-1 D.2H2(g)+O2(g)===2H2O(l)ΔH=2(a-b-c)kJ·mol-1 解析:选D 反应热等于反应物总能量减去生成物总能量,根据图像可知H2(g)+O2(g)===H2O(g) ΔH=(a-b)kJ·mol-1,H2(g)+O2(g)===H2O(l) ΔH=(a-b-c)kJ·mol-1,所以有2H2(g)+O2(g)===2H2O(g) ΔH=2(a-b)kJ·mol-1或2H2(g)+O2(g)===2H2O(l) ΔH=2(a-b-c)kJ·mol-1。 4.(2015·海南高考节选)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________ kJ·mol-1。 解析:根据图像可知N2O与NO反应生成氮气和二氧化氮的反应热为(209-348)kJ·mol-1=-139 kJ·mol-1。 答案:-139 考向三 利用盖斯定律计算反应热(ΔH) 5.(1)(2016·全国甲卷节选) ①2O2(g)+N2(g)===N2O4(l) ΔH1 ②N2(g)+2H2(g)===N2H4(l) ΔH2 ③O2(g)+2H2(g)===2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ·mol-1 上述反应热效应之间的关系式为ΔH4=____________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________________________。 (2)(2016·全国丙卷节选)已知下列反应: SO2(g)+2OH-(aq)===SO(aq)+H2O(l) ΔH1 ClO-(aq)+SO(aq)===SO(aq)+Cl-(aq) ΔH2 CaSO4(s)===Ca2+(aq)+SO(aq) ΔH3 则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=________。 (3)(2016·四川高考节选)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25 ℃,101 kPa时: CaO(s)+H2SO4(l)===CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1 5CaO(s)+3H3PO4(l)+HF(g)===Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1 则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 ________________________________________________________________________。 解析:(1)由已知热化学方程式①②③可得: N2O4(l)===2O2(g)+N2(g) -ΔH1 2N2H4(l)===2N2(g)+4H2(g) -2ΔH2 2O2(g)+4H2(g)===4H2O(g) 2ΔH3 根据盖斯定律,将上述三个热化学方程式相加,可得2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=2ΔH3-2ΔH2-ΔH1。由热化学方程式可知,N2H4和N2O4反应时放出大量的热,且产生大量气体。 (2)将题给三个热化学方程式分别标号为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律,由Ⅰ+Ⅱ-Ⅲ可得:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq),则有ΔH=ΔH1+ΔH2-ΔH3。 (3)把已知热化学方程式依次编号①、②,根据盖斯定律由①×5-②得:Ca5(PO4)3F(s)+5H2SO4(l)===5CaSO4(s)+3H3PO4(l)+HF(g) ΔH=-418 kJ·mol-1。 答案:(1)2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体 (2)ΔH1+ΔH2-ΔH3 (3)Ca5(PO4)3F(s)+5H2SO4(l)===5CaSO4(s)+3H3PO4(l)+HF(g) ΔH=-418 kJ·mol-1 6.(1)(2015·山东高考节选)贮氢合金ThNi5可催化由CO、H2合成CH4的反应。温度为T时,该反应的热化学方程式为___________________________________________________。 已知温度为T时: CH4(g)+2H2O(g)===CO2(g)+4H2(g)ΔH=+165 kJ·mol-1 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 (2)(2015·四川高考节选)已知25 ℃,101 kPa时: 4Fe(s)+3O2(g)===2Fe2O3(s)ΔH=-1 648 kJ·mol-1 C(s)+O2(g)===CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)===2FeCO3(s)ΔH=-1 480 kJ·mol-1 FeCO3在空气中加热反应生成Fe2O3的热化学方程式是__________________________。 解析:(1)由题意把已知两个反应依次编号①、②,应用盖斯定律,由②-①可得CO、H2合成CH4的反应: CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=-206 kJ·mol-1。 (2)将所给热化学方程式依次标号①、②、③ 根据盖斯定律:③×(-2)+①+②×4可得: 4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1。 答案:(1)CO(g)+3H2(g)===CH4(g)+H2O(g)ΔH=-206 kJ·mol-1 (2)4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 备考锦囊 考向四 反应热的大小比较 7.(2014·新课标卷Ⅱ)室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( ) A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3 解析:选B 1 mol CuSO4·5H2O(s)溶于水会使溶液温度降低,为吸热反应,故ΔH1>0,1 mol CuSO4(s)溶于水会使溶液温度升高,为放热反应,故 ΔH2<0,1 mol CuSO4·5H2O(s)溶于水可以分为两个过程,先分解成1 mol CuSO4(s)和5 mol水,然后1 mol CuSO4(s)再溶于水, CuSO4·5H2O的分解为吸热反应,即ΔH3>0,根据盖斯定律得到关系式ΔH1=ΔH2+ΔH3,分析得到答案:ΔH1<ΔH3。 8.强酸与强碱的稀溶液发生中和反应的热效应: H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 向1 L 0.5 mol·L-1的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是( ) A.ΔH1<ΔH2<ΔH3 B.ΔH1>ΔH3>ΔH2 C.ΔH2>ΔH1>ΔH3 D.ΔH1<ΔH3<ΔH2 解析:选B 与浓硫酸反应放出的热量最多,ΔH最小,与稀醋酸反应放出的热量最少,ΔH最大,所以ΔH1>ΔH3>ΔH2,B项正确。 备考锦囊 比较反应热大小的3项注意 (1)反应中各物质的聚集状态。 (2)ΔH有正负之分,比较时要连同“+”、“-”一起比较,类似数学中的正、负数大小的比较。 (3)若只比较放出或吸收热量的多少,则只比较数值的大小,不考虑正、负号。 1.下列关于反应过程中能量变化的说法正确的是( ) A.图中的曲线说明该反应是放热反应,即CH2===CH2(g)+H2(g)―→CH3CH3(g) ΔH<0 B.化合反应都是放热反应,分解反应都是吸热反应 C.若图中表示有无使用催化剂时的反应进程,则b曲线使用催化剂,a曲线没使用催化剂 D.图中,若ΔH=Q kJ·mol-1(Q>0),表示正反应活化能比逆反应活化能大Q kJ·mol-1 解析:选D 反应物的总能量低于生成物的总能量,则图中的曲线说明该反应是吸热反应,即CH2===CH2(g)+H2(g)―→CH3CH3(g) ΔH>0,A错误;大多数化合反应都是放热反应,但C+CO2===2CO是吸热反应,大多数分解反应都是吸热反应,但(NH4)2Cr2O7===N2+Cr2O3+4H2O是放热反应,B错误;a曲线表示使用催化剂,b曲线表示没有使用催化剂,C错误;某反应的ΔH= Q kJ·mol-1(Q>0),ΔH=正反应的活化能-逆反应的活化能=Q kJ·mol-1,说明正反应活化能比逆反应活化能大Q kJ·mol-1,D正确。 2.(2016·开封一模)根据表中的信息判断下列说法错误的是( ) 物质 外观 熔点 燃烧热/(kJ·mol-1) 金刚石 无色,透明固体 ? 395.4 石墨 灰黑,不透明固体 ? 393.5 A.由表中信息可得如图所示的图像 B.由表中信息知C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·mol-1 C.由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 D.表示石墨燃烧热的热化学方程式为C(石墨,s)+O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 解析:选D 由表中信息可得:C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.4 kJ·mol-1 ①,C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ②。根据盖斯定律,由①-②得C(金刚石,s)===C(石墨,s) ΔH=-1.9 kJ·mol-1,A、B项正确;由表中信息可知等质量的石墨所具有的能量低于金刚石,能量越低越稳定,而石墨的层内共价键键长比金刚石的共价键键长短,作用力更大,破坏石墨中化学键需要更大能量,所以石墨的熔点比金刚石高,C项正确;A项解析中式②表示石墨燃烧热的热化学方程式,D项错误。 3.(2016·江苏高考)通过以下反应均可获取H2。下列有关说法正确的是( ) ①太阳光催化分解水制氢:2H2O(l)===2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1 ②焦炭与水反应制氢:C(s)+H2O(g)===CO(g)+H2(g) ΔH2=131.3 kJ·mol-1 ③甲烷与水反应制氢:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ·mol-1 解析:选D 反应①是太阳能转化为化学能,A不正确;反应②中ΔH2>0,是吸热反应,B不正确;反应③使用催化剂不能改变反应的焓变,ΔH不变,C不正确;D项中,由盖斯定律,反应③-②可得CH4(g)===C(s)+2H2(g) ΔH=74.8 kJ·mol-1,正确。 4.某硝酸厂处理尾气中NO的方法是在催化剂存在时用H2将NO还原为N2:NO(g)+H2(g)===N2(g)+H2O(g) ΔH=m kJ·mol-1,其能量变化过程如下: 下列说法正确的是( ) A.过程①②③④都是放热过程 B.m=(a+b-c-d) C.m=-(c+a-d-b) D.m=(c+d-a-b) 解析:选B 分子变为原子需要吸收能量,原子结合为分子释放出能量,则有:①2NO(g)===2N(g)+2O(g) ΔH1=+a kJ·mol-1、②2N(g)===N2(g) ΔH2=-c kJ·mol-1、③2H2(g)===4H(g) ΔH3=+b kJ·mol-1、④2O(g)+4H(g)===2H2O(g) ΔH4=-d kJ·mol-1 。根据盖斯定律,由①+②+③+④得:2NO(g)+2H2(g)===N2(g)+2H2O(g) ΔH=+(a+b-c-d) kJ·mol-1,则NO(g)+H2(g)===N2(g)+H2O(g) ΔH=(a+b-c-d) kJ·mol-1。 5.下列有关叙述不正确的是( ) ①在100 ℃,101 kPa条件下,液态水汽化热为40.69 kJ·mol-1,则H2O(g)===H2O(l) ΔH=+40.69 kJ·mol-1 ②已知25 ℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO)是否相等,总有c(Mg2+)·c(CO)=6.82×10-6 ③已知: 共价键 C—C C===C C—H H—H 键能/(kJ·mol-1) 348 610 413 436 ΔH=-384 kJ·mol-1 ④常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,则NH3·H2O的电离被抑制,溶液pH减小 A.①② B.③④ C.②④ D.①③ 解析:选D 水由气态变为液态时放热,ΔH<0,①错误;温度一定,Ksp(MgCO3)不变,根据Ksp(MgCO3)=c(Mg2+)·c(CO)可知②正确;由于甲苯中苯环上的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的化学键,其键能大小未知,故无法计算该反应的反应热,③错误;根据NH3·H2ONH+OH-,当向氨水中加入少量NH4Cl晶体时,由于NH浓度增加,平衡左移,即NH3·H2O的电离被抑制,溶液pH减小,④正确。 6.已知:2NO2(g)N2O4(g) ΔH1 2NO2(g)N2O4(l) ΔH2。 下列能量变化示意图中,正确的是( ) 解析:选A NO2转化为N2O4为放热反应,故可排除C、D,又因为气态N2O4的能量高于液态N2O4的能量,所以选A。 7.高温下,在密闭容器中用H2还原WO2可得到金属钨,其总反应为WO2(s)+2H2(g)===W(s)+2H2O(g) ΔH=+66.0 ;又已知WO2(g)+2H2(g)===W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1,下列判断正确的是( ) A.总反应中,反应物能量总和大于生成物能量总和 B.W(s)+2H2O(l)===WO2(s)+2H2(g)ΔH=-66.0 kJ·mol-1 C.总反应中生成1 mol W(s)放出66.0 kJ热量 D.WO2(s)===WO2(g)的ΔH=+203.9 kJ·mol-1 解析:选D 由题中信息知用H2还原WO2,得到金属钨为吸热反应,故可判知反应物总能量小于生成物总能量,同时知生成1 mol W(s)时需吸收66.0 kJ的热量,A、C错误;B项中H2O的状态符号应为“g”,B错误;根据盖斯定律,由题给的两个热化学方程式相减可得:WO2(s)WO2(g) ΔH=+203.9 kJ·mol-1,D正确。 8.(2016·长沙模拟)已知下列反应的热化学方程式为: ①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1; ②CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH2=-870.3 kJ·mol-1; ③H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1。 则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热(焓变)为( ) A.488.3 kJ·mol-1 B.-488.3 kJ·mol-1 C.-244.15 kJ·mol-1 D.244.15 kJ·mol-1 解析:选B 由盖斯定律得该反应的反应热ΔH=①×2+③×2-②=(-393.5 kJ·mol-1)×2+(-285.8 kJ·mol-1)×2-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1。 9.资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。 (1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下: 6FeO(s)+CO2(g)===2Fe3O4(s)+C(s)ΔH=-76.0 kJ·mol-1 ①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为________ mol。 ②已知:C(s)+2H2O(g)===CO2(g)+2H2(g) ΔH=+113.4 kJ·mol-1,则反应:3FeO(s)+H2O(g)===Fe3O4(s)+H2(g)的ΔH=________。 (2)在一定条件下,二氧化碳转化为甲烷的反应为CO2(g)+4H2(g)CH4(g)+2H2O(g)。向容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300 ℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300 ℃时上述反应的化学平衡常数K=________。200 ℃时该反应的化学平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。 (3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: ①上述生产过程的能量转化方式是________(填字母)。 a.电能转化为化学能 b.太阳能转化为电能 c.太阳能转化为化学能 D.化学能转化为电能 ②上述电解反应在温度小于900 ℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应为3CO2+4e-===C+2CO,则阳极的电极反应为____________。 解析:(1)①由6FeO(s)+CO2(g)===2Fe3O4(s)+C(s)知,铁元素的化合价由+2升至+,碳元素的化合价由+4降至0,每生成1 mol C转移4 mol电子,生成2 mol Fe3O4,则生成1 mol Fe3O4转移2 mol电子;②反应1:6FeO(s)+CO2(g)===2Fe3O4(s)+C(s) ΔH1=-76.0 kJ·mol-1,反应2:C(s)+2H2O(g)===CO2(g)+2H2(g) ΔH2=+113.4 kJ·mol-1,根据盖斯定律,ΔH=(ΔH1+ΔH2)=×(-76.0+113.4) kJ·mol-1=+18.7 kJ·mol-1。(2)300 ℃时该反应的化学平衡常数K===25;300 ℃时,K=25,200 ℃时,K=64.8,化学平衡常数增大,则降低温度,平衡正向移动,因此正反应为放热反应,ΔH<0。(3)①由题图知,太阳能转化为化学能,电能转化为化学能,故太阳能和电能转化为化学能,选ac。②电解反应中阳极失去电子发生氧化反应,又电解质为熔融Na2CO3,故阳极的电极反应为2CO-4e-===2CO2↑+O2↑。 答案:(1)①2 ②+18.7 kJ·mol-1 (2)25 < (3)①ac ②2CO-4e-===2CO2↑+O2↑查看更多