2021届高考化学一轮复习原子结构与性质作业
考点规范练35 原子结构与性质
(时间:45分钟 满分:100分)
考点规范练第70页
非选择题(共6小题,共100分)
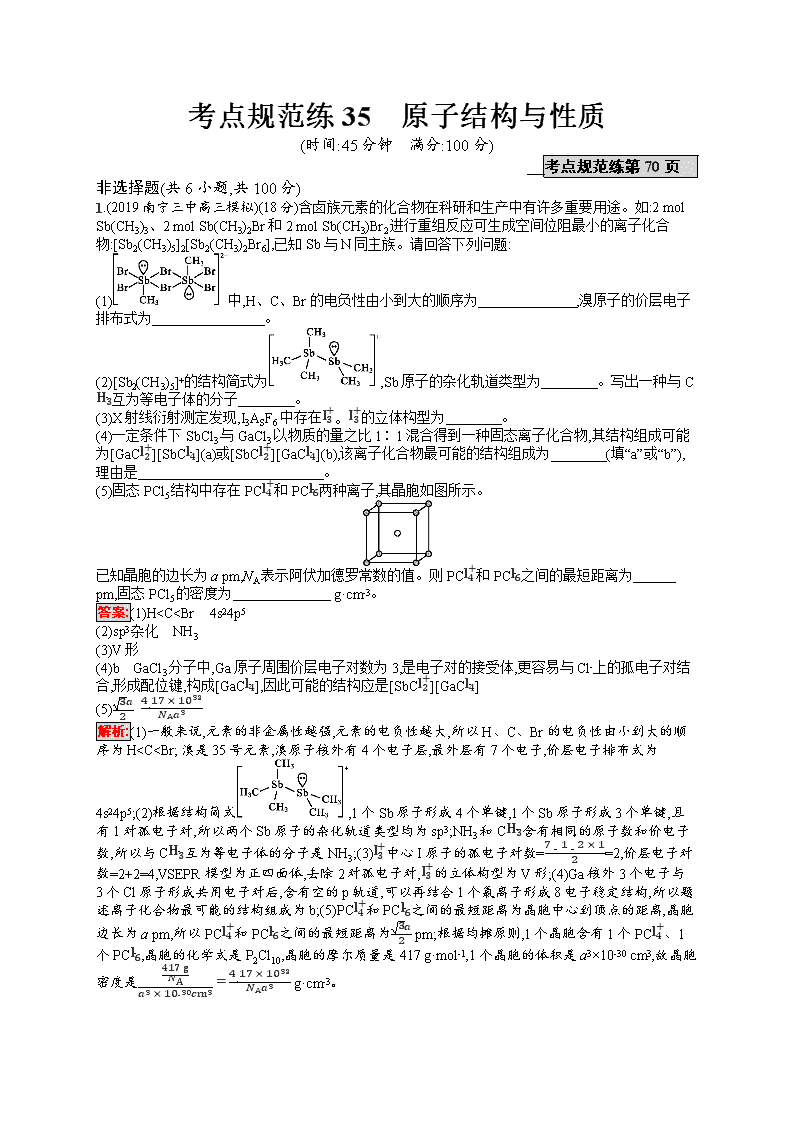
1.(2019南宁三中高三模拟)(18分)含卤族元素的化合物在科研和生产中有许多重要用途。如:2 mol Sb(CH3)3、2 mol Sb(CH3)2Br和2 mol Sb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2[Sb2(CH3)2Br6],已知Sb与N同主族。请回答下列问题:
(1)中,H、C、Br的电负性由小到大的顺序为 ,溴原子的价层电子排布式为 。
(2)[Sb2(CH3)5]+的结构简式为,Sb原子的杂化轨道类型为 。写出一种与CH3-互为等电子体的分子 。
(3)X射线衍射测定发现,I3ASF6中存在I3+。I3+的立体构型为 。
(4)一定条件下SbCl3与GaCl3以物质的量之比1∶1混合得到一种固态离子化合物,其结构组成可能为[GaCl2+][SbCl4-](a)或[SbCl2+][GaCl4-](b),该离子化合物最可能的结构组成为 (填“a”或“b”),理由是 。
(5)固态PCl5结构中存在PCl4+和PCl6-两种离子,其晶胞如图所示。
已知晶胞的边长为a pm,NA表示阿伏加德罗常数的值。则PCl4+和PCl6-之间的最短距离为 pm,固态PCl5的密度为 g·cm-3。
答案:(1)H
Si>Cu sp3
(5)12 (14,14,14) 4×144NA×(a×10-10)3
解析:(1)基态Fe原子的价电子排布式为3d64s2,其中s能级有2个电子,d能级有5个电子,根据洪特规则可知其价层电子排布图为。
(2)Al的第二电离能增幅较大的原因是:Al失去1个电子后,其3s能级上有2个电子,为全充满状态,3p和3d能级为全空状态,故较难失去电子,相对稳定。
(3)氯化铝的熔点较低且易升华,其在熔融状态下不能电离出离子,故氯化铝属于分子晶体。
(4)一般来说,非金属性越强的元素,其电负性越大,金属的电负性比非金属的小,O和Si为同主族元素,同主族元素从上至下,非金属性依次减弱,所以Cu、Si、O元素的电负性由大到小的顺序为O>Si>Cu;SiO2中每个Si原子与周围的4个O原子形成共价键,所以Si原子采用sp3杂化。
(5)由图可知,该晶胞中,溴原子位于晶胞的顶点和面心,所以与溴原子紧邻的溴原子分别位于“同层”4个,“上下溴层”各4个,总数为12个;R点位于晶胞的左下前方的八分之一立方体的体心,P点是顶点,位于坐标原点,Q点是面心,由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(14,14,14);根据均摊原则,可知该晶胞中含有4个Br、4个Cu,已知晶胞参数为a pm,NA个晶胞的体积为NA×(a×10-10 cm)3,质量为4×144 g,故其密度为4×144NA×(a×10-10)3 g·cm-3。
3.(16分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
元素
性质或结构信息
A
核外电子数和电子层数相等
B
原子的核外p电子数比s电子数少1
C
原子的第一至第四电离能如下:
I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;
I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1
D
原子核外所有p轨道全满或半满
E
主族序数与周期数的差为4
F
前4周期中电负性最小
G
位于元素周期表的第七列
(1)已知BA5为离子化合物,写出其电子式: 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为,该同学所画的电子排布图违背了 。
(4)G位于第 族,属于 区元素,该元素的核外电子排布式为 。
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其立体构型为 。
答案:(1)[H··N··H··H··H]+[··H]- (2)3 哑铃 (3)泡利原理 (4)ⅦB d 1s22s22p63s23p63d54s2 (5)sp3 三角锥形
解析:由题给信息可知元素A、B、C、D、E、F、G分别为H、N、Mg、P、Cl、K、Mn。(1)离子化合物NH5为氢化铵。(2)氮原子的基态原子能量最高的电子为p电子,p电子云有三个方向,原子轨道呈哑铃形。(3)题图中3s轨道的两个电子自旋状态相同,违背了泡利原理。(5)PCl3的中心原子P的价层电子对数为4,故为sp3杂化;因外层有一对孤电子对,故立体构型为三角锥形。
4.(16分)下图为元素周期表中部分元素的某种性质(X值)随原子序数变化的关系。
(1)短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是 (写元素符号)。
(2)同主族内不同元素的X值变化的特点是 ,同周期内,随着原子序数的增大,X值变化的总趋势是 。周期表中X值的这种变化特点体现了元素性质的 变化规律。
(3)X值较小的元素集中在元素周期表的 。
A.左下角
B.右上角
C.分界线附近
(4)下列关于元素该性质的说法中正确的是 。
A.X值可反映元素最高正化合价的变化规律
B.X值可反映原子在分子中吸引电子的能力
C.X值大小可用来衡量元素金属性和非金属性的强弱
答案:(1)O、Mg (2)同一主族,从上到下,X值逐渐减小 逐渐增大 周期性 (3)A (4)BC
解析:(1)由于p轨道最多容纳6个电子,s轨道最多容纳2个电子,因此短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素其电子排布可能为1s22s22p4或1s22s22p63s2,即分别为O和Mg。
(2)根据图示,同主族元素从上到下,X值逐渐减小,同周期元素从左到右,X值逐渐增大。
(3)X值较小的元素集中在元素周期表左下角。
(4)X值能够反映原子在分子中吸引电子的能力,能够衡量元素金属性和非金属性的强弱。
5.(15分)已知A、B、C、D、E、F六种元素,它们的原子序数依次增大。A、E是同一主族的短周期元素,A原子最外层s能级和p能级上的电子数相等,C+与B2-具有相同的电子层结构,D原子的最外层电子数等于其电子层数,且A、B、C、D、E五种元素的原子序数之和是F元素原子序数的2倍。请回答下列问题:
(1)元素E基态原子的电子排布式为 。
(2)B、C、D三种元素形成简单离子的半径由大到小的顺序是 (用离子符号表示)。
(3)F元素在元素周期表中的位置为 。
(4)B、E两种元素形成的晶体类型为 。
(5)电负性:A (填“>”或“<”, 下同)B,氢化物的稳定性:B E,第一电离能:C D,最高价氧化物对应水化物的碱性:C D。
答案:(1)1s22s22p63s23p2
(2)O2->Na+>Al3+
(3)第四周期第Ⅷ族
(4)原子晶体
(5)< > < >
解析:A、B、C、D、E、F六种元素,它们的原子序数依次增大,A、E是同一主族的短周期元素,A原子最外层s能级和p能级上的电子数相等,则A为C(碳),E为Si,C+与B2-具有相同的电子层结构,则B为O,C为Na,D原子的最外层电子数等于其电子层数,则D为Al,A、B、C、D、E五种元素的原子序数之和是F元素原子序数的2倍,则F为26号元素铁。
(1)E为Si,硅元素基态原子的电子排布式为1s22s22p63s23p2。
(2)B、C、D三种元素分别是O、Na、Al,形成的简单离子具有相同的电子层结构,质子数越大,半径越小,三种离子的半径由大到小的顺序是O2->Na+>Al3+。
(3)F元素是铁,在元素周期表中的位置是第四周期第Ⅷ族。
(4)B、E两种元素形成的物质是SiO2,晶体类型为原子晶体。
(5)同周期元素从左到右,电负性逐渐增大,则电负性:CSi,同周期元素,从左到右第一电离能呈增大趋势,非金属性逐渐增强,最高价氧化物对应的水化物的碱性逐渐减弱,则第一电离能:NaAl(OH)3。
6.(15分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
元素
性质或结构信息
A
室温下单质呈粉末状固体,加热易熔化,单质在氧气中燃烧,发出明亮的蓝紫色火焰
B
单质在常温、常压下是气体,能溶于水,原子的M层上只有1个未成对的p电子
C
单质质软、银白色固体、导电性强,单质在空气中燃烧发出黄色火焰
D
原子最外电子层上s电子数等于p电子数,单质为空间网状晶体,具有很高的熔、沸点
(1)B元素在周期表中的位置是 ,写出A原子的电子排布式: 。
(2)写出C单质与水反应的化学方程式: 。
A与C形成的化合物溶于水后,溶液的pH (填“大于”“等于”或“小于”)7。
(3)A、B两元素非金属性较强的是 (写元素符号)。写出能证明这一结论的一个实验事实: 。
(4)元素B和D形成的化合物中中心原子的杂化方式是 。
答案:(1)第三周期第ⅦA族 1s22s22p63s23p4
(2)2Na+2H2O2NaOH+H2↑ 大于
(3)Cl 高氯酸的酸性比硫酸的酸性强(或氯化氢稳定性比硫化氢稳定性强等,合理即可)
(4)sp3
解析:从“明亮的蓝紫色火焰”,再结合其他信息可知A元素是硫元素;B元素从“气体”可知是非金属元素,从M层上只有“1个未成对的p电子”知是氯元素,与气体“能溶于水”相符合。从“黄色火焰”可知C元素是钠元素,再由前面的信息进行验证。D元素原子最外层上s电子数等于p电子数,结合空间网状结构和“很高的熔、沸点”知应该是硅元素或碳元素。比较元素非金属性的强弱可从它们之间的相互置换、氢化物的稳定性、最高价氧化物的水化物的酸性强弱等方面去判断。