- 2021-08-24 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习层级题组快练5含解析
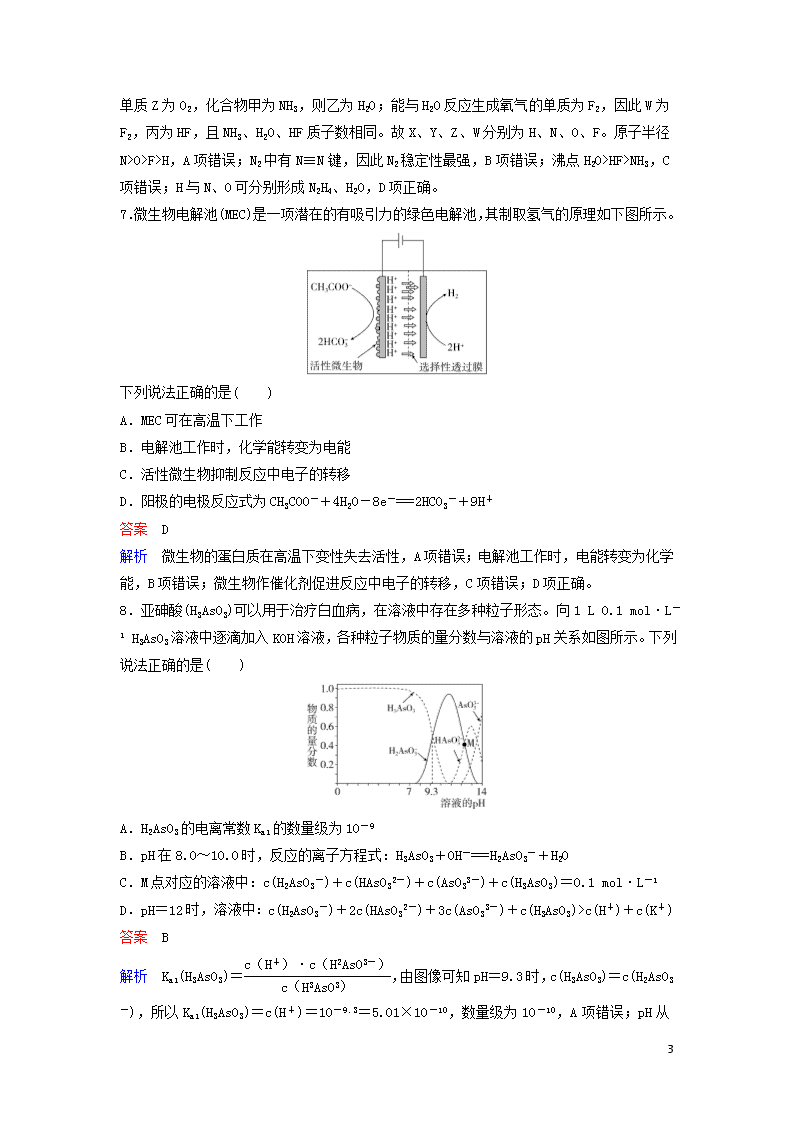
层级题组快练8+2(5) 1.下列有关有机物的叙述正确的是( ) A.毛织、丝织衣服不宜用加酶洗衣粉洗涤 B.纤维素、淀粉、油脂均为天然高分子化合物 C.糖类、油脂、蛋白质都能够水解 D.食物中的纤维素在人体内被吸收利用,是健康饮食重要的一部分 答案 A 解析 蛋白质在酶作用下发生水解,毛织、丝织衣服不宜用加酶洗衣粉洗涤,A项正确;油脂不属于高分子化合物,B项错误;糖类中的单糖不能发生水解反应,C项错误;纤维素在人体内不能被吸收利用,D项错误。 2.甲酸香叶脂(结构如右图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精。下列有关该有机物的叙述正确的是( ) A.分子式为C11H19O2 B.含有羧基和碳碳双键两种官能团 C.能发生加成反应和水解反应 D.1 mol该物质与足量Na反应生成标准状况下气体11.2 L 答案 C 解析 甲酸香叶脂的分子式为C11H18O2,A项错误;含有酯基和碳碳双键两种官能团,能发生加成反应和水解反应,B项错误,C项正确;该物质不与Na反应,D项错误。 3.下列各组物质中,物质之间通过一步反应能实现如图所示转化的是( ) 选项 A B C D X Fe Al2O3 N2 HCl Y FeCl3 Al(OH)3 NO2 NaCl Z Fe(OH)3 NaAlO2 HNO3 Cl2 答案 D 解析 Fe(OH)3无法通过一步反应生成铁,A项错误;Al2O3无法通过一步反应生成Al(OH)3,NaAlO2无法通过一步反应生成Al2O3,B项错误;N2无法通过一步反应生成NO2,C项错误;HCl与氢氧化钠反应生成NaCl,电解熔融NaCl生成氯气,氯气与钠反应生成氯化钠,氯气与氢气反应生成氯化氢,D项正确。 4.设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.1 L 1 mol·L-1 NH4NO3溶液中含N原子数为2NA B.5.6 g铁粉与硝酸反应失去电子数一定为0.3NA 7 C.pH=11的Ca(OH)2溶液中OH-数为0.002 NA D.11.2 L苯蒸气含碳碳双键的数目为0.1NA 答案 A 解析 A项正确;铁与硝酸反应生成物可能是Fe2+或Fe3+,B项错误;溶液的体积未知,无法计算离子数目,C项错误;没有标明状态,且苯中不含有碳碳双键,D项错误。 5.下列实验现象与对应结论均正确的是( ) 选项 操作 现象 结论 A 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 溶液变为黄色 氧化性:H2O2>Fe3+ B 向硅酸钠溶液中滴加盐酸 溶液变浑浊 氯的非金属性强于硅,故而盐酸能制得硅酸 C 向溴水中滴加苯 液体出现分层,上层有颜色,下层接近无色 溴在苯中的溶解度远大于水中 D 将过量过氧化钠固体投入紫色石蕊试液中 溶液变成蓝色 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 答案 C 解析 Fe(NO3)2溶液中滴入硫酸,溶液变为黄色,有可能是H+、NO3-(相当于HNO3)氧化Fe2+,A项错误;盐酸不是氯的最高价氧化物对应水化物,不能比较氯和硅的非金属性强弱,B项错误;C项正确;过量过氧化钠固体投入紫色石蕊试液中,溶液先变蓝,最终会褪色,D项错误。 6.X、Y、Z、W是短周期中原子序数依次增大的四种元素。X可以分别与Y、Z、W结合生成甲、乙、丙三种相同质子数的分子;相关物质之间的转化关系如下图所示,已知丁是无色气体,遇空气显红棕色。下列说法正确的是( ) A.原子半径:W>X>Y>Z B.单质的稳定性:X>Y>Z>W C.简单氢化物的沸点:Y>Z>W D.X与Y、Z均可形成原子个数比为2∶1的化合物 答案 D 解析 丁是无色气体,遇到空气显红棕色,丁为NO;单质Z与化合物甲反应生成NO, 7 推出单质Z为O2,化合物甲为NH3,则乙为H2O;能与H2O反应生成氧气的单质为F2,因此W为F2,丙为HF,且NH3、H2O、HF质子数相同。故X、Y、Z、W分别为H、N、O、F。原子半径N>O>F>H,A项错误;N2中有N≡N键,因此N2稳定性最强,B项错误;沸点H2O>HF>NH3,C项错误;H与N、O可分别形成N2H4、H2O,D项正确。 7.微生物电解池(MEC)是一项潜在的有吸引力的绿色电解池,其制取氢气的原理如下图所示。 下列说法正确的是( ) A.MEC可在高温下工作 B.电解池工作时,化学能转变为电能 C.活性微生物抑制反应中电子的转移 D.阳极的电极反应式为CH3COO-+4H2O-8e-===2HCO3-+9H+ 答案 D 解析 微生物的蛋白质在高温下变性失去活性,A项错误;电解池工作时,电能转变为化学能,B项错误;微生物作催化剂促进反应中电子的转移,C项错误;D项正确。 8.亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种粒子形态。向1 L 0.1 mol·L-1 H3AsO3溶液中逐滴加入KOH溶液,各种粒子物质的量分数与溶液的pH关系如图所示。下列说法正确的是( ) A.H2AsO3的电离常数Ka1的数量级为10-9 B.pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-===H2AsO3-+H2O C.M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1 mol·L-1 D.pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+) 答案 B 解析 Ka1(H3AsO3)=,由图像可知pH=9.3时,c(H3AsO3)=c(H2AsO3-),所以Ka1(H3AsO3)=c(H+)=10-9.3=5.01×10-10,数量级为10-10,A 7 项错误;pH从8.0→10.0时,H3AsO3物质的量分数减小,H2AsO3-物质的量分数增大,反应的离子方程式为H3AsO3+OH-===H2AsO3-+H2O,B项正确;M点对应溶液的体积大于1 L,由物料守恒知c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)<0.1 mol·L-1,C项错误;pH=12时,溶液中电荷守恒式为c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)+c(K+),此时溶液中c(OH-)=0.01 mol·L-1>c(H3AsO3),所以c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)查看更多
相关文章
- 当前文档收益归属上传用户