- 2021-08-24 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】天津市河东区2020届高三学业水平等级性考试模拟测试(解析版)
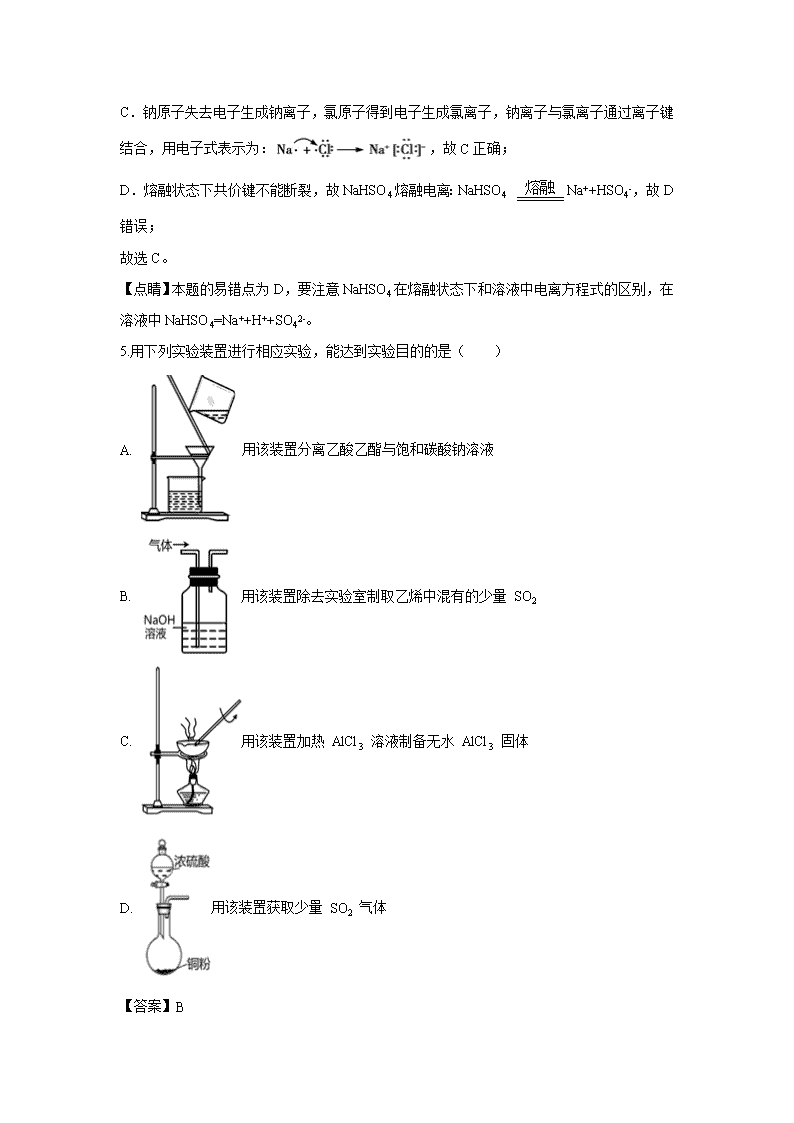
天津市河东区2020届高三学业水平等级性考试模拟测试 第Ⅰ卷(选择题,共 36 分) 本卷可能用到的相对原子质量: C:12 S:32 Na:23 O:16 H:1 Fe:56 本题包括 12 小题,每小题 3 分,共 36 分。每小题只有一个选项符合题意 1.下列对预防“新型冠状病毒肺炎”的一些认识,你认为合理的是( ) A. 制作口罩的无纺布材料聚丙烯是天然高分子材料 B. 将 84 消毒液与酒精混合使用消毒效果更佳 C. 用于消毒的医用酒精中乙醇的体积分数为 95% D. 可以直接用氯水做漂白、杀菌、消毒剂 【答案】D 【详解】A.聚丙烯为合成高分子化合物,属于合成材料,故A错误; B.84消毒液和酒精混合不但不会增加效果,反而会降低消毒效果,产生有毒气体,故B错误; C.95%酒精会使细菌细胞外面形成保护层,酒精不能完全进入细菌细胞内,达不到杀菌目的,75%的酒精杀菌效果最好,所以医用酒精中乙醇的体积分数为75%,故C错误; D.氯水中含有次氯酸,可以直接用氯水做漂白、杀菌、消毒剂,故D正确; 故选D。 【点睛】本题的易错点为B,要注意84 消毒液的主要成分为次氯酸钠,具有强氧化性,能够与酒精发生氧化还原反应生成氯气等,降低消毒效果,因此二者不能混合使用。 2.下列有关化学基本概念的依据正确的是( ) A. 溶液与胶体:本质区别是能否发生丁达尔效应 B. 纯净物与混合物:是否仅由一种物质组成 C. 强电解质与弱电解质:根据其溶液的导电能力强弱 D. 极性分子与非极性分子:根据化学键的极性判断 【答案】B 【详解】A.溶液与胶体两者的根本区别在于分散质粒子直径的大小,溶液中的分散质粒子直径小于1nm,胶体的胶粒直径在1nm~100nm,故A错误; B.纯净物:只由一种物质组成的称为纯净物。混合物:由两种或两种以上物质组成的称为混合物,所以纯净物、混合物是按照是否仅含一种物质划分的,故B正确; C.在水溶液中完全电离的化合物属于强电解质,部分电离的化合物属于弱电解质,和导电能力强弱无关,故C错误; D.分子中正负电荷的重心重合或电荷分布均匀的分子是非极性分子,正负电荷的重心不重合或电荷分布不均匀的分子是极性分子,与化学键的极性没有直接的关系,非极性分子中可能含有极性键,如CO2,极性分子中也可能含有非极性键,如H2O2,故D错误; 故选B。 3.下列反应需要破坏共价键的是( ) A. 晶体硅熔化 B. 碘升华 C. 冰融化成水 D. NaCl 溶于水 【答案】A 【详解】A.晶体硅是原子晶体,熔化时破坏的是共价键,故A正确; B.碘是分子晶体,升华时克服的是分子间作用力,共价键没有破坏,故B错误; C.冰是分子晶体,融化成水时克服的是分子间作用以及氢键,共价键没有被破坏,故C错误; D.氯化钠是离子晶体,溶于水时,破坏的是离子键,故D错误; 故选A。 4.下列化学用语对事实的表述正确的是( ) A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OHC17H35COOC2H5+H218O B. 向 Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32- C. 由 Na 和 C1 形成离子键的过程: D. NaHSO4熔融电离:NaHSO4Na++H++SO42- 【答案】C 【详解】A.酯化反应的机理是“酸断羟基醇断氢”,硬脂酸与乙醇的酯化反应的化学方程式为:C17H35COOH+C2H518OH C17H35CO18OC2H5+H2O,故A错误; B.向Na2SiO3溶液中通入过量SO2,反应生成硅酸和亚硫酸氢钠,反应的离子方程式为:SiO32-+2SO2+2H2O=H2SiO3↓+2HSO3-,故B错误; C.钠原子失去电子生成钠离子,氯原子得到电子生成氯离子,钠离子与氯离子通过离子键结合,用电子式表示为:,故C正确; D.熔融状态下共价键不能断裂,故NaHSO4熔融电离:NaHSO4 Na++HSO4-,故D错误; 故选C。 【点睛】本题的易错点为D,要注意NaHSO4在熔融状态下和溶液中电离方程式的区别,在溶液中NaHSO4=Na++H++SO42-。 5.用下列实验装置进行相应实验,能达到实验目的的是( ) A. 用该装置分离乙酸乙酯与饱和碳酸钠溶液 B. 用该装置除去实验室制取乙烯中混有的少量 SO2 C. 用该装置加热 AlCl3 溶液制备无水 AlCl3 固体 D. 用该装置获取少量 SO2 气体 【答案】B 【详解】A.乙酸乙酯与饱和碳酸钠溶液分层,不能选过滤分离,应选分液分离,故A错误; B.二氧化硫与NaOH能够反应被吸收,乙烯不能,导管长进短出,洗气可分离,故B正确; C.加热 AlCl3溶液,促进水解,生成的盐酸易挥发,加热蒸干得不到无水 AlCl3 固体,应在HCl气流中加热制备无水 AlCl3固体,故C错误; D.Cu与浓硫酸的反应需要加热,图中缺少加热装置,故D错误; 故选B。 6.已知有机物 M 在一定条件下可转化为N。下列说法正确的是( ) A. 该反应类型为取代反应 B. N 分子中所有碳原子共平面 C. M 中苯环上的一氯代物共有 4 种 D. 可用溴水鉴别 M 和 N 【答案】D 【详解】A.M中碳碳双键和氢气发生加成反应生成N,该反应为加成反应,故A错误; B.N分子中取代基上的3个碳原子都采用sp3杂化,具有甲烷的结构特点,则N中所有碳原子不可能共平面,故B错误; C.M中苯环上有三种氢原子,所以M苯环上一氯代物有3种,故C错误; D.M和溴水发生加成反应、N和溴水不反应,前者能使溴水褪色,后者发生萃取,振荡静置后分层,且上层有色,现象不同,可以鉴别,故D正确; 故选D。 【点睛】本题的易错点为B,要注意甲烷是四面体结构,有机物分子中只要含有饱和碳原子(包括:-CH3、-CH2-、、)中的一种,分子中的所有原子就不可能处于同一平面内。 7.下列说法正确的是( ) A. 同一原子中,在离核较远的区域运动的电子能量较高 B. 原子核外电子排布,先排满K层再排L层,先排满M层再排N层 C. 同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大 D. 同一周期中,Ⅱ A与Ⅲ A族元素原子的核电荷数都相差1 【答案】A 【详解】A.电子能量越低,挣脱原子核束缚的能力弱,在距离原子核近的区域运动;电子能量高,挣脱原子核束缚的能力强,在距离原子核远的区域运动,故A正确; B. M能层中d能级的能量高于N能层中s能级能量,填充完4s能级后才能填充3d能级,故B错误; C.同一周期中,主族元素随着核电荷数的增加,元素的原子半径逐渐减小,故C错误; D.第四周期中,Ⅱ A与Ⅲ A族元素原子的核电荷数相差11,故D错误; 故答案为A。 【点睛】本题考查元素周期表的结构及应用,把握元素在周期表的位置、元素的性质及元素周期律为解答的关键,注意整体把握周期表的结构。 8.X、Y、Z、W 均为常见短周期非金属元素,常温下,其最简单氢化物水溶液(浓度均为0.01 mol/L)的 pH 和原子半径的关系如图所示。其中 X 为氧元素。下列有关说法正确的是( ) A. Y 是钠元素 B. 图中 Y 的氢化物不能与X 的氢化物反应 C. Z 的最高价氧化物对应水化物的化学式为 HClO4 D. W 的最高价氧化物对应水化物是弱酸 【答案】C 【分析】X、Y、Z、W均为常见的短周期非金属元素,X 为氧元素,由常温下,其最简单氢化物水溶液(浓度均为 0.01mol/L)的pH、原子半径可知,Y对应最简单氢化物水溶液的pH>7,且原子半径大于O,则Y为N;Z的原子半径大于N,Z的最简单氢化物水溶液的pH=2,为一元强酸,则Z为Cl;W的原子半径最大,且0.01mol/L W的最简单氢化物水溶液的2<pH<7,可知W为S,据此分析解答。 【详解】由上述分析可知,X为O、Y为N、Z为Cl、W为S。 A.根据上述分析,Y为N元素,故A错误; B.Y 的氢化物为氨气,X 的氢化物为水,二者能够反应生成NH3·H2O,故B错误; C.Z为Cl,最高价为+7价,最高价氧化物对应水化物的化学式为HClO4,故C正确; D.W 为S元素,最高价氧化物对应水化物为硫酸,是强酸,故D错误; 故选C。 9.由下述实验现象,下列氯水对应结论不正确的是( ) 实验 装置 试剂 A 现象 ① 紫色石蕊溶液 先变红后褪色 ② 滴有 KSCN 的 FeCl2 溶液 溶液变红 ③ NaHCO3 溶液 产生使澄清石灰水变浑浊的气体 ④ HNO3 酸化的 AgNO3 溶液 产生白色沉淀 A. ①氯水具有酸性和漂白性 B. ②氯水具有还原性 C. ③氯水中含有 H+ D. ④氯水中含有 Cl- 【答案】B 【详解】A.向紫色石蕊溶液中滴加氯水,溶液变红,说明氯水显酸性,然后褪色,说明氯水具有漂白性,能说明氯水具有酸性和漂白性,故A正确; B.将氯水滴加到含KSCN 的 FeCl2 溶液,溶液变红,说明氯水能够将亚铁离子氧化为铁离子,说明氯水具有氧化性,不能说明氯水具有还原性,故B错误; C.氯水能与碳酸氢钠反应产生能使澄清石灰水变浑浊的气体二氧化碳,说明氯水显酸性,能说明氯水中含有 H+,故C正确; D.氯水与HNO3 酸化的硝酸银反应产生白色沉淀,该白色沉淀是氯离子与银离子反应得到AgCl,说明氯水中含有Cl-,故D正确; 故选B。 【点睛】解答本题的关键是知道氯水中含有的微粒和微粒的性质,氯水溶液中存在平衡Cl2+H2O⇌HCl+HClO,盐酸为强酸,次氯酸为弱酸,溶液中含有H+、Cl-、氯气、HClO等。 10.如图所示电池是一种新型储氢材料—镍电池(MHn—Ni),(MHn中金属和氢都为 0 价)。下列有关说法不正确的是( ) A. 放电时正极反应为 NiOOH+H2O+e-→Ni(OH)2+OH- B. 电池的电解液可为KOH 溶液 C. 充电时阴极反应为 MHn+nOH--e-→nH2O+M D. MHn 是一类储氢材料,n 越大,电池的比能量越高 【答案】C 【分析】根据图示,镍电池(MHn—Ni)中应该选碱性溶液作电解质溶液,放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MHn+nOH--ne-=M+nH2O,总反应:MHn+nNiOOH=M+nNi(OH)2 ,充电时,阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O,阴极反应:M+nH2O+ne-=MHn+nOH-,总反应:M+nNi(OH)2=MHn+nNiOOH;据此分析解答。 【详解】A.放电时,正极发生还原反应:NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确; B.为了防止MHn被氢离子氧化,镍电池中电解液应该为碱性溶液,可以用KOH作电解液,故B正确; C.充电时,电池的负极作阴极,阴极发生还原反应:M+nH2O+ne-=MHn+nOH-,故C错误; D.M为储氢合金,MHn为吸附了氢原子的储氢材料,其氢密度越大,电池的能量密度越高,故D正确; 故选C。 11.一定温度下,下列溶液的离子浓度关系式正确的是( ) A. 稀释氨水溶液 10 倍后,其 c(OH-)为原来的 B. pH 之和为 14 的 H2C2O4与 NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+ c(HC2O4-) C. pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol/L D. 将等物质的量的Na2CO3 和 NaHCO3 混合溶于水中<1 【答案】D 【详解】A.一水合氨在稀释过程中继续电离生成OH-,所以稀释氨水溶液10倍后,其c(OH-)大于原来的,故A错误; B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),所以c(Na+)+c(H+)>c(OH-)+c(HC2O4-),故B错误; C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),所以c(H+)>c(HS-),故C错误; D.Na2CO3的水解程度大于NaHCO3,导致溶液中c(HCO3-)>c(CO32-),则<1,故D正确; 故选D。 12.《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(过硫酸根离子如图所示)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( ) A. 室温下,中间产物 Fe(OH)3 溶于水所得饱和溶液中 c(Fe3+)为2.7×10-18 mol·L-1 B. 若 56g Fe 参加反应,共有 NA 个 S2O82- 被还原 C. 1mol 过硫酸钠(Na2S2O8)含 2NA 个过氧键 D. pH 越小,越有利于去除废水中的正五价砷 【答案】A 【详解】A.已知Ksp[Fe(OH)3]=2.7×10-39,此溶液碱性极弱,溶液的pH接近7,即c(OH-)=10-7mol/L,代入方程即可解得:c(Fe3+)=2.7×10-18mol•L-1,故A正确; B.56g Fe为1mol,根据图示,一个S2O82-和一个Fe反应生成两个SO42-和一个Fe2+,该过程转移2个电子,但Fe2+还要与S2O82-反应变成Fe3+和自由基(SO4-●),因此1mol铁参加反应要消耗1.5molS2O82-,共有1.5NA个S2O82-被还原,故B错误; C.根据Na2S2O8的结构,1mol过硫酸钠(Na2S2O8)含1mol过氧键,即含有NA个过氧键,故C错误; D.根据图示,最后是将铁离子和亚铁离子转变为沉淀,与正五价砷共沉淀析出,则溶液的碱性越强,越有利于沉淀析出,即pH越大,越有利于去除废水中的正五价砷,故D错误; 故选A。 【点睛】本题的易错点和难点为B,要注意观察图示,反应过程中Fe先与S2O82-反应生成SO42-和Fe2+,然后Fe2+再与S2O82-反应变成Fe3+和自由基(SO4-●),结合氧化还原反应中得失电子守恒计算判断。 第Ⅱ卷(非选择题,共 64 分) 本卷可能用到的相对原子质量: C:12 S:32 Na:23 O:16 H:1 Fe:56 13.C、H、O、N 是构成生命的基本元素,是中学化学研究的重要内容之一。 (1)对碳原子核外两个未成对电子的描述,正确的是_____ A 电子云形状不同 B. 自旋方向相同 C. 能量不同 D. 在同一轨道 (2)C、O、N 三种元素第一电离能由大到小的顺序是______________ (3)HCHO 分子中碳原子轨道的杂化类型是________,福尔马林(HCHO 的水溶液),HCHO 极易与水互溶的主要原因是____________________________________________ (4)在有机银镜反应实验中其中一种反应物是配合物,写出此配合物离子的结构简式_____,提供孤电子对的成键原子是________。 (5)如图是金刚石晶胞,每个碳原子的配位数是_____;每个晶胞中含有的碳原子个数是_____;若晶胞的边长是anm,该晶胞中两个碳原子之间的最短距离为_____nm。 【答案】 (1). B (2). N>O>C (3). sp2 (4). HCHO与水分子间存在氢键 (5). [Ag(NH3)2]+ (6). N (7). 4 (8). 8 (9). a 【分析】(1)碳原子的电子排布式为1s22s22p2,结合核外电子的排布规律分析判断; (2)C、O、N都是第二周期非金属元素,同一周期元素,自左而右,第一电离能呈增大趋势,结合N元素原子2p能级是半满状态分析排序; (3)根据甲醛中的成键来分析碳原子的杂化类型,结合氢键对物质性质的影响分析解答; (4)银镜反应实验中的反应物属于配合物的是Ag(NH3)2OH,据此分析解答; (5)根据金刚石的晶胞结构结合均摊法计算晶胞中含有的碳原子数;晶胞中两个碳原子之间的最短距离为晶胞体对角线的,据此计算。 【详解】(1)A、碳原子核外两个未成对电子,都属于2p能级,p能级沿x、y、z轴的方向电子云密度大,呈现哑铃型,则电子云形状相同,故A错误;B、p能级又分x、y、z三个相互垂直的轨道,电子优先占据不同轨道,并且自旋方向相同,所以碳原子核外两个未成对电子,自旋方向相同,故B正确;C、碳原子核外两个未成对电子,都属于2p能级,能量相同,故C错误; D、p能级又分x、y、z三个相互垂直的轨道,电子优先占据不同轨道,所以碳原子核外两个未成对电子,不在同一轨道,故D错误;故答案为:B。 (2)C、O、N都是第二周期非金属元素,同一周期元素,自左而右,第一电离能呈增大趋势,但N元素原子2p能级是半满的稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:N>O>C; (3)甲醛分子中含有碳氧双键,1个甲醛分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化;福尔马林是HCHO的水溶液,HCHO与水分子间存在氢键使得HCHO极易与水互溶,故答案为:sp2;HCHO与水分子间存在氢键; (4)有机物的银镜反应实验中的反应物属于配合物的是Ag(NH3)2OH,配合物离子的结构简式为[Ag(NH3)2]+,NH3为配体,N原子中含有孤电子对,因此提供孤电子对的成键原子是N,故答案为:[Ag(NH3)2]+;N; (5)根据图示,在金刚石晶胞中,每个碳原子周围有4个碳原子,碳原子的配位数是4;每个晶胞中含有的碳原子个数是8×+6×+4=8;晶胞中两个碳原子之间的最短距离为晶胞体对角线的,因此最短距离为anm,故答案为:4;8;a。 14.“阿比朵尔”是抗击新型冠状病毒潜在用药,其合成路线如图: 回答下列问题: (1)有机物 A 含氧官能团名称___________; (2)反应②、⑥反应类型分别是___________、___________; (3)F 的分子式为___________; (4)请写出反应③的化学反应方程式_________________________________________; (5)M 是 B 的一种同分异构体,满足下列条件的同分异构体有_____种;其中核磁共振氢谱有 4 组峰,峰面积之比为 2:2:2:1 的结构简式________; ①苯环上有 3 个取代基; ②能发生银镜反应; ③能发生水解反应,且 1 mol M 水解消耗4mol NaOH (6)设计由甲苯和丙酮()为原料制备合成路线______________________________________________________________。 【答案】(1). 羟基和硝基 (2). 还原反应 (3). 取代反应 (4). C14H15O4N (5). ++H2O (6). 6 (7). 或 (8). 【分析】(1)根据常见官能团的结构和名称分析判断A 的含氧官能团; (2)根据流程图,反应②中B中硝基生成C后变成了氨基,反应⑥中G变成H后有2个H原子被溴原子代替,结合反应的特征分析判断反应类型; (3)根据F 的结构简式判断F的分子式; (4)根据流程图,反应③为C在InBr3条件下与D生成E,C中氨基与D中羰基发生了脱水反应,据此书写反应的化学方程式; (5)①苯环上有 3 个取代基;②能发生银镜反应,说明结构中含有醛基;③能发生水解反应,说明属于甲酸酯类物质, 1 mol M 水解消耗4mol NaOH,说明结构中含有2个酯基,且水解生成的羟基为酚羟基,还含有1个-NH2,据此分析解答; (6)根据题干流程图中C→E的反应可知,由甲苯和丙酮为原料制备合成,需要有对氨基甲苯,因此需要先合成对硝基甲苯,据此分析解答。 【详解】(1)有机物 A ()的含氧官能团有羟基和硝基,故答案为:羟基和硝基; (2)根据流程图,反应②中B()中硝基生成C()后变成了氨基,为还原反应,反应⑥中G()变成H()后有2个H原子被溴原子代替,为取代反应,故答案为:还原反应;取代反应; (3)F ()的分子式为C14H15O4N,故答案为:C14H15O4N; (4)根据流程图,C()在InBr3条件下与D()生成E(),C中氨基与D中羰基发生了脱水反应,因此反应③的化学方程式为++H2O,故答案为:++H2O; (5)M 是 B ()的一种同分异构体,①苯环上有 3 个取代基;②能发生银镜反应,说明结构中含有醛基;③能发生水解反应,且 1 mol M 水解消耗4mol NaOH,说明结构中含有2个甲酸形成的酯基,且水解生成的羟基为酚羟基,即满足条件的M的同分异构体的苯环上的3个取代基:2个HCOO-、1个-NH2,有6种;其中核磁共振氢谱有 4 组峰,峰面积之比为 2:2:2:1 的结构简式为或,故答案为:6;或; (6)根据题干流程图中C→E的反应可知,由甲苯和丙酮()为原料制备合成,需要有对氨基甲苯和丙酮,因此需要先合成对硝基甲苯,因此合成路线为,故答案为:。 【点睛】本题的易错点为(5),明确苯环上含有的侧链是解题的关键,要注意能够水解且能够发生银镜反应,结合B的分子式,符合条件的是甲酸酯类物质,而且该酯基水解生成的羟基为酚羟基。 15.利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图: 回答下列问题: (1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____________________________; (2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_________________; (3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____________________________;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol; (4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行; 重铬酸钠的溶解度表: 温度℃ 10 20 40 60 80 100 溶解度% 61.6 62.8 65.1 71.8 78.7 81.1 (5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作; (6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_________________(写一种即可)。 【答案】(1). 2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2 (2). 水浴加热 (3). 负极 (4). 4OH-―4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+ (5). 4 (6). 冷却结晶(降低温度) (7). 重结晶 (8). 乙醛(CH3CHO)、乙酸(CH3COOH)、二氧化碳(CO2)等 【分析】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠。将铬铁矿和碳酸钠、空气混合焙烧,发生反应得到Na2CrO4、NaAlO2、Na2SiO3等和CO2,然后在60℃时调节溶液pH=6.5,用盐酸浸取后过滤,得到的滤渣中主要含有硅酸、氢氧化铁、氢氧化铝等,滤液中含有Na2CrO4和NaCl,然后用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,在Na2Cr2O7溶液中加入氯化钾固体可以制得K2Cr2O7,在Na2Cr2O7溶液中加入稀硫酸和乙醇,可以制得Na Cr(SO4)2,据此分析解答。 【详解】(1)Cr2O3 与碳酸钠在空气中焙烧反应生成Na2CrO4 的化学反应方程式为2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2; (2)可以采用水浴加热的方法,控制反应温度 60℃,故答案为:水浴加热; (3)Na2CrO4 溶液中存在2CrO42-+2H+⇌Cr2O72-+H2O,用图示装置(均为石墨电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极(电极Ⅱ)是阳极,连接电源的正极,即b为正极,则a为负极;电极Ⅱ为阳极,溶液中氢氧根离子失电子生成氧气,电极反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+;由CrO42-+2H +=Cr2O72-+H2O可知,每生成2molNa2Cr2O7时,理论上II电极生成4molH+,根据阳极反应式4OH--4e-=2H2O+O2↑可知,每生成4molH+,转移4mol电子,故答案为:负极;4OH-―4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+;4; (4) 根据溶解度曲线和重铬酸钠的溶解度表可知,K2Cr2O7的溶解度随温度的变化较大,而Na2Cr2O7的溶解度受温度的影响不大,且温度较低是由水中的溶解度:Na2Cr2O7>K2Cr2O7,因此流程③中向Na2Cr2O7溶液中加入适量KCl,充分加热,蒸发浓缩至表面出现晶膜,然后冷却结晶,析出K2Cr2O7固体,反应才能顺利进行,故答案为:冷却结晶(降低温度); (5) 根据溶解度曲线,K2Cr2O7的溶解度随温度的变化较大,而氯化钠的溶解度受温度的影响不大,为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,需要对K2Cr2O7 晶体进行重结晶操作,进一步分离提纯,故答案为:重结晶; (6) Na2Cr2O7 溶液具有强氧化性,Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为乙醛(CH3CHO)、乙酸(CH3COOH)、甚至可以氧化生成二氧化碳和水,故答案为:乙醛(CH3CHO)、乙酸(CH3COOH)、二氧化碳(CO2)等。 16.亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g)。 (1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示); (2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O) 化学键 N≡O Cl-Cl Cl-N N==O 键能/(kJ·mol-1) 630 243 a 607 则2NO(g)+Cl2(g)2ClNO(g)的反应的 △H和a的关系为 △H = _____kJ·mol-1。 (3)300℃时,2NO(g)+Cl2 (g)2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表: 序号 c(ClNO)/(mol·L-1) v/(mol·L-1·s-l) ① 0. 30 3. 60×10-9 ② 0. 60 1. 44×10-8 ③ 0. 90 3. 24×10-8 n = _____;k = ______。 (4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)2ClNO(g),能判断反应已达到化学平衡状态的是____(填标号)。 a.容器中压强不变 b.2v正(NO) = v逆(Cl2) c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变 (5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)2ClNO(g)△H。 ①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是__________________。 图甲 ②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。 【答案】(1). K3= (2). 289-2a (3). 2 (4). 4. 0×10-8 L·mol-1·s-1 (5). acd (6). < (7). 加入催化剂 (8). 乙 (9). 2 【分析】(1)利用方程式叠加关系得到平衡常数之间的关系; (2)利用键能计算焓变,反应物的键能之和减去生成物的键能之和就是焓变; (3)将表中数据带入速率方程即可求得n和k; (4)平衡状态的判定; (5)列三段式计算平衡常数,进而去计算。 【详解】(1)①② 将①×2−②可得: ,则平衡常数, 故答案为:; (2)反应的△H=反应物的键能之和−生成物的键能之和, 故答案为:289-2a; (3)根据表格①②中的数据,带入速率公式然后做比值: ,解得n=2,将n代入①中得k=4×10−8, 故答案为:2;4. 0×10-8 L·mol-1·s-1; (4)a.对于反应,反应前后气体系数变化,故压强是变量,故当压强不再变化说明反应已经平衡,a正确; b. 2v正(NO) = v逆(Cl2),正逆反应速率不相等,反应未达到平衡状态,b错误; c. 气体的平均相对分子质量即平均摩尔质量等于总质量比总物质的量,总质量虽然不变,但是总物质的量会改变,故平均相对分子质量是变量,当它不再变化则说明反应已经达到平衡状态,c正确; d. 绝热容器中,温度会改变,温度改变平衡常数就会改变,当平衡常数不再变化则说明反应已经达到平衡状态,d正确; e.和的体积比始终是2:1,不是变量,故不能说明达到平衡状态,e错误; 答案选acd; (5)①由图甲分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随反应进行温度升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变为△H<0;由图甲知:化学反应速率加快,平衡不动,故改变的条件:加入催化剂; 答案为:<;加入催化剂; ②T升高,平衡左移,K减小,lgK减小,曲线选乙,设反应的氯气物质的量为x, 根据压强之比等于物质的量之比,得到: ,解得:x=0.02mol,依据计算得到平衡时物质的浓度代入x求得:;; ; 平衡常数: ,lgK=lg100=2,m=2; 故答案为:乙;2。 【点睛】化学平衡状态的判定方法:1、;2、当变量不再变化,如体系中气体总物质的量在反应中会发生变化,则气体的总物质的量就是变量,当气体的总物质的量不再变化,则说明反应已经达到平衡状态。查看更多