- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省南昌市新建县第一中学2020届高三上学期第一次月考化学试卷
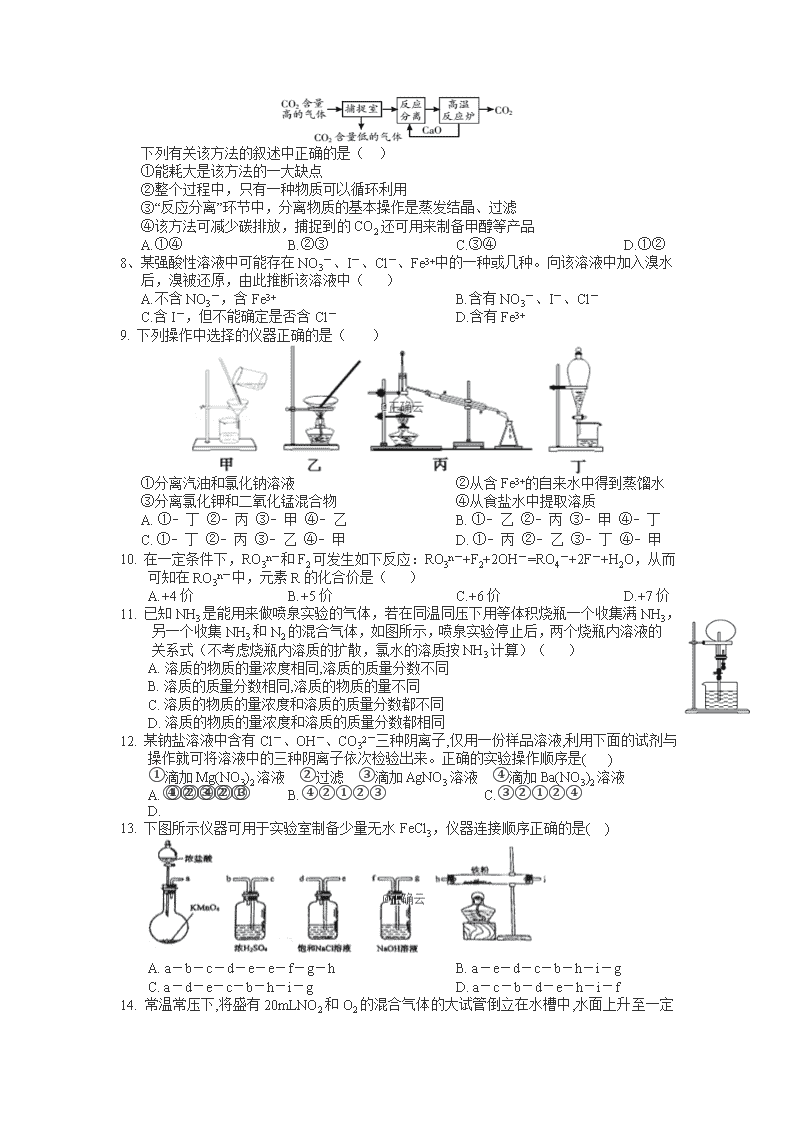
高三共建化学试卷 总分值:100分 时间:100分钟 温馨提示:此次考试卷面分为5分 说明:1. 书写整齐无大面积涂改且主观题基本完成的得5分 2. 书写有涂改或主观题未完成的,根据情况扣(1—5) 分 相对原子质量:H-1 C-12 N-14 O-16 Ag-24 Al-27 Fe-56 Cu-64 Ba-137 一、选择题(每题3分,16小题,共48分) 1、下列关于阿伏伽德罗常数NA的说法正确的是( ) A. 标况下11.2LHCl气体溶于0.5L水中,所得溶液中含Cl- 数为NA B. NA个Fe(OH)3胶体粒子的质量为107g C. 电解精炼铜时转移了NA 个电子,阳极溶解了32g铜 D. 20gD2O和H218O中含有的质子数为10NA 2、下列实验操作中,正确的是( ) A. 为检验RX是碘代烷,将RX于NaOH水溶液混合加热后再加入AgNO3溶液 B. 检验溶液中是否含有SO42-,想溶液中加入盐酸酸化后的BaCl2溶液,产生白色沉淀,则证明溶液中有SO42- C. 为检验Fe(NO)3样品是否变质,取少量样品溶于稀硫酸,滴入KSCN溶液,溶液变红,证明样品已变质 D. 用酸性高锰酸钾溶液可以除去CO2中混有的SO2 3、下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( ) 物质(括号内为杂质) 除杂试剂 A FeCl2溶液(FeCl3) Fe粉 B NaCl溶液(MgCl2) NaOH溶液、稀HCl C Cl2(HCl) H2O、浓H2SO4 D NO(NO2) H2O、无水CaCl2 4、能正确表示下列反应的离子方程式的是( ) A. NH4HSO3溶于少量的NaOH溶液中:HSO3-+OH-═SO32-+H2O B. 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- C. 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ D. 在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O 5、聚合硫酸铁[Fe(OH)SO4]n能用做净水剂(絮凝剂),可由绿矾(FeSO4•7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( ) A. KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗molKClO3 B. 生成聚合硫酸铁后,水溶液的PH增大 C. 聚合硫酸铁可在水溶液中雄城氢氧化铁胶体而净水 D. 在反应中氧化剂和还原剂物质的量之比为1:6 6、镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示,下列判断不合理的是( ) A. Al、Ga 均处于ⅢA 族 B. Ga2O3 可与盐酸反应生成GaCl3 C. Ga(OH)3可与NaOH 反应生成NaGaO2 D. 碱性:Al(OH)3>Ga(OH)3 7、“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。 下列有关该方法的叙述中正确的是( ) ①能耗大是该方法的一大缺点 ②整个过程中,只有一种物质可以循环利用 ③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 ④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 A.①④ B.②③ C.③④ D.①② 8、某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,溴被还原,由此推断该溶液中( ) A.不含NO3-,含Fe3+ B.含有NO3-、I-、Cl- C.含I-,但不能确定是否含Cl- D.含有Fe3+ 9. 下列操作中选择的仪器正确的是( ) ①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水 ③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质 A. ①﹣丁 ②﹣丙 ③﹣甲 ④﹣乙 B. ①﹣乙 ②﹣丙 ③﹣甲 ④﹣丁 C. ①﹣丁 ②﹣丙 ③﹣乙 ④﹣甲 D. ①﹣丙 ②﹣乙 ③﹣丁 ④﹣甲 10. 在一定条件下,RO3n-和F2可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是( ) A.+4价 B.+5价 C.+6价 D.+7价 11. 已知NH3是能用来做喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集NH3和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系式(不考虑烧瓶内溶质的扩散,氯水的溶质按NH3计算)( ) A. 溶质的物质的量浓度相同,溶质的质量分数不同 B. 溶质的质量分数相同,溶质的物质的量不同 C. 溶质的物质的量浓度和溶质的质量分数都不同 D. 溶质的物质的量浓度和溶质的质量分数都相同 12. 某钠盐溶液中含有Cl-、OH-、CO32-三种阴离子,仅用一份样品溶液,利用下面的试剂与操作就可将溶液中的三种阴离子依次检验出来。正确的实验操作顺序是( ) ①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液 A. ①②④②③ B.④②①②③ C.③②①②④ D.④②③②① 13. 下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( ) A. a-b-c-d-e-e-f-g-h B. a-e-d-c-b-h-i-g C. a-d-e-c-b-h-i-g D. a-c-b-d-e-h-i-f 14. 常温常压下,将盛有20mLNO2和O2 的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( ) A. 17.8 mL B. 14.8 mL C. 12.6 mL D. 12.4 mL 15. 在密闭容器中充入CO2、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg;则CO2与CH4的体积比为( ) A. 3:1 B. 2:1 C. 1:1 D. 任意比 16. 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( ) A. 该合金中铜与镁的物质的量之比是2:1 B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L C. NO2和N2O4的混合气体中,NO2的体积分数是80% D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL 二、填空题(共5小题,除标注外,每空2分,共52分) 17.(8分)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3—六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题: (1)试管A的溶液中所含的上述离子有_______________________ (2)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是________(填化学式)。 (3)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为__________________(要求标注出离子种类)。 (4)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为 18.(10分) (1)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO、Cl-、H2O。 ①湿法制备高铁酸钾反应体系中的氧化剂为:__________________(填化学符号) ②写出并配平湿法制高铁酸钾反应的离子方程式____________________________。 (2)工业上从海水中提取单质溴可采用如下方法: ①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为:___________________。 ②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为______。 ③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为:__________________。 19.(9分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。 (1)酸浸时反应的化学方程式为_________________________________。 (2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为: Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是_______________(用离子方程式表示)。 (3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是_______________; 与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。 20.(10分)硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。 (1)B装置的作用是________________________________。 (2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______气体产生,写出D中发生反应的离子方程式____________________。 (3)A中固体分解后产生NH3,写出其两种用途______________________。 (4)用实验的方法验证C溶液含有NH4+: ______________________。 21.(共10分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究: 查得资料: 该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。 I. 摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。 (1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是___________________________________________________。 (2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________________________________________________________。 II. 牙膏样品中碳酸钙的定量测定 利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。 依据实验过程回答下列问题: (3)D装置的作用是__________________________________________________。 (4)下列各项措施中,不能提高测定准确度的是________(填标号)。 ①在加入盐酸之前,应排净装置内的CO2气体 ②滴加盐酸不宜过快 ③在A-B之间增添盛有浓H2SO4的洗气装置 ④在B-C之间增添盛有饱和NaHCO3溶液的洗气装置 (5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____________。查看更多