- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省厦门市2020届高三毕业班第一次质量检查(4月)化学试题(全国I卷)
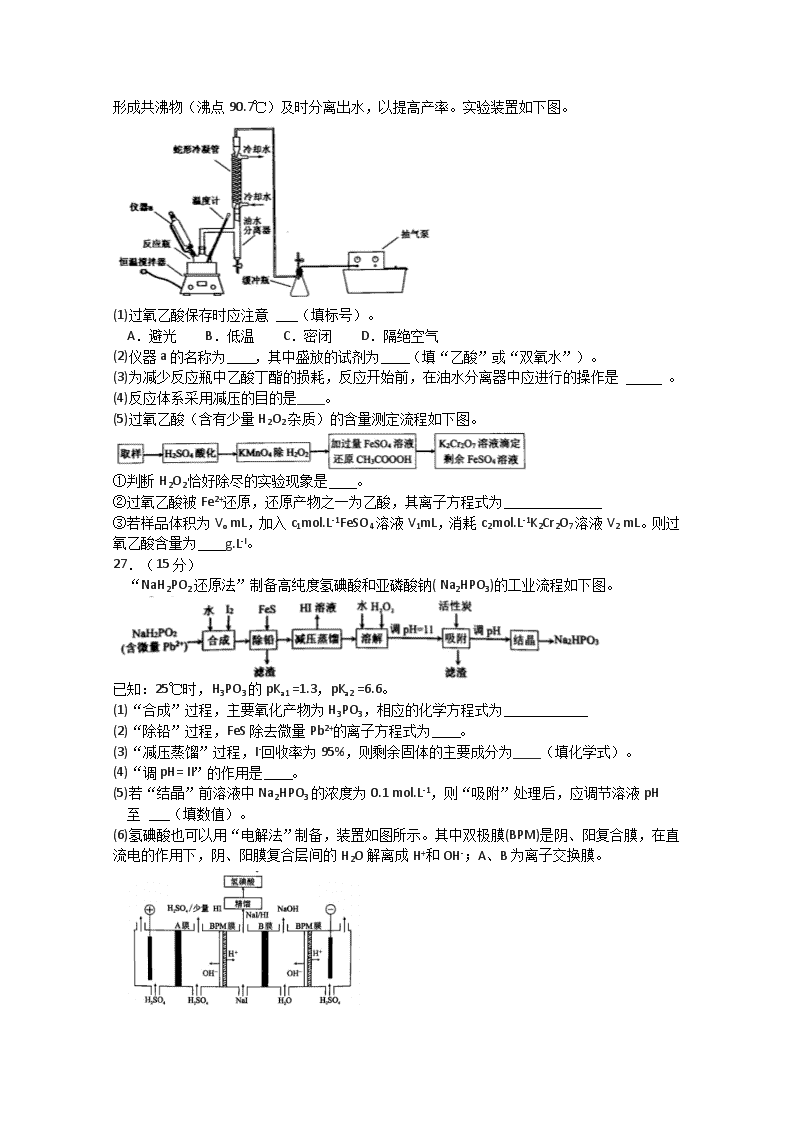
厦门市2020届高中毕业班第一次质量检查 理科综合能力测试化学 可能用到的相对原子质量:H-I C-12 N-14 O-16 第I卷(选择题共42分) 一、选择题:(本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项符合题目要求) 7.下列有关酒精说法错误的是 A.医用消毒酒精中乙醇的体积分数为75% B.向空气中喷洒大量酒精进行消毒,存在安全隐患 C.工业酒精因含甲醇故不能勾兑直接饮用 D.酒精与84消毒液混合,可增强消毒效果 8.科学家合成的一种纳米小人结构如右下图。下列关于该化合物的说法正确的是 A.易溶于水 B.1 mol该物质最多可与16 mol H2发生加成反应 C.一氯代物有10种(不考虑空间异构) D.所有原子处于同一平面 9.我国科学家首次抓住“兔耳朵”解密催化反应“黑匣子”。图a是TiO2结构图,图b是TiO2吸附H2O后形成“兔耳朵”的结构图,图c是图b的俯视图。下列叙述错误的是 A.由图a可知,每隔4个Ti原子会有一列凸起 B.由图b可知,凸起位置上的Ti原子是反应的活性位点 C.由图c可知,水分子和羟基之间靠共价键结合 D.将CO引人体系,通过观察凸起结构变化,证实水煤气变换催化反应的发生 10.下列实验方案设计中,无法达到实验目的的是 11.科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是 A.Q的氧化物对应水化物为强酸B.阴离子中所有原子均满足8电子稳定结构 C.元素非金属性的顺序为Z>Y>XD.W和X形成的化合物溶于水呈碱性 12.我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如下图所示。下列叙述错 误的是 A.丙区发生的电极反应为 B.丁区在催化剂表面发生电化学反应生成和H2 C.理论上甲区每生成1 mol S时通过质子交换膜的H+为2 mol D.该装置实现了利用太阳能间接将H2S分解为S和H2 13.向0. 02 mol.L-1 CuSO4溶液中匀速滴加1 mol.L-1氨水,先观察到有浅蓝色沉淀[Cu2(OH)2SO4]生成,后沉淀溶解,逐渐变为深蓝色溶液。该实验过程体系的pH和电导率随时间的变化如右图所示。下列说法正确的是 A.c(Cu2+):a点=b点 B.bc段生成浅蓝色沉淀的反应为 C.d点时: D.导电能力: 26.(14分) 过氧乙酸(CH3COOOH)是一种常用的消毒剂,易溶于水、易挥发、见光或受热易分解。其 制备原理为:△H<0,同时利用乙酸丁酯与水 形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如下图。 (1)过氧乙酸保存时应注意 (填标号)。 A.避光 B.低温 C.密闭 D.隔绝空气 (2)仪器a的名称为 ,其中盛放的试剂为 (填“乙酸”或“双氧水”)。 (3)为减少反应瓶中乙酸丁酯的损耗,反应开始前,在油水分离器中应进行的操作是 。 (4)反应体系采用减压的目的是____。 (5)过氧乙酸(含有少量H2O2杂质)的含量测定流程如下图。 ①判断H2O2恰好除尽的实验现象是 。 ②过氧乙酸被Fe2+还原,还原产物之一为乙酸,其离子方程式为 ③若样品体积为Vo mL,加入c1mol.L-1FeSO4溶液V1mL,消耗c2mol.L-1K2Cr2O7溶液V2 mL。则过氧乙酸含量为 g.L-l。 27.(15分) “NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠( Na2HPO3)的工业流程如下图。 已知:25℃时,H3PO3的pKa1 =1.3,pKa2 =6.6。 (1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为 (2)“除铅”过程,FeS除去微量Pb2+的离子方程式为 。 (3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____(填化学式)。 (4)“调pH= II”的作用是 。 (5)若“结晶”前溶液中Na2HPO3的浓度为0.1 mol.L-1,则“吸附”处理后,应调节溶液pH 至 (填数值)。 (6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。 ①B膜最佳应选择 ②阳极的电极反应式是____。 ③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是 。 28.(14分) 研究大气污染物SO2、CH3OH与H2O之间的反应,有利于揭示雾霾的形成机理。 反应i: 反应ii: (I)CH3OSO3H发生水解:△H= kJ.mol-1。 (2)T℃时,反应ii的CH3OH(g)、SO3 (g)的初始浓度分别为 平衡时SO3转化率为0.04%,则K= 。 (3)我国科学家利用计算机模拟计算,分别研究反应ii在无水和有水条件下的反应历程, 如图所示,其中分子间的静电作用力用“…”表示。 ①分子间的静电作用力最强的是 (填“a”、“b”或“c”)。 ②水将反应ii的最高能垒由 eV降为 eV。 ③d到f转化的实质为质子转移,该过程断裂的化学键为____(填标号)。 A.CH3OH中的氢氧键 B.CH3OH中的碳氧键 C.H2O中的氢氧键 D.SO3中的硫氧键 (4)分别研究大气中H2O、CH3OH的浓度对反应i、反应ii产物浓度的影响,结果如图所示。 ①当c( CH3OH)大于10-11 mol.L-1时,c(CH3OH)越大,c( H2SO4)越小的原因是 。 ②当c( CH3OH)小于10-11mol.L-1时,c(H2O)越大,c( CH3OSO3H)越小的原因是 。 35.[化学——选修3:物质结构与性质](15分) 一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如下。 (1)基态碳原子的价电子排布图为 。 (2)1 mol HCOOH中含有的σ键数目为 ,HCOOH的沸点比CO2高的原因为 。 (3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为 (4) Ru络合物中与Ru配位的原子有N、 。 (5)Ru络合物含有的片段和中氮原子均采用sp2杂化,都存在大π键,氮原子配 位能力更强的是 (填“前者”或“后者”)。 (6)-种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。 ①g-C3N4中氮原子的杂化类型是 。 ②根据图2,在图1中用平行四边形画出一个最小重复单元。 ③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。 36.[化学——选修5:有机化学基础](15分) 苯丁酸氮芥是氮芥类抗癌药的代表物,其合成路线如下: 回答下列问题: (1)反应①所需的试剂和条件是____,B中的官能团名称是 (2)C的结构简式为 。 (3)写出具有苯环结构,既能发生银镜反应又能发生水解反应的D的同分异构体的结构 简式 。(不考虑立体异构,只需写出 3个) (4)⑤的反应类型是 。 (5)写出F到G的反应方程式 。 (6)H到I的转化过程中是否可以将1)、2)两步交换顺序,说出你的理由? (7)设计由苯和制备的合成路线 (无机试剂任选)。查看更多