【化学】安徽省寿县安丰高中2019-2020学年高一下学期期末教学质量检测试题
安徽省寿县安丰高中 2019-2020 学年高一下学期期末教学质
量检测试题
命题人: 审题人:
可能用到的相对原子质量:H:1 C:12 N:14 O: 16 Na: 23 Cu: 64 Zn: 65 Tl:204
第 I 卷(选择题)
一、选择题(20 小题,每小题只有一个....选项符合题意,共计 60 分)
1.2019 年是元素周期表发表 150 周年,期间科学家为完善周期表做出了不懈努力。中国科
学院院士张青莲教授曾主持测定了铟(49In)等 9 种元素相对原子质量的新值,被采用为国
际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In 是第五周期第ⅢA 族元素
B.11549In 的中子数与电子数的差值为 17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
2.下列有关化学用语正确的是( )
A.乙烷的分子式:CH3CH3 B.乙烯的结构简式:CH2CH2
C.四氯化碳的电子式: D.甲烷的比例模型:
3.CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊的相关信息如下图所示。下列有关
卡片信息解读不正确的是( )
A.铊的元素符号为 Tl B.铊原子的中子数=204-81=128
C.铊位于第六周期ⅢA 族 D.铊的金属性比铝的金属性强
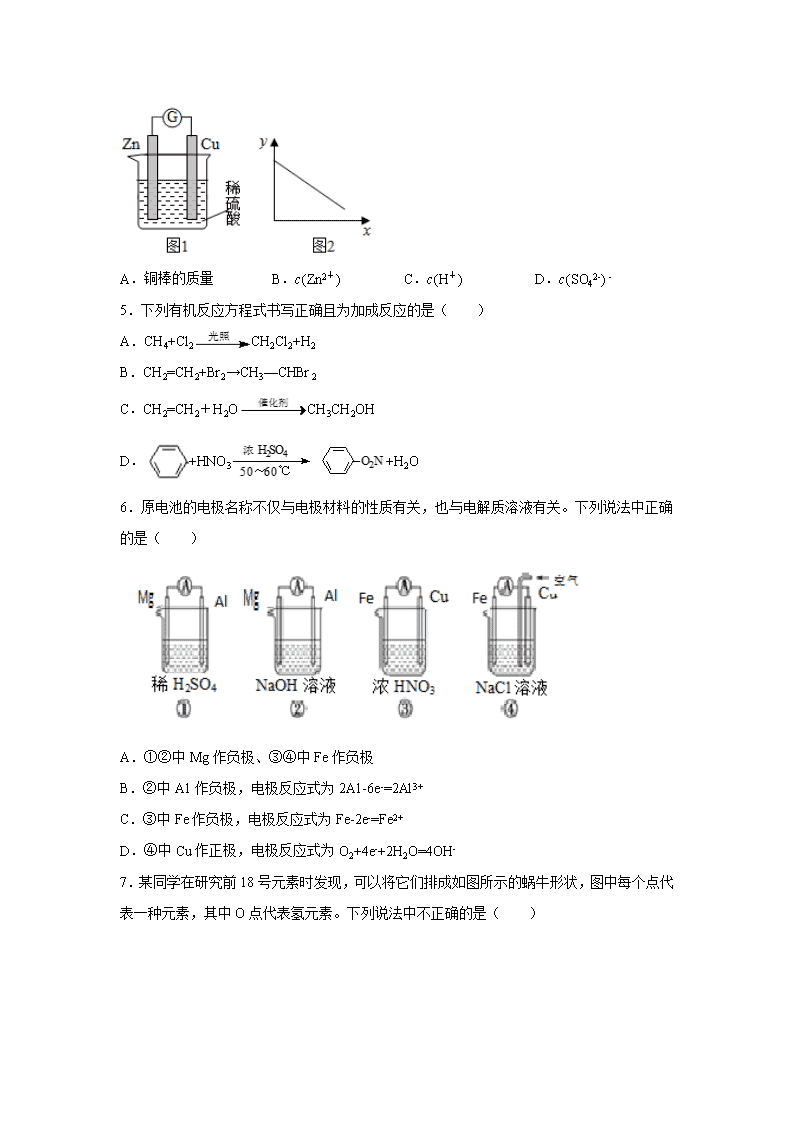
4.图 1 是铜锌原电池示意图。图 2 中,x 轴表示实验时流入正极的电子的物质的量,y 轴表
示( )
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-) -
5.下列有机反应方程式书写正确且为加成反应的是( )
A.CH4+Cl2 CH2Cl2+H2
B.CH2=CH2+Br2→CH3—CHBr2
C.CH2=CH2+H2O CH3CH2OH
D. +HNO3 +H2O
6.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确
的是( )
A.①②中 Mg 作负极、③④中 Fe 作负极
B.②中 A1 作负极,电极反应式为 2A1-6e-=2Al3+
C.③中 Fe 作负极,电极反应式为 Fe-2e-=Fe2+
D.④中 Cu 作正极,电极反应式为 O2+4e-+2H2O=4OH-
7.某同学在研究前 18 号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代
表一种元素,其中 O 点代表氢元素。下列说法中不正确的是( )
A.离 O 点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B、C 最高价氧化物对应的水化物可相互反应
D.A、B 组成的化合物中可能含有共价键
8.四种短周期元素在周期表中的位置如图,其中只有 M 为金属元素下列说法不正确的是
( )
Y Z
M X
A.Y 的最高价氧化物对应水化物的酸性比 X 的弱
B.Z 位于元素周期表中第二周期第ⅥA 族
C.X 的气态氢化物的稳定性比 Z 的弱
D.M 的原子半径比 Y 的原子半径大
9.已知 X、Y 是短周期的两种元素,下列有关比较或说法中一定正确的是( )
选项 条件 结论
A 若原子半径:X>Y 原子序数:X
Y
C 若价电子数:X>Y 最高正价:X>Y
D 若 X、Y 最外层电子数分别为 1、7 X、Y 之间一定能形成离子键
10.某元素原子的结构示意图为 ,由此得出的结论不正确的是( )
A.元素符号是 Cl
B.原子半径大于 S
C.在周期表中的位置是第三周期,第ⅦA 族
D.在化学反应中易得电子
11.已知反应 A B=C D 的能量变化如图所示,下列说法正确的是( )
A.该反应为放热反应
B.该反应吸收的能量为 1 2E -E
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
12.燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,
a、b 均为惰性电极。下列叙述不正确的是( )
A.a 极是负极,该电极上发生氧化反应
B.总反应方程式为 2H2+O2═2H2O
C.b 极反应是 O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
13.下列关于苯的叙述正确的是( )
A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中 1 mol 苯最多与 3 mol H2 发生加成反应,因为苯分子含有三个碳碳双键
14.若将等物质的量的 CO 和 H2 混合气体充入恒温恒容密闭容器中进行反应:
CO(g)+2H2(g) CH3OH(g),下列事实能说明此反应已达到平衡状态的是( )
A.容器内气体密度保持不变
B.用 CO、H2、CH3OH 表示反应的速率之比为 1:2:1
C.单位时间内生成 nmolCO 的同时生成 2nmolH2
D.混合气体的平均相对分子质量不变
15.对于 A2+3B2 2C 的反应,以下化学反应速率的表示,反应速率最快的是( )
A.υ(A2) = 0.4 mol·L-1·s-1 B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1 D.υ(B2) = 4.2 mol·L-1·min-1
16.中科院电子学研究所的研究人员已经掌握了锶原子光钟研究的一系列关键技术,为显著
提高卫星导航系统的定位精度奠定了基础。锶(元素符号 Sr)的原子序数为 38,下列说法
中不正确的是( )
A.84Sr、86Sr、87Sr、88Sr 互为同位素
B.由 Sr 的原子序数可知,其在周期表中的位置是第五周期第 IIA 族
C.根据元素周期律可知,Sr(OH)2 的碱性强于 Ca(OH)2,弱于 Ba(OH)2
D.根据元素周期律可知,Sr 的还原性强于 Mg,因此可以从 MgCl2 溶液中置换出 Mg
17.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强
④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①③⑤
18.下列有关元素周期表的叙述正确的是 ( )
A.元素周期表中ⅠA 族元素又称为碱金属元素
B.元素周期表中每一周期元素的种类均相等
C.元素周期表的形成原因是核外电子排布的周期性变化
D.每一周期的元素最外层电子数均是 1→8,周而复始
19.下列说法正确的是( )
A.F 是最活泼非金属,Li 是最活泼金属
B.X2+的核外电子数目为 18,则 X 在第四周期第ⅡA 族
C.元素周期表有 7 个主族,7 个副族,1 个 0 族,1 个Ⅷ族,共 16 纵行
D.NaOH 易溶于水,Ca(OH)2 微溶,所以 NaOH 碱性比 Ca(OH)2 强
20.短周期元素 A、B、C 的位置如图所示,已知 B、C 两元素的原子序数之和是 A 元素原
子序数的 4 倍,则 A、B、C 依次是( )
A.Be、Na、Al B.C、Al、P
C.B、Mg、Si D.O、P、Cl
第 II 卷(非选择题)
二、填空题(4 小题,每空 2 分,共计 40 分)
21.(10 分)几种主族元素(过渡元素略去)在周期表中的位置如下:
A
M B D
E G R J
T
(1) E、G、T 的原子半径由大到小的顺序是_________(填元素符号)。
(2)硒元素(34Se)与 D 同主族,其非金属性比 D_________(填“强”或“弱”)。
(3) E、G 元素最高价氧化物对应水化物之间能反应,离子方程式为:_________________。
(4) E、D 两元素能形成原子个数比 1:1 型化合物的电子式为__________________。
(5)A 与 M 形成的分子可能是______________(填字母序号)。
22.(10 分)某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
(1) 装置 A 中盛放的试剂是_______(填选项),
A 中发生反应的化学反应方程式是_________ 。
A.Na2SO3 溶液 B.Na2S 溶液 C.Na2SO4 溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl 比 H2S 稳定
B.HClO 氧化性比 H2SO4 强
C.HClO4 酸性比 H2SO4 强
D.铁与 Cl2 反应生成 FeCl3,而硫与铁反应生成 FeS
(3)若要验证非金属性:
Cl>I,装置 A 中加入淀粉碘化钾混合溶液,观察到装置 A 中溶液_______的现象,即可证明。
用原子结构理论解释非金属性 Cl>I 的原因:同主族元素从上到下,________________。
23.(10 分)下图中 A、B、C、D 分别是三种烃的分子结构,请回答下列问题:
(1)上图中 D 是有机物分子的_____模型(填“球棍”或者“比例”)。
(2)烃 A 及其同系物的分子式符合通式_____(碳原子个数用 n 表示)。
(3)下列关于烃 C 的叙述正确的是_____(填序号)。
A.分子式为 C6H6,它不能使酸性 KMnO4 溶液褪色,属于饱和烃
B.从分子结构看,C 分子中含有碳碳双键,属于烯烃
C.烃 C 中加入溴水,充分振荡,静置,下层无色
(4)分别写出 B 使溴水褪色的化学方程式__________ _,
该反应类型:________________。
24.(10 分)将气体 A、B 置于固定容积为 2 L 的密闭容器中,发生如下反应:
3A(g)+B(g) 2C(g)+2D(g)
反应进行到 10 s 末,达到平衡,测得 A 的物质的量为 1.8 mol,B 的物质的量为 0.6 mol,C
的物质的量为 0.8 mol。
(1)用 C 表示 10 s 内反应的平均反应速率为________。
(2)反应前 A 的物质的量浓度是________ mol·L-1 。
(3)10 s 末,生成物 D 的物质的量浓度为________ mol·L-1。
(4)A 与 B 的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”)。
【参考答案】
1-10 DDBCC DAABB
11-20 BCBDA BCCBD
21.(1)T>E>G
(2)弱
(3)Al(OH)3 +OH- = AlO2
-+2H2O
(4)
(5)③
22.(1)B Cl2 + H2S = S↓ + 2HCl
(2)B
(3)变蓝 原子核外电子层数依次增多,原子半径逐渐增大,原子核对最外层电子吸引
力减弱,失电子能力逐渐增强,得电子能力逐渐减弱。
23.(1)球棍
(2)CnH2n+2
(3)C
(4) 加成反应
24.(1)0.04 mol·L-1·s-1
(2)1.5
(3)0.4
(4)1∶1
(5)减小