- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省新乡市红旗区高二上学期第一次月考化学试题
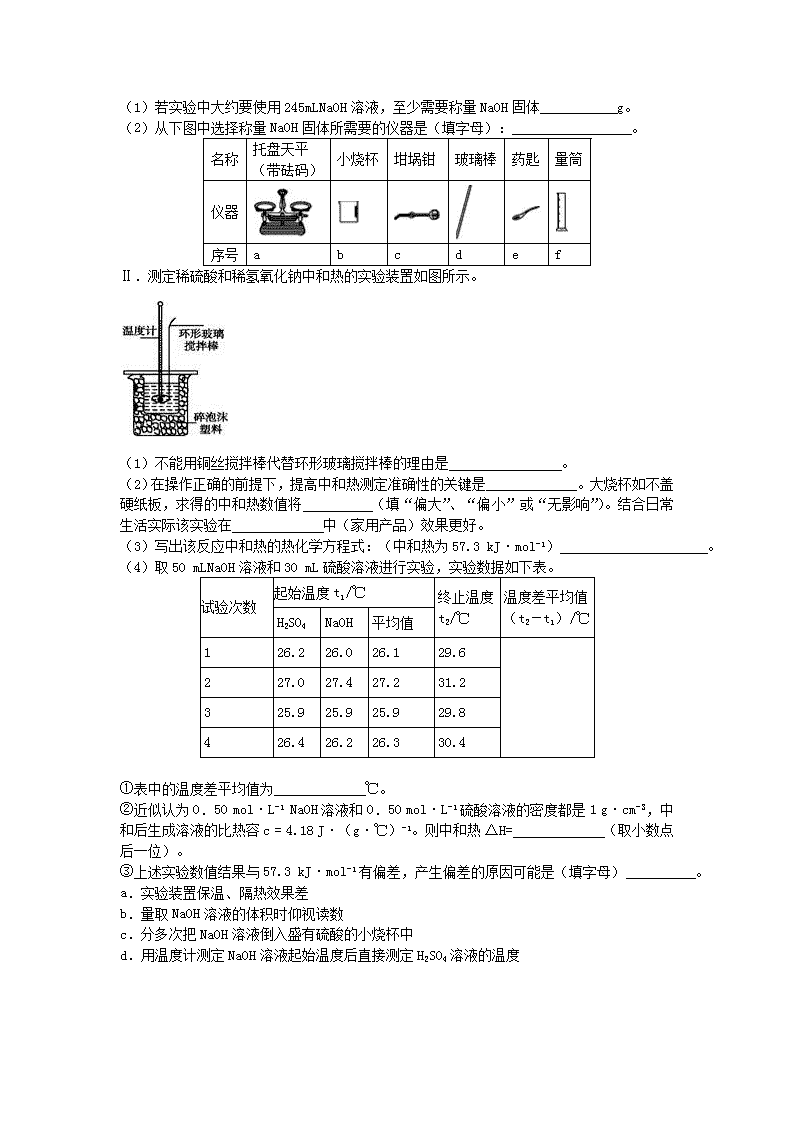
河南省新乡市红旗区 2017-2018 学年高二化学上学期第一次月考试 题 一、选择题 1.如图所示,在 101kPa 时,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正 确的是 A. 石墨的燃烧热为 393.5kJ B. 石墨转变成金刚石需要吸收能量,是物理变化 C. 石墨比金刚石稳定 D. 1mol 金刚石与 1molO2 的总能量低于 1molCO2 的总能量 2.下列热化学方程式正确的是(△H 的绝对值均正确)( ) A. 2NO2 N2O4 △H=-57kJ/mol(反应热) B. 1/2Ba(OH)2(aq)+HCl(aq)==1/2BaCl2(aq)+H2O(l)△H=-57.3kJ/mol(中和热) C. S(s)+O2(g)==SO2(g) △H=+269.8kJ/mol(反应热) D. C8H18(l)+1/2 O2(g) ==8CO2(g)+9H2O(g) ΔH=-5518kJ·mol-1(燃烧热) 3.根据热化学方程式(在 101 kPa 时):S(s)+O2(g)= SO2(g) ΔH=-297.23kJ/mol,分析 下列说法中错误的是( ) A. S 的燃烧热为 297.23 kJ/mol B. 形成 1 mol SO2 的化学键所释放的总能量大于断裂 1mol S(s)和 1mol O2(g)的化学键所吸收 的总能量 C. S(g)+O2(g) = SO2(g)放出的热量小于 297.23 kJ D. 1mol SO2 的总能量小于 1mol S(s)和 1mol O2(g)的总能量 4.通常人们把拆开 1mol 某化学键吸收的能量看成该化学键的键能。键能的大小可以估量化 学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H 等于反应中断裂旧化学 键的键能之和与反应中形成新化学键的键能之和的差。下表是一些化学键的键能。根据键能 数据估算下列反应 CH4(g)+4F2(g)=CF4(g)+4HF(g) 的反应热△H 为( ) 化学键 C-H C-F H-F F-F 键能/(kJ•mol-1) 414 489 565 155 A. -1940 kJ•mol-1 B. 1940 kJ•mol-1 C. -485 kJ•mol-1 D. 485 kJ•mol-1 5.对于可逆反应 2SO2+O2⇌2SO3,在混合气体中充入一定量的 18O2 足够长时间后,18O 原子( ) A. 只存在于 O2 中 B. 只存在于 SO3 和 O2 中 C. 只存在于 SO2 和 O2 中 D. 存在于 SO2、SO3 和 O2 中 6.反应 A(g)+3B(g) 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应 速率如下,其中反应速率最大的是( ) A. v(A)=0.15 mol·L-1·min-1 B. v(B)=0.6 mol·L-1·min-1 C. v(C)=0.04 mol·L-1·s-1 D. v(D)=0.01 mol·L-1·s-1 7.一定量的铁粉与足量 2mol/L 盐酸反应,为了加快反应速率且不影响产生氢气的量,可向 溶液中加入 ①3mol/L 的硝酸溶液 ②少量 CuSO4(s) ③加入一定量的铜 ④少量 CH3COONa(s) ⑤对 溶液加热(假定盐酸溶质不挥发) ⑥向反应液中通入 HCl 气体 ⑦加入过量铁粉 ⑧将铁粉改 为铁片 A.③⑤⑥ B.②③④ C.①⑥⑦ D.①⑤⑧ 二、填空题 8.以下属于放热反应的有______________________(填序号)。 ①钢铁生锈 ②铝热反应 ③Na2O2 与水反应 ④铜和稀硝酸反应 ⑤Ba(OH)2·8H2O 和 NH4Cl 晶体的反应 ⑥C 和水蒸气反应制备水煤气 ⑦C 和 CO2 反应 ⑧ 酸碱中和反应 ⑨碳酸钙分解 ⑩天然气的燃烧 9.甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: (1)甲烷—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极, 在 两 极 上 分 别 通 甲 烷 和 氧 气 。 其 电 极 反 应 式 分 别 为 : 负 极 _______________ , 正 极 ______________。 (2)以甲烷为原料制取氢气是工业上常用的制氢方法。 已知:CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206.2kJ·mol-1 CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+247.4kJ·mol-1 写出 CH4(g)与 H2O(g)反应生成 CO2(g)和 H2(g)的热化学方程式为________________。 10.写出下列反应的热化学方程式: (1)46 克 NO2(g)与 H2O (1)充分反应生成 HNO3(aq)和 NO(g),放热 46kJ。__________; (2)用 CO 还原 1molFe2O3,放热 24.8kJ。___________; (3)1molHgO(s)分解为液态汞和氧气,吸热 90.7kJ。___________; (4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2 在催化剂(掺有 少量 Fe2O3 的 TiO2)表面与水发生下列反应, 已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-l, 2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-l, 则 2N2(g)+6H2O(1) 4NH3(g)+3O2(g) △H= ___________。 三、实验题 11.某实验小组用 0.50 mol·L-1NaOH 溶液和 0.50 mol·L-1 硫酸溶液进行中和热的测定。 Ⅰ.配制 0.50 mol·L-1NaOH 溶液 (1)若实验中大约要使用 245mLNaOH 溶液,至少需要称量 NaOH 固体 g。 (2)从下图中选择称量 NaOH 固体所需要的仪器是(填字母): 。 名称 托盘天平 (带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒 仪器 序号 a b c d e f Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。 (1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。 (2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖 硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常 生活实际该实验在 中(家用产品)效果更好。 (3)写出该反应中和热的热化学方程式:(中和热为 57.3 kJ·mol-1) 。 (4)取 50 mLNaOH 溶液和 30 mL 硫酸溶液进行实验,实验数据如下表。 起始温度 t1/℃ 试验次数 H2SO4 NaOH 平均值 终止温度 t2/℃ 温度差平均值 (t2-t1)/℃ 1 26.2 26.0 26.1 29.6 2 27.0 27.4 27.2 31.2 3 25.9 25.9 25.9 29.8 4 26.4 26.2 26.3 30.4 ①表中的温度差平均值为 ℃。 ②近似认为 0.50 mol·L-1 NaOH 溶液和 0.50 mol·L-1 硫酸溶液的密度都是 1 g·cm-3,中 和后生成溶液的比热容 c = 4.18 J·(g·℃)-1。则中和热 ΔH= (取小数点 后一位)。 ③上述实验数值结果与 57.3 kJ·mol-1 有偏差,产生偏差的原因可能是(填字母) 。 a.实验装置保温、隔热效果差 b.量取 NaOH 溶液的体积时仰视读数 c.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中 d.用温度计测定 NaOH 溶液起始温度后直接测定 H2SO4 溶液的温度查看更多