- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考考前45天大冲刺卷理综化学部分一(全国1卷)
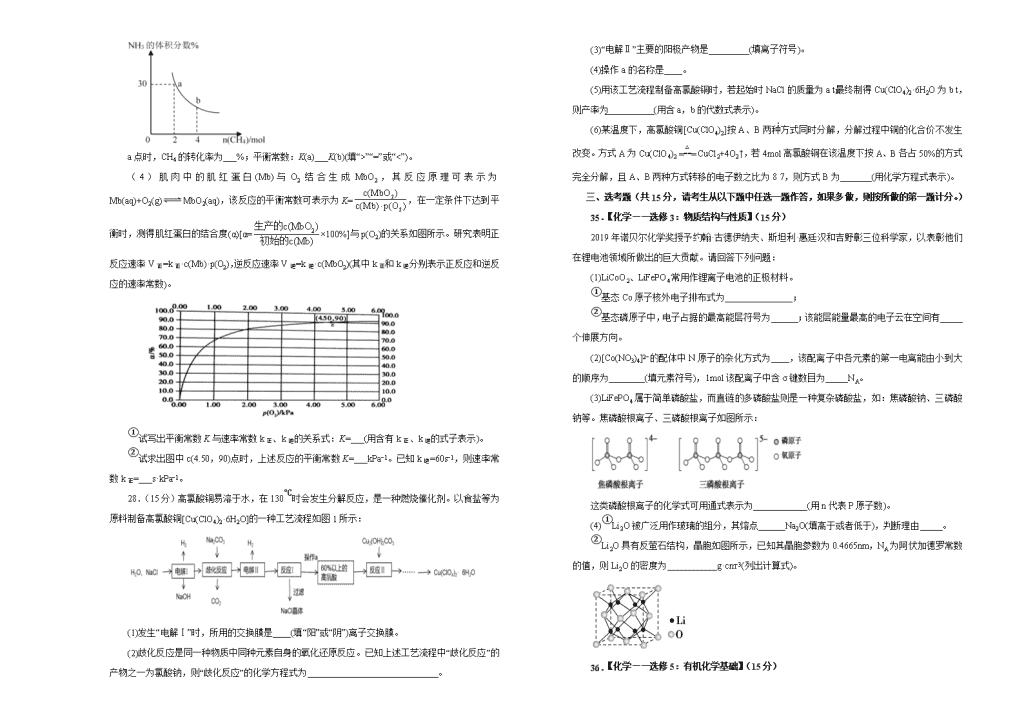
2020年高考考前45天大冲刺卷 理综综合(化学部分)(一) 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.考试结束后,请将本试题卷和答题卡一并上交。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、选择题(每题6分,共42分。) 7.钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称,下列关于陶瓷的说法正确的是 A.“窑变”是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化 B.高品质白瓷晶莹剔透,属于纯净物 C.氮化硅陶瓷属于传统无机非金属材料 D.由于陶瓷耐酸碱,因此可以用来熔化氢氧化钠 8.莽草酸可用于合成药物达菲,其结构简式如图所示。下列关于莽草酸的说法正确的是 A.分子中所有碳原子共平面 B.分子式为C7H10O5,属于芳香族化合物 C.分子中含有3种官能团,能发生加成、氧化、取代反应 D.1mol莽草酸与足量的NaHCO3溶液反应可放出4mol CO2气体 9.用NA表示阿伏加德罗常数值,下列叙述中正确的 A.0.4mol NH3与0.6mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA B.C60和石墨的混合物共1.8g,含碳原子数目为0.15NA C.1L 0.1mol/L NH4Al(SO4)2溶液中阳离子总数小于0.2NA D.5.6g铁在足量的O2中燃烧,转移的电子数为0.3NA 10.科研工作者结合实验与计算机模拟来研究钌催化剂表面不同位点上合成氨反应历程,如图所示,其中实线表示位点A上合成氨的反应历程,虚线表示位点B上合成氨的反应历程,吸附在催化剂表面的物种用*标注。下列说法错误的是 A.由图可以判断合成氨反应属于放热反应 B.氮气在位点A上转变成2N*速率比在位点B上的快 C.整个反应历程中活化能最大的步骤是2N*+3H2→2N*+6H* D.从图中知选择合适的催化剂位点可加快合成氨的速率 11.某新型电池材料结构如图,M、W、X、Y、Z是同周期主族元素,除M外均满足8电子稳定结构,X的最外层电子数是W次外层电子数的3倍,下列说法正确的是 A.M的单质可以保存在煤油中 B.原子半径Z>X>Y C.气态氢化物稳定性X>Y D.W的最高价氧化物对应的水化物为三元弱酸 12.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是 A.该装置工作时,H+从a极区向b极区迁移 B.该装置将化学能转化为光能和电能 C.a电极的反应式为3CO2+18H+-18e−=C3H8O+5H2O D.每生成3mol O2,有88g CO2被还原 13.已知:p[]=-lg[]。室温下,向0.10mol/L HX溶液中滴加0.10mol/L NaOH溶液,溶液pH随p[]变化关系如图所示。下列说法正确的是 A.溶液中水的电离程度:a>b>c B.c点溶液中:c(Na+)=10c(HX) C.室温下NaX的水解平衡常数为10−4.75 D.图中b点坐标为(0,4.75) 二、非选择题(共43分) 26.(14分)亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。SO2和浓硝酸在浓硫酸存在时可制备NOSO4H,反应原理为:SO2+HNO3=SO3+HNO2、SO3+HNO2= NOSO4H。 (1)亚硝酰硫酸(NOSO4H)的制备。 ①仪器I的名称为______________,打开其旋塞后发现液体不下滴,可能的原因是_________________。 ②按气流从左到右的顺序,上述仪器的连接顺序为__________________(填仪器接口字母,部分仪器可重复使用)。 ③A中反应的方程式为___________。 ④B中“冷水”的温度一般控制在20℃,温度不宜过高或过低的原因为________。 (2)亚硝酰硫酸(NOSO4H)纯度的测定。 称取1.500g产品放入250mL的碘量瓶中,并加入100.00mL 0.1000mol·L−1 KMnO4标准溶液和10mL 25% H2SO4摇匀;用0.5000mol·L−1 Na2C2O4标准溶液滴定,滴定前读数1.02mL,到达滴定终点时读数为31.02mL。 已知:i:□KMnO4+□NOSO4H+□______=□K2SO4+□MnSO4+□HNO3+□H2SO4 ii:2KMnO4+5Na2C2O4+8H2SO4=2MnSO4+10CO2↑+8H2O ①完成反应i的化学方程式:_____________ □KMnO4+□NOSO4H+□______=□K2SO4+□MnSO4+□HNO3+□H2SO4 ②滴定终点的现象为____________________。 ③产品的纯度为__________________。 27.(14分)含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题: (1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含的物质为H2O和 (填化学式)。 (2)研究氮氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应: ①2NO2(g)+NaCl(g)=NaNO3(g)+ClNO(g) ΔH1<0 ②2NO(g)+Cl2(g)=2ClNO(g) ΔH2<0 则4NO2(g)+2NaCl(g)=2NaNO3(g)+2NO(g)+Cl2(g)的ΔH= (用ΔH1和ΔH2表示)。 若反应①在绝热密闭容器中进行,实验测得NO2(g)的转化率随时间的变化示意图如图所示,NO2(g)的转化率α(NO2)在t3-t4时间降低的原因是 。 (3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)HCN(g)+3H2(g) ΔH>0。在一定温度下,向2L密闭容器中加入n mol CH4和2mol NH3平衡时NH3体积分数随n变化的关系如图所示。 a点时,CH4的转化率为___%;平衡常数:K(a)___K(b)(填“>”“=”或“<”)。 (4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g)MbO2(aq),该反应的平衡常数可表示为K=,在一定条件下达到平衡时,测得肌红蛋白的结合度(α)[α=×100%]与p(O2)的关系如图所示。研究表明正反应速率V正=k正·c(Mb)·p(O2),逆反应速率V逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。 ①试写出平衡常数K与速率常数k正、k逆的关系式:K=___(用含有k正、k逆的式子表示)。 ②试求出图中c(4.50,90)点时,上述反应的平衡常数K=___kPa−1。已知k逆=60s−1,则速率常数k正=___s·kPa−1。 28.(15分)高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示: (1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。 (2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为 。 (3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。 (4)操作a的名称是____。 (5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为 (用含a,b的代数式表示)。 (6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2CuCl2+4O2↑,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为 (用化学方程式表示)。 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。) 35.【化学——选修3:物质结构与性质】(15分) 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷汉和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题: (1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。 ①基态Co原子核外电子排布式为_______________; ②基态磷原子中,电子占据的最高能层符号为______;该能层能量最高的电子云在空间有_____个伸展方向。 (2)[Co(NO3)4]2−的配体中N原子的杂化方式为____,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号),1mol该配离子中含σ键数目为_____NA。 (3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示: 这类磷酸根离子的化学式可用通式表示为____________(用n代表P原子数)。 (4)①Li2O被广泛用作玻璃的组分,其熔点______Na2O(填高于或者低于),判断理由_____。 ②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为0.4665nm,NA为阿伏加德罗常数的值,则Li2O的密度为___________g·cm−3(列出计算式)。 36. 【化学——选修5:有机化学基础】(15分) 艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下: 回答下列问题: (1)丙二酸的结构简式为_______;E中含氧官能团的名称是_______。 (2)D生成E的反应类型为____________。 (3)C的结构简式为________________。 (4)A遇FeCl3溶液发生显色反应,1mol A和1mol丙二酸在吡啶、苯胺中反应生成1mol B、1mol H2O和1mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为____。 (5)X是B的同分异构体,X同时满足下列条件的结构共有____种,其中核磁共振氢谱有五组峰的结构简式为____。 ①可与碳酸氢钠溶液反应生成二氧化碳 ②遇FeCl3溶液发生显色反应 ③除苯环外不含其他环 (6)写出以苯甲醇和丙二酸为原料制备的合成路线________(其他试剂任选)。 参考答案 7. 【答案】C 8. 【答案】C 9. 【答案】B 10. 【答案】C 11. 【答案】B 12. 【答案】D 13. 【答案】D 26. 【答案】(1)分液漏斗 分液漏斗上口的瓶塞未打开或漏斗未与大气相通或漏斗下端活塞的凹槽未与瓶颈上的通气孔对齐 a→de→cb→de→f Na2SO3+H2SO4=Na2SO4+H2O+SO2↑(或Na2SO3+2H2SO4=2NaHSO4+SO2↑) 温度过低,反应速率太慢,温度过高,浓硝酸易分解,SO2逸出 (2)2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4 滴入最后一滴Na2C2O4标准液后,溶液由紫红色变为无色,且半分钟颜色不恢复 84.67% 27. 【答案】(1)N2 (2)2ΔH1-ΔH2 因反应为放热反应且反应容器为绝热容器,随着反应正向进行,体系的温度升高,t3-t4时间段温度升高使平衡逆向移动,转化率降低 (3)25 = (4) 2 120 28. 【答案】(1)阳 (2)3Na2CO3+3Cl2==5NaCl+NaClO3+3CO2 (3) ClO (4) 蒸发浓缩 (5) 100% (6) 2Cu(ClO4)22CuO+7O2↑+2Cl2↑ 35. 【答案】(1)1s22s22p63s23p63d74s2 M 3 (2) sp2 Co、O、N 16 (3) (PnO3n+1)(n+2)− (4) 高于 Li+半径小于Na+,电荷相同情况下,离子半径越小,晶格能越大,所以Li2O晶格能大于Na2O,其熔点高于Na2O 36. 【答案】(1)HOOC-CH2-COOH 醚键、酯基 (2) 取代反应 (3) (4) (5) 15 (6)查看更多