- 2021-08-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
甘肃省武威第六中学2020届高三下学期第六次诊断化学试题
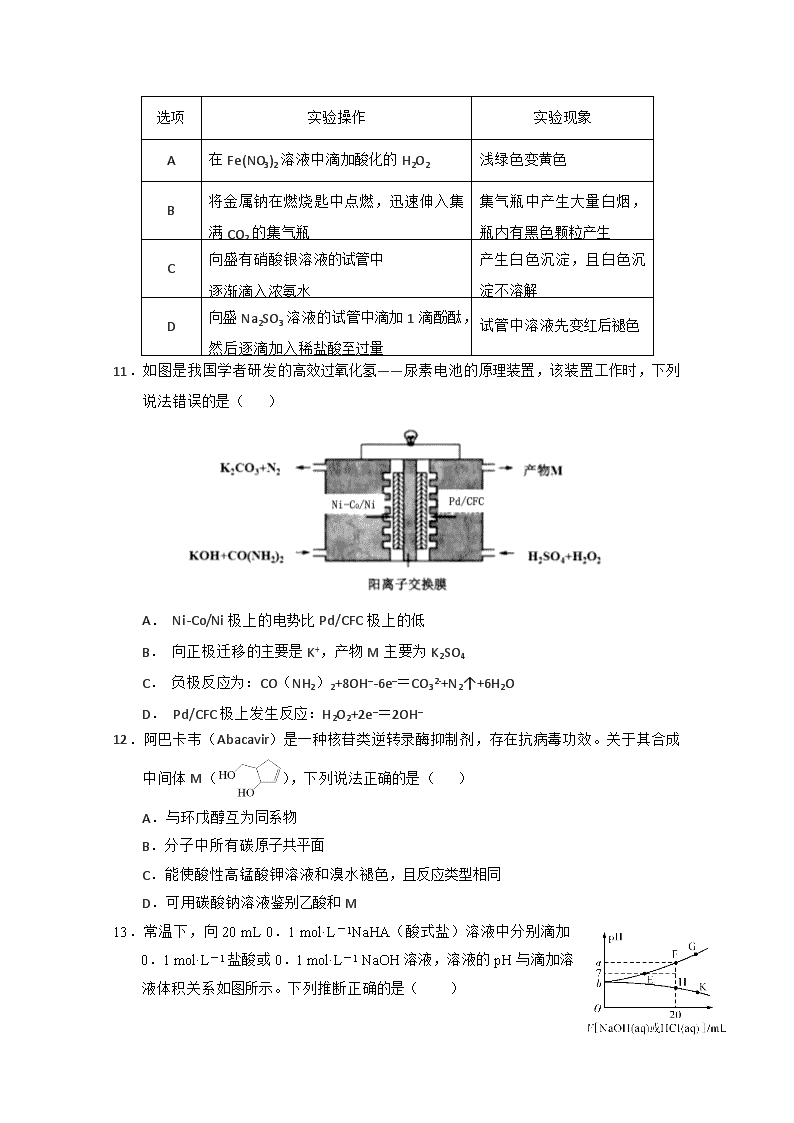
武威六中2020届高三第六次诊断考试 化 学 试 题 第I卷(选择题 共126分) 相对原子质量:H-1 O-16 C-12 N-14 Na-23 Cl-35.5 S-32 Bi-209 一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.2020年1月武汉爆发新冠肺炎,湖北省采取封城封镇的措施阻止了冠状病毒蔓延。新冠病毒主要传播方式是经飞沫传播、接触传播(包括手污染)以及不同大小的呼吸道气溶胶近距离传播。冠状病毒对热敏感,56℃30分钟、75%酒精、含氯消毒剂、过氧乙酸、乙醚和氯仿等脂溶剂均可有效灭活病毒。下列有关说法正确的是( ) A. 因为过氧乙酸能灭活病毒,所以在家每天进行醋熏能杀死家里的新冠肺炎病毒 B. 电解食盐水制取次氯酸钠喷洒房间能杀死新冠肺炎病毒 C. 在空气质量检测中的PM2.5,属于气溶胶 D. 含氯消毒剂、过氧乙酸、乙醚和氯仿等都属于有机物 8.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.1L 0.lmol/L的Na2SiO3溶液中含阴离子总数为0.1NA个 B.0.1mol的2H37Cl分子的中子数是2.1NA C.7.8g Na2O2与足量水充分反应转移的电子数目为0.2NA D.1mol雄黄(As4S4),结构如图:,含有4NA个S-S键 9.短周期主族元素W、X、Y、Z原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素原子中最大的,Y的原子序数是W的2倍,Z与X形成的离子化合物的水溶液呈中性。下列说法一定正确的是( ) A.Z的氧化物的水化物的酸性比Y的强 B.氢元素与W只能形成一种化合物 C.W的简单离子的半径比X的大 D.Y的简单气态氢化物的热稳定性比W的强 10.下列实验现象与实验操作不相匹配的是( ) 选项 实验操作 实验现象 A 在Fe(NO3)2溶液中滴加酸化的H2O2 浅绿色变黄色 B 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 C 向盛有硝酸银溶液的试管中 逐渐滴入浓氨水 产生白色沉淀,且白色沉淀不溶解 D 向盛Na2SO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 试管中溶液先变红后褪色 11.如图是我国学者研发的高效过氧化氢——尿素电池的原理装置,该装置工作时,下列说法错误的是( ) A. Ni-Co/Ni极上的电势比Pd/CFC极上的低 B. 向正极迁移的主要是K+,产物M主要为K2SO4 C. 负极反应为:CO(NH2)2+8OH–-6e–=CO32-+N2↑+6H2O D. Pd/CFC极上发生反应:H2O2+2e–=2OH– 12.阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(),下列说法正确的是( ) A.与环戊醇互为同系物 B.分子中所有碳原子共平面 C.能使酸性高锰酸钾溶液和溴水褪色,且反应类型相同 D.可用碳酸钠溶液鉴别乙酸和M 13.常温下,向20 mL 0.1 mol·L-1NaHA(酸式盐)溶液中分别滴加0.1 mol·L-1盐酸或0.1 mol·L-1 NaOH溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( ) A.NaHA在水中电离程度大于水解程度 B.在对应的各点溶液中,H点水电离程度最大 C.E点对应的溶液中有c(Na+)=c(HA-)+c(A2-) D.F点对应的溶液中存在c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) 第Ⅱ卷(非选择题 共174分) 三、非选择题(包括必考题和选考题两部分,第22~32题为必考题,每个试题考生都必须作答.第33~38题为选考题,考生根据要求作答) 26.(14分)铋酸钠(NaBiO3)常用作Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如下: 己知:①NaBiO3是一种难溶于水的物质 ②BiCl3极易水解生成不溶性的BiOCl沉淀 请回答下列问题: (1)为了提高溶浸工序中原料的浸出率,可以采取的措施有 (填标号)。 a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.降低温度 (2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是 ,滤渣A的主要成分为 (填化学式)。 (3)反应④的化学方程式为 。 (4)NaBiO3可在酸性介质中将Mn2+ 氧化为MnO4一,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为 。 (5)实验室为了测定NaBiO3样品的纯度,需要配制250mL 0.500mol/L FeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要 。 (6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00 mL溶液,然后用新配制的0.500mol/L FeSO4溶液进行滴定,滴定完成后消耗24.80 mL FeSO4溶液。则该样品中NaBiO3纯度为 %(结果保留小数点后一位)。 27.(15分)1,2二氯乙烷是一种广泛使用的有机溶剂、黏合剂,也用作谷物和粮仓的熏蒸剂,沸点83.5 ℃,熔点-35 ℃。某研究性学习小组的同学利用如图(加热装置省略)装置制备一定量的1,2二氯乙烷,制备原理为C2H5OH 170℃ 浓硫酸 C2H4 CH2ClCH2Cl。装置A中的浓硫酸是催化剂、脱水剂,乙醇的密度约为0.8 g·mL-1。 (1)根据制备原理,可知装置A中还缺少的一种实验仪器是__________________。使用冷凝管的目的是__________________________。 (2)实验时A中三颈烧瓶内有有刺激性气味的无机气体产生,为吸收反应中生成的无机气体,在装置B中应加入________(填字母序号)。 a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液 (3)D中a、c两个导管进入仪器中的长度不同,其优点是______________________,对导管b的进一步处理方法是____________________________,装置E是氯气的贮气瓶,则Q中的物质是______________。 (4)写出D中反应的化学方程式_______________________________________。 (5)若得到a g 1,2二氯乙烷,则乙醇的利用率为_________________________________。 28.(14分)丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。 主反应:①C3H8(g) =C3H6(g) +H2(g)ΔH1 副反应:②C3H8(g) =C2H4(g)+ CH4(g) ③C2H4(g) +H2(g) =C2H6(g) ④C3H8(g) +H2(g)=C2H6(g) +CH4(g) 回答下列问题: (1)已知ΔH2=-117kJ/mol。 ΔH3=-242kJ/mol。反应①的ΔH1= 。 (2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为 ;该反应的平衡常数Kp= Pa。若提高C3H8的平衡转化率,可采取的措施有 (填标号)。 A.增大C3H8的浓度 B.提高温度 C.恒容下通入惰性气体 D.使用高效催化剂 (3)工业生产中常采用恒压下充入高温水蒸气的条件。下图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2 5(填“>”或“<”)。 (4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于崔化剂活性保持,其原因是 。反应气中的配比对催化剂活性的影响如下表所示。其中C3H6收率最高时的配比是 。 35.[化学—选修3:物质结构与性质](15分) 第四周期某些过渡元素在工业生产中有着极其重要的作用。 (1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置____________;其原子核外电子排布的最高能层符号为________。 (2)在1 mol CrO5(其中Cr为+6价)中,含有过氧键的数目为____________。 (3)钒(23V)广泛用于催化及钢铁工业,被称之为“工业的味精”。写出钒原子价电子排布图_____________________________________; V2O5常用作SO2转化为SO3的催化剂。SO3 的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为____________。 (4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是__________。(填元素符号) (5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。 CaTiO3晶胞如图,边长为a=0.266 nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为________nm,与Ti紧邻的O个数为________。 (6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于________位置,O处于________位置。 36.【化学—选修5:有机化学基础】(15分) 1, 3-环己二酮()常用作医药中间体,用于有机合成。1, 3-环己二酮的一种合成路线如图所示。 回答下列问题: (1)甲的分子式为 。 (2)丙中含有官能团的名称是 。 (3)反应①所需的试剂和条件是 ;②的反应类型是 。 (4)丁的结构简式为 。 (5)写出丙与新制氢氧化铜悬浊液反应的化学方程式 。 (6)符合下列条件的乙的同分异构体共有种 。 ①能发生银镜反应 ②能与NaHCO3溶液反应 其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为 _______________(任写一种)。 高三化学答案 7B 8B 9C 10C 11D 12D 13 A 26.(共14分) (1) bc(2分) (2)防止FeCl3及BiCl3水解,提高原料的浸出率(2分,不答FeCl3不扣分) SiO2、S (2分,各1分) (3)2Bi + Na2O2 + 2O2 === 2NaBiO3(2分) (4)5NaBiO3+2Mn2++14H+=== 2MnO4﹣+5Na++5Bi3++7H2O (2分) (5)250mL容量瓶、胶头滴管 (2分,各1分) (6)86.8 (2分) 27.(共15分) (1)温度计(1分) 使乙醇冷凝回流,提高原料的利用率(2分) (2)c (2分) (3)有利于Cl2、C2H4充分混合反应(2分) 将b管逸出的Cl2引入到NaOH溶液中(2分) 饱和食盐水(2分) (4)CH2===CH2+Cl2―→CH2ClCH2Cl (2分) (5)% (2分) 28.(共14分) (1)+125kJ/mol (2分) (2)20%(2分) 5000 (2分) B (2分) (3)> (2分) (4)C+CO2=2CO有利于消除积碳 (2分) 1:2.4(2分) 35.(15分) (1)第四周期第VI B族(1分) N(1分) (2)2×6.02×1023(或2NA) (1分) (3) (2分) sp3(2分) (4)C(2分) (5)0.188(2分) 12(2分) (6)体心(1分) 棱心(1分) 36. (15分)(1)C6H11Br(2分) (2)醛基、羰(酮)基(2分) (3)氢氧化钠醇溶液,加热(2分) 氧化反应(1分) (4)(2分) (5)CHO+2Cu(OH)2+NaOH COONa+Cu2O↓+3H2O (2分) (6)12(2分)或(2分)查看更多