- 2021-08-24 发布 |
- 37.5 KB |
- 41页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学常用计量课件(41张)(全国通用)
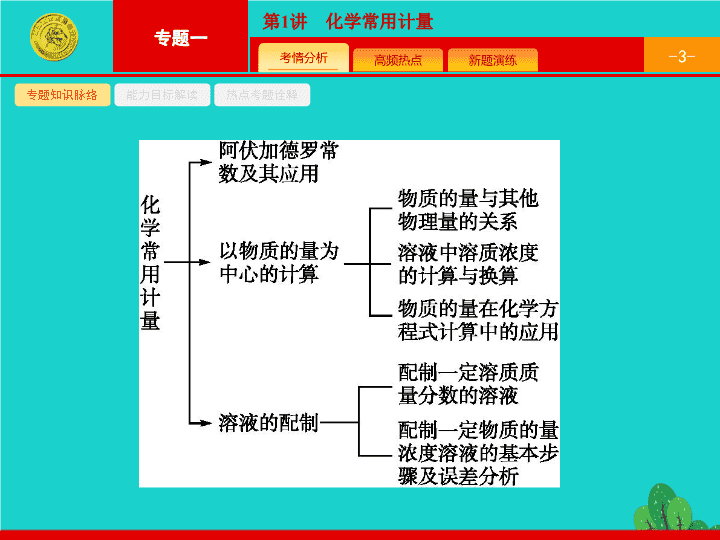
专题一 基本概念和基本原理 第 1 讲 化学常用计量 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 - 5 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 1 .(2016 全国乙 ) 设 N A 为阿伏加德罗常数值。下列有关叙述正确的是 ( ) A.14 g 乙烯和丙烯混合气体中的氢原子数为 2 N A B.1 mol N 2 与 4 mol H 2 反应生成的 NH 3 分子数为 2 N A C.1 mol Fe 溶于过量硝酸 , 电子转移数为 2 N A D. 标准状况下 ,2.24 L CCl 4 含有的共价键数为 0.4 N A A - 6 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 2 .(2015 课标全国 Ⅰ ) N A 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.18 g D 2 O 和 18 g H 2 O 中含有的质子数均为 10 N A B.2 L 0.5 mol·L -1 亚硫酸溶液中含有的 H + 数为 2 N A C. 过氧化钠与水反应时 , 生成 0.1 mol 氧气转移的电子数为 0.2 N A D. 密闭容器中 2 mol NO 与 1 mol O 2 充分反应 , 产物的分子数为 2 N A 答案 解析 解析 关闭 答案 解析 关闭 - 7 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 3 .(2014 课标全国 Ⅱ 部分 )PbO 2 在加热过程发生分解的失重曲线如下图所示 , 已知失重曲线上的 a 点为样品失重 4.0%( 即 表示为 PbO x 或 m PbO 2 · n PbO, 列式计算 x 值和 m ∶ n 值。 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 9 - 热点一 热点二 热点三 阿伏加德罗常数及其应用 有关阿伏加德罗常数解题的思维路径 问题探究 阿伏加德罗常数计算中常见的陷阱有哪些 ? - 10 - 热点一 热点二 热点三 - 11 - 热点一 热点二 热点三 - 12 - 热点一 热点二 热点三 例 1 (2015 重庆一中模拟 ) N A 为阿伏加德罗常数的数值 , 下列说法正确的是 ( ) A.7.2 g CaO 2 晶体中阴离子和阳离子总数为 0.3 N A B.0.1 mol·L -1 NH 4 Cl 溶液中 Cl - 总数为 0.1 N A C. 反应 3H 2 (g)+N 2 (g) 2NH 3 (g) Δ H =-92 kJ·mol -1 , 放出热量 9.2 kJ 时 , 转移电子 0.6 N A D.0.1 mol H 2 O 2 分子中含极性共价键数目为 0.3 N A - 13 - 热点一 热点二 热点三 分析推理 (1) 对于物质中所含原子、离子或共价键数目的判断 , 需要以下几个思维步骤 : ① 计算物质的物质的量 , 注意选择合适的计算公式 ; ② 分析物质的微观结构 , 注意结构的特殊性等问题 ; ③ 结合物质的物质的量和结构进行计算。 (2) 对于溶液中离子数目的判断 , 一般思路是 : ① 根据溶液体积和物质的量浓度求出物质的物质的量 ; ② 分析电解质的电离特点 , 以及离子在溶液中的存在情况 ; ③ 结合物质的物质的量计算。 (3) 对于化学反应中转移电子的计算 , 需要进行以下几步 : ① 书写化学方程式 , 有时需要列出考查到的反应热、某些差量、某些具体微粒等物质的量之间的比例关系 ; ② 分析化学反应中的电子转移情况 ; ③ 列出转移电子和考查项目的比例关系 ; ④ 根据题目所给信息代入计算。 答案 C - 14 - 热点一 热点二 热点三 题后反思 (1) 分析 CaO 2 、 Na 2 O 2 结构时应注意 是 1 个原子团。 (2)H 2 O 2 分子结构为 H—O—O—H,1 mol H 2 O 2 含极性共价键 2 mol 。 (3) 溶液中溶质的物质的量应该用溶质的物质的量浓度乘以溶液的体积求出。 - 15 - 热点一 热点二 热点三 对点训练 1 设 N A 为阿伏加德罗常数的值。下列说法正确的是 ( ) A. 高温下 ,0.2 mol Fe 与足量水蒸气反应 , 生成的 H 2 分子数目为 0.3 N A B. 室温下 ,1 L pH=13 的 NaOH 溶液中 , 由水电离的 OH - 数目为 0.1 N A C. 氢氧燃料电池正极消耗 22.4 L( 标准状况 ) 气体时 , 电路中通过的电子数目为 2 N A D.5NH 4 NO 3 2HNO 3 +4N 2 ↑+9H 2 O 反应中 , 生成 28 g N 2 时 , 转移的电子数目为 3.75 N A 答案 解析 解析 关闭 答案 解析 关闭 - 16 - 热点一 热点二 热点三 以物质的量为中心的计算 以物质的量为中心的解题思维路径 - 17 - 热点一 热点二 热点三 问题探究 1 . 以物质的量为中心的计算中有哪些常用的公式 ? (1) 物质的量计算中的万能恒等式 (2) 物质的量浓度与溶质质量分数之间的换算 (3) 物质的量浓度与溶解度的换算 - 18 - 热点一 热点二 热点三 2 . 如何判断同溶质的溶液混合后溶液的质量分数 ? (1) 溶质相同的两溶液等质量混合时 , 混合溶液的质量分数为两溶液质量分数和的一半。 (2) 溶质相同的两溶液等体积混合时 : ① 对于密度小于 1 g·cm -3 的溶液 , 如氨水、乙醇的水溶液 , 等体积混合时溶质质量分数小于两溶液溶质质量分数和的一半 ; ② 对于密度大于 1 g·cm -3 的溶液 , 如硫酸溶液、氯化钠溶液 , 等体积混合时溶质质量分数大于两溶液溶质质量分数和的一半。 - 19 - 热点一 热点二 热点三 3 . 化学计算中的常用方法有哪些 ? (1) 守恒法。 守恒法是中学化学计算中一种常用方法 , 守恒法中的三把 “ 金钥匙 ”—— 质量守恒、电荷守恒、得失电子守恒 , 都是抓住有关变化的始态和终态 , 淡化中间过程 , 利用某种不变量 ( ① 某原子、离子或原子团不变 , ② 溶液中阴阳离子所带电荷数相等 , ③ 氧化还原反应中得失电子数相等 ) 建立关系式 , 从而达到简化过程、快速解题的目的。 - 20 - 热点一 热点二 热点三 (2) 极值法。 对混合体系或反应物可能发生几种反应生成多种产物的计算 , 我们可假设混合体系中全部是一种物质 , 或只发生一种反应 , 求出最大值、最小值 , 然后进行解答 , 此类题一般为选择题。 (3) 设未知数法。 对混合体系的计算 , 我们一般设两个未知数 , 然后依据题意列两个方程 , 进行求解。 - 21 - 热点一 热点二 热点三 例 2 1.52 g 铜镁合金完全溶解于 50 mL 密度为 1.40 g·mL -1 、质量分数为 63% 的浓硝酸中 , 得到 NO 2 和 N 2 O 4 的混合气体 1 120 mL ( 标准状况 ), 向反应后的溶液中加入 1.0 mol·L -1 NaOH 溶液 , 当金属离子全部沉淀时 , 得到 2.54 g 沉淀。下列说法不正确的是 ( ) A. 该合金中铜与镁的物质的量之比是 2 ∶ 1 B. 该浓硝酸中 HNO 3 的物质的量浓度是 14.0 mol·L -1 C.NO 2 和 N 2 O 4 的混合气体中 ,NO 2 的体积分数是 80% D. 得到 2.54 g 沉淀时 , 加入 NaOH 溶液的体积是 600 mL - 22 - 热点一 热点二 热点三 分析推理 (1) 本题中应如何求算铜和镁的物质的量 ? 对混合体系的计算 , 我们一般采用设未知数法 , 然后根据题意列方程 , 进行求解。对于本题 , 设铜的物质的量为 x , 镁的物质的量为 y , 有 得 x =0.02 mol, y =0.01 mol - 23 - 热点一 热点二 热点三 (2) 如何求硝酸的物质的量浓度 ? (3) 如何求算 NO 2 和 N 2 O 4 各自的物质的量 ? 根据混合气体在标准状况下的体积 , n (NO 2 )+ n (N 2 O 4 )=0.05 mol, 根据电子得失守恒 , n (NO 2 )+2 n (N 2 O 4 )=2 n (Cu)+2 n (Mg)=0.06 mol, 得出 n (NO 2 )=0.04 mol, n (N 2 O 4 )=0.01 mol 。 - 24 - 热点一 热点二 热点三 (4) 至少需要氢氧化钠溶液的体积是多少 ? 浓硝酸总的物质的量为 14.0 mol · L -1 ×0.05 L=0.70 mol, 生成的混合气体中氮原子的物质的量 0.04 mol+0.01 mol×2=0.06 mol, 生成的 Cu(NO 3 ) 2 、 Mg(NO 3 ) 2 中氮原子的物质的量为 0.02 mol×2+0.01 mol×2=0.06 mol, 由氮原子守恒知合金与浓硝酸的反应中 HNO 3 有剩余 , 向反应后的溶液中加入 NaOH 溶液时 ,HNO 3 与 NaOH 反应生成 NaNO 3 和 H 2 O, 生成沉淀后的溶液中溶质为 NaNO 3 , 由 n (Na + )= n ( )=0.70 mol-0.06 mol=0.64 mol, 所以得到 2.54 g 沉淀时加入 NaOH 溶液的体积应为 640 mL 。 答案 D - 25 - 热点一 热点二 热点三 题后反思 (1) 在有关 HNO 3 的计算题中 , 氮元素守恒法往往可以使解题更便捷。 (2) 在表达氮元素守恒的式子时 , 应注意 1 个 N 2 O 4 分子中有 2 个氮原子。 (3) 在计算 NaOH 溶液的体积时 , 除了根据铜和镁的物质的量来计算 , 还应考虑 HNO 3 可能有剩余。 - 26 - 热点一 热点二 热点三 对点训练 2 将一定量的氯气通入 30 mL 浓度为 10.00 mol·L -1 的 NaOH 浓溶液中 , 加热少许时间后溶液中形成 NaCl 、 NaClO 、 NaClO 3 共存体系。下列判断正确的是 ( ) A. 与 NaOH 反应的氯气一定为 0.3 mol B. n (Na + ) ∶ n (Cl - ) 可能为 7 ∶ 3 C. 若反应中转移的电子为 n mol, 则 0.15< n <0.25 D. n (NaCl ) ∶ n (NaClO ) ∶ n (NaClO 3 ) 可能为 11 ∶ 2 ∶ 1 答案 解析 解析 关闭 答案 解析 关闭 - 27 - 热点一 热点二 热点三 一定物质的量浓度溶液的配制及误差分析 有关一定物质的量浓度溶液的配制解题的思维路径 - 28 - 热点一 热点二 热点三 问题探究 1 . 一定物质的量浓度溶液的配制过程中需要哪些仪器 ? 使用的实验仪器 : 托盘天平、量筒、玻璃棒、容量瓶、胶头滴管、烧杯、药匙。 尤其注意容量瓶使用 : ① 容量瓶使用的第一步操作是检查是否漏水 ( 简称 “ 查漏 ”); ② 要选择规格合适的容量瓶 ; ③ 不能用容量瓶直接溶解固体溶质或稀释浓溶液 , 不能用作反应容器或长期贮存溶液。 2 . 配制溶液的步骤如何 ? 操作步骤 : 计算 → 称量 ( 量取 )→ 溶解 ( 稀释 )→ 转移 → 定容 → 摇匀 → 倒出装瓶。 - 29 - 热点一 热点二 热点三 3 . 如何分析所得溶液的浓度误差 ? 判断可能产生的误差。 (1) 使测定结果偏高的常见情况 : 砝码生锈 , m 偏大 , 结果偏高 ; 定容时溶液温度高 ; 用量筒量取液体时 , 仰视读数 ; 定容时俯视容量瓶刻度线读数。 - 30 - 热点一 热点二 热点三 (2) 使测定结果偏低的常见情况 : 称量时固体溶质与砝码位置放反而又使用游码 ; 未洗涤烧杯及玻璃棒 , 使 n 减小 , 浓度偏低 ; 定容时溶液温度过低 ; 称量易吸水物质时称量时间过长 ; 称量不干燥的物质 ; 用量筒量取液体时 , 俯视读数 ; 溶液在溶解、稀释、转移、定容的过程中有液体溅出 ; 定容时 , 滴加蒸馏水超过刻度线 , 再用胶头滴管吸出 ; 定容摇匀后 , 液面低于刻度线 , 再滴加蒸馏水至刻度线。 (3) 对测量结果无影响的情况 : 容量瓶内有少量水 ; 定容摇匀后发现液面低于刻度线。 - 31 - 热点一 热点二 热点三 例 3 (2015 高考模拟题改编 ) 下列说法中正确的是 ( ) A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 B. 用容量瓶配溶液时 , 若加水超过刻度线 , 立即用滴管吸出多余液体 C. 配制 350 mL 1.0 mol·L -1 NaCl 溶液可以选择一个 100 mL 的容量瓶和一个 250 mL 的容量瓶 D. 用容量瓶配制溶液 , 定容时俯视刻度线 , 所配溶液浓度偏大 - 32 - 热点一 热点二 热点三 分析推理 (1) 实验室中哪些仪器不能放进烘箱中烘干 ? 一些精确测量的仪器不能烘干 , 如容量瓶、量筒、滴定管。下列仪器可以烘干 , 如烧杯、烧瓶、试管、漏斗、广口瓶、锥形瓶等。 (2) 加水超过容量瓶刻度线 , 如何处理 ? 重新配制。 (3) 容量瓶应如何选择 ? 容量瓶的容积应等于溶液的体积 , 当没有与溶液体积匹配的容量瓶时 , 应选择大于并最接近于溶液体积的容量瓶。 答案 D - 33 - 热点一 热点二 热点三 题后反思 (1) 通常都知道容量瓶中有少量水不会影响到所配溶液的浓度 , 但不知道容量瓶不能烘干。 (2) 加水超过容量瓶刻度线时 , 误以为可以吸出多余的液体而忽略了溶质的损失。 - 34 - 热点一 热点二 热点三 对点训练 3 (2015 湖南联考 )“84 消毒液 ” 能有效杀灭甲型 H7N9 病毒 , 某同学参阅 “84 消毒液 ” 说明中的配方 , 欲用 NaClO 固体配制 480 mL 含 NaClO 25%, 密度为 1.2 g·cm -3 的消毒液 , 下列说法正确的是 ( ) - 35 - 热点一 热点二 热点三 A. 需要称量 NaClO 固体的质量为 144.0 g B. 上图所示的仪器中 , 有四种是不需要的 , 另外还需一种玻璃仪器 C. 配制的溶液在空气中光照 , 久置后溶液中 NaClO 的物质的量浓度减小 D. 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制 , 否则结果偏低 答案 解析 解析 关闭 答案 解析 关闭 - 36 - 1 2 3 4 1 .(2016 安徽合肥六校第二次联考 ) 用 N A 表示阿伏加德罗常数的值 , 下列说法正确的是 ( ) A.Fe 在少量 Cl 2 中燃烧生成 0.5 mol 产物 , 转移的电子数为 N A B.78 g Na 2 O 2 晶体中含有的阴离子数目为 2 N A C. 在标准状况下 ,2.8 g N 2 和 2.8 g CO 所含电子数均为 1.4 N A D.pH =13 的 NaOH 溶液中含有 OH - 的数目为 0.1 N A 答案 解析 解析 关闭 答案 解析 关闭 - 37 - 1 2 3 4 2 .(2016 福建漳州八校联考 ) 用 N A 表示阿伏加德罗常数的值 , 下列叙述中正确的是 ( ) A. 标准状况下 ,22.4 L SO 3 含有氧原子数目为 3.0 N A B. 常温常压下 ,12.0 g NaHSO 4 中含有的离子总数为 0.3 N A C. 在 1 L 0.1 mol·L -1 碳酸钠溶液中 , 阴离子总数大于 0.1 N A D. 某密闭容器盛有 0.1 mol N 2 和 0.3 mol H 2 , 在一定条件下充分反应 , 转移电子的数目为 0.6 N A 答案 解析 解析 关闭 答案 解析 关闭 - 38 - 1 2 3 4 3 . 现有 500 mL 某硫酸铁溶液 , 它的密度是 1.5 g·cm -3 , 其中铁离子的质量分数是 11.2%, 则下列有关该溶液的说法中不正确的是 ( ) A. 溶质的质量分数是 40% B. 溶液中溶质的物质的量浓度是 1.5 mol·L -1 C. 若取出 250 mL 该溶液稀释成 1 L, 则硫酸根离子的浓度变为 0.75 mol·L -1 D. 若加入 3 L 1.5 mol·L -1 NaOH 溶液恰好使铁离子完全沉淀 答案 解析 解析 关闭 答案 解析 关闭 - 39 - 1 2 3 4 4 . 用 98%( 密度为 1.84 g·cm -3 ) 的浓硫酸配制 0.92 mol·L -1 的稀硫酸 480 mL 。回答下列问题 : (1) 实验需用到的仪器有 : 。 (2) 需要量取浓硫酸 mL 。 (3) 下列操作正确的是 。 A. 先检查容量瓶是否漏水 B. 量取的浓硫酸先倒入烧杯中 , 加水 , 稀释后再转入容量瓶 C. 稀释后的浓硫酸立即转入容量瓶 D. 用少量蒸馏水洗涤烧杯及玻璃棒 , 将溶液注入容量瓶 , 并重复操作两次 - 40 - 1 2 3 4 E. 定容时超过刻度线 , 立即用胶头滴管吸出多余的液体 F. 加水至离刻度线 1~2 cm 时改用胶头滴管 , 直至溶液的凹液面与刻度线相切 (4) 制得的稀硫酸溶液浓度小于 0.92 mol·L -1 , 可能的原因是 ( 填写编号 ) 。 A. 用量筒量取液体时 , 俯视液面读数 B. 使用容量瓶配制溶液时 , 俯视液面定容后所得溶液浓度 C. 没有用蒸馏水洗涤烧杯 2~3 次 , 并将溶液移入容量瓶中 D. 容量瓶刚用蒸馏水洗净 , 没有烘干 E. 定容摇匀后液面低于刻度线没做处理 - 41 - 1 2 3 4 答案 (1) 量筒、烧杯、玻璃棒、 500 mL 容量瓶、胶头滴管 (2)25.0 (3)A 、 D 、 F (4)A 、 C 解析 (2)98%( 密度为 1.84 g · cm -3 ) 的浓硫酸的物质的量浓度为 稀释定律 , 溶液稀释前后溶质的物质的量不变 , 则 : V ×18.4 mol · L -1 =0.92 mol · L -1 ×500 mL 解得 V =25.0 mL 。 (4) 用量筒量取液体时 , 俯视液面读数 , 量取浓硫酸的体积偏小 , 所配溶液浓度偏小 , 故 A 符合 ; 使用容量瓶配制溶液时 , 俯视液面定容 , 溶液体积偏小 , 所配溶液浓度偏大 , 故 B 不符合 ; 没有用蒸馏水洗涤烧杯 2~3 次 , 移入容量瓶中硫酸的物质的量偏小 , 所配溶液浓度偏小 , 故 C 符合 ; 配制需加水定容 , 容量瓶刚用蒸馏水洗净 , 没有烘干 , 对所配溶液浓度无影响 , 故 D 不符合 ; 定容后的体积已经达到要求 , 不能再加溶剂了 , 故 E 不符合。查看更多