- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江西省上饶中学高一上学期期中考试化学 试卷(特零班)
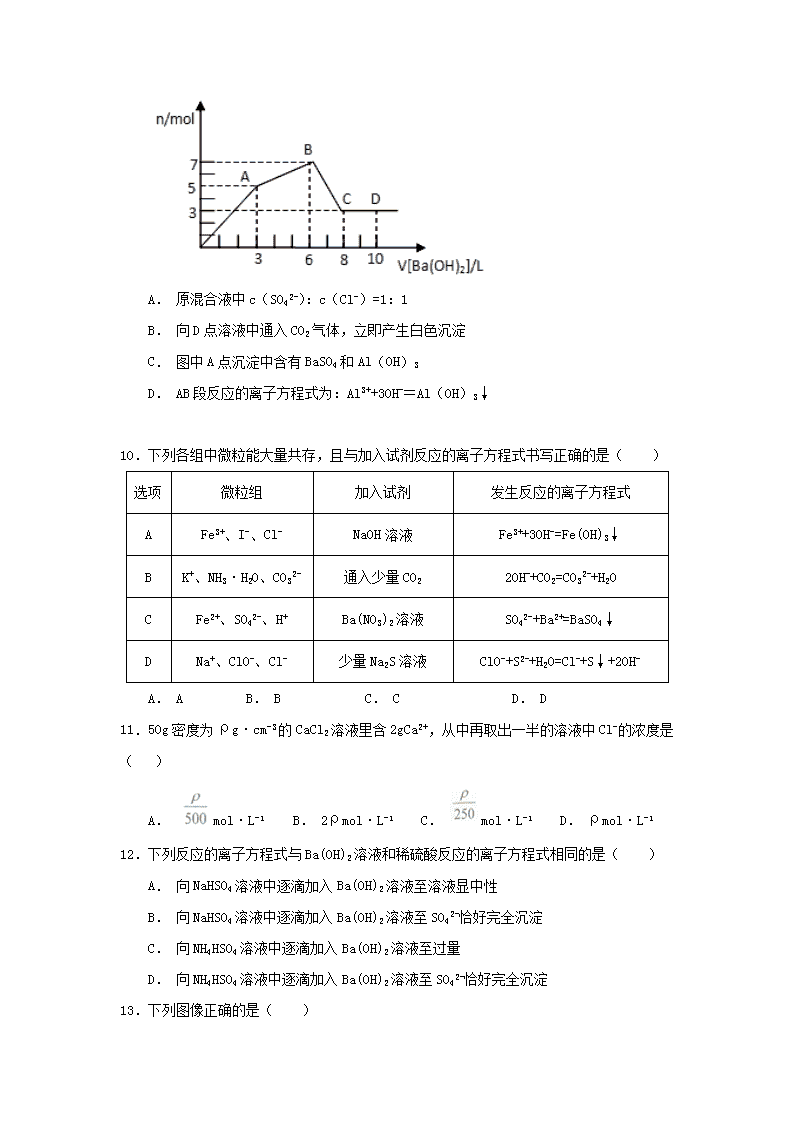
2018-2019学年江西省上饶中学高一上学期期中考试化学 试卷(特零班) 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Fe 56 Ca 40 Cu 64 一、选择题(每小题只有一个选项符合题意,每题3分,共48分) 1. 央视栏目《国家宝藏》不仅介绍了历史文化知识,彰显了民族自信、文化自信,历史文物本身也蕴含着许多化学知识。下列说法错误的是( ) A. 南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是二氧化硅 B. 战国·曾侯乙编钟属于青铜制品,青铜是一种铜锡合金 C. 清·乾隆“瓷母”—各种釉彩大瓶中的红色窑变釉的主要成分可能是氧化亚铜 D. 宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜 2.在下列溶液中,离子一定能大量共存的是 ( ) A. 强碱性溶液中:K+、Cu2+、Cl-、SO42- B. 含有0.1 mol·L-1 Fe3+的溶液中:K+、Ba2+、OH-、NO3- C. 含有0.1 mol·L-1 Ca2+的溶液中:Na+、K+、CO32-、Cl- D. 室温下的强酸性溶液中:Na+、Fe3+、NO3-、SO42- 3. 已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应。用溴水作试剂不能将下列各选项中的溶液鉴别出来的是( ) A. 水、四氯化碳、苯 B. AgNO3、NaOH、KI C. NaCl、NaBr、NaI D. 汽油、酒精、NaOH 4.下列关于物质的分类中,正确的是 ( ) 酸性氧化物 酸 盐 混合物 电解质 A SiO2 HClO 烧碱 KAl(SO4)2·12H2O C2H5OH B Na2O2 HNO3 NaHSO4 漂白粉 Mg C SO3 H2SiO3 纯碱 水泥 NaCl D NO Al(OH)3 BaCO3 氨水 NH3 A. A B. B C. C D. D 5.NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 78gNa2O2与足量SO2 充分反应转移电子数为NA B. 100gCaS与CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA C. 1molNa2CO3 和NaHCO3的混合物中CO32-的数目为NA D. 3mol单质Fe在氧气中完全燃烧转变为Fe3O4,得到8NA个电子, 6. 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑下列说法正确的是:( ) A. KNO3是还原剂,其中氮元素被氧化 B. 生成物中的N2是氧化产物,K2O是还原产物 C. 每转移1 mol电子,可生成标准状况下N2的体积为35.84 L D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3.2 mol 7.化学与生产、生活密切相关。下列与化学相关的说法正确的是( ) A. 医用酒精和Fe(OH)3胶体可用丁达尔效应区分 B. 水泥、水玻璃、水晶均属于硅酸盐产品 C. 氯水和食盐水消毒杀菌的原理相同 D. 盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 8.下列离子方程式书写正确的是( ) A. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O B. 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O C. 100mL0.1 mol·L-1 FeI2溶液与标准状况下0.224LCl2:2Fe2++Cl2=2Fe3++2Cl- D. 向明矾溶液中滴加Ba(OH)2溶液,恰好SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ 9. 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( ) A. 原混合液中c(SO42-):c(Cl-)=1:1 B. 向D点溶液中通入CO2气体,立即产生白色沉淀 C. 图中A点沉淀中含有BaSO4和Al(OH)3 D. AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓ 10.下列各组中微粒能大量共存,且与加入试剂反应的离子方程式书写正确的是( ) 选项 微粒组 加入试剂 发生反应的离子方程式 A Fe3+、I-、Cl- NaOH溶液 Fe3++3OH-=Fe(OH)3↓ B K+、NH3·H2O、CO32- 通入少量CO2 2OH-+CO2=CO32-+H2O C Fe2+、SO42-、H+ Ba(NO3)2溶液 SO42-+Ba2+=BaSO4↓ D Na+、ClO-、Cl- 少量Na2S溶液 ClO-+S2-+H2O=Cl-+S↓+2OH- A. A B. B C. C D. D 11.50g密度为ρg·cm-3的CaCl2溶液里含2gCa2+,从中再取出一半的溶液中Cl-的浓度是( ) A. mol·L-1 B. 2ρmol·L-1 C. mol·L-1 D. ρmol·L-1 12.下列反应的离子方程式与Ba(OH)2溶液和稀硫酸反应的离子方程式相同的是( ) A. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性 B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀 C. 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至过量 D. 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀 13.下列图像正确的是( ) A. A B. B C. C D. D 14.下列有关物质性质与用途具有对应关系的是( ) A. NaHCO3受热易分解,可用于制胃酸中和剂 B. SiO2熔点高硬度大,可用于制光导纤维 C. Al2O3是两性氧化物,可用作耐高温材料 D. CaO能与水反应,可用作食品干燥剂 15.NaHCO3和Na2O2按2:1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是( ) A.只有 Na2CO3 B.NaHCO3和Na2CO3 C.NaOH和Na2CO3 D.Na2O2和NaHCO3 16.向某碳酸钠溶液中逐滴滴加1 mol·L-1的盐酸,测得溶液中Cl-、 HCO3-的物质的量随加入盐酸体积的关系如图所示,其中 n2:n1=3:2,则下列说法中正确的是 ( ) A. Oa段反应的离子方程式与ab段反应的离子方程式相同 B. 该碳酸钠溶液中含有1mol Na2CO3 C. b点的数值为0.6 D. b点时生成CO2的物质的量为0.3 mol 二、填空题(每空2分,共52分) 17.(12分)三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl22BCl3+3CO。 (1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。 ①装置B中盛放的试剂是_ _,装置C的作用是________________。 ②装置A中发生反应的离子方程式为 ___________ ________________。 (2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。 ①乙组同学的实验装置中,依次连接的合理顺序为: A→B→C→G→_ _→_ _→_ _→_ _→F→D→I。 ②能证明反应中有CO生成的现象是______________________ _____。 ③请写出BCl3水解的化学方程式_______ ___________________。 18.(10分)危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题: (1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O 则被氧化和被还原的氮元素质量之比为___________ __; (2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol; (3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出离子反应方程式:________ _____ _____。 处理CN- 还常用的一种方法是:用ClO- 氧化处理生成CNO-,反应的离子方程式如下; aCN-+bClO-+ 2cOH- =dCNO-+eN2↑+fCO32-+bCl-+cH2O 上述化学方程式可能的配平化学计量数有多组,回答下列问题: ①方程式中e:f的值为___ ______(填字母); A.1 B.1/2 C.2 D.不能确定 ②若d=e=l,则b=______ ___。 19.(12分)(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是(_______) A.能全部透过半透膜 B.有丁达尔效应 C.所得液体一定呈胶状 D.所得物质一定是悬浊液 (2)把淀粉溶液溶于沸水中,制成淀粉胶体,60℃左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里充分反应。从半透膜里析出的物质是麦芽糖,该操作的名称是_____________。 (3)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化。 ①先出现红褐色沉淀,原因是_______________________________________________。 ②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是 。 ③最后溶液颜色加深,此反应的离子方程式是_______________________________。 (4)若用稀盐酸代替HI稀溶液,能出现(3)所述变化现象中的____________ (填写上面各题序号)。 20.(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题: (1)CuCl制备过程中需配制物质的量浓度为0.16 mol·L-1的CuSO4溶液。 ①配制950 mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为_______ _g。 ②某学生实际配制CuSO4溶液的浓度为0.18 mol·L-1,原因可能是________。 A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水 C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度 (2)写出用上述方法制备CuCl的离子方程式_______________________________。 (3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。其中“于70 ℃真空干燥”的目的是_________________ ________ _______ (回答两点)。 (4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2===CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是________。 A.氧化产物是HO2 B.HO2在碱中能稳定存在 C.1 mol O2 参加反应有1 mol电子发生转移 D.Cu被氧化 21.(8分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题: (1)原NaOH溶液的物质的量浓度为_______________。 (2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是__ _,其物质的量之比为_ __。 (3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况下)的最大值为__ __mL。 上饶中学2018-2019学年高一上学期期中考试参考答案 ADCCB CABAD BABDA C 17、【答案】(1) 饱和食盐水 干燥氯气 2MnO4-+16H++10Cl-2Mn2++5Cl2↑+8H2O (2)E H J H 装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 BCl3+3H2O=H3BO3+3HCl 18、【答案】 5:3 0.75 CN-+S2O32-=SCN-+SO32- B 6 19、【答案】B 渗析 加入电解质后,胶体发生聚沉 Fe(OH)3+3H+===Fe3++3H2O 2Fe3++2I-===I2+2Fe2+ ①② 20、【答案】40.0 AD 2Cu2++SO+2Cl-+H2O2CuCl↓+SO+2H+ 加快乙醇和水的蒸发,防止CuCl在空气中被氧化 CD 21、【答案】0.75mol/L Na2CO3、NaOH 1:3 112 上饶中学2018-2019学年高一上学期期中考试 化学试卷(1-3班)答题卡 班级 姓名 得分 一、选择题(每小题只有一个选项符合题意,每题3分,共48分) 题号 1 2 3 4 5 6 7 8 答案 题号 9 10 11 12 13 14 15 16 答案 二、填空题(52分) 17.(12分)(1)①_ _,_______________ ____。 ② _____________ __ ______________。 (2)①A→B→C→G→_ _→_ _→_ _→_ _→F→D→I。 ②______________________ _____。 ③_______ ___________________。 18.(10分)(1)___________ __; (2)______________mol; (3)________ _____ _ ____。 ①___ ______;②若d=e=l,则b=______ ___。 19.(12分)(1)_____ __(2)____ ________。 (3)①__________________________________ __________ ___。 ②_________________________ ______________ _______ ③_____ ______________ _______ _____。 (4)__________ __ (填写上面各题序号)。 20.(10分)(1) ①_______ _g。 ②________。 (2) ________________________ __ _____。 (3)_________________ _____________ _ _________________ _____________ _。 (4) ________。 21.(8分)(1) ____________。 (2) __ _, _ __。 (3) __ __mL。查看更多