- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省内江市第六中学2019-2020学年高一下学期期中考试试题
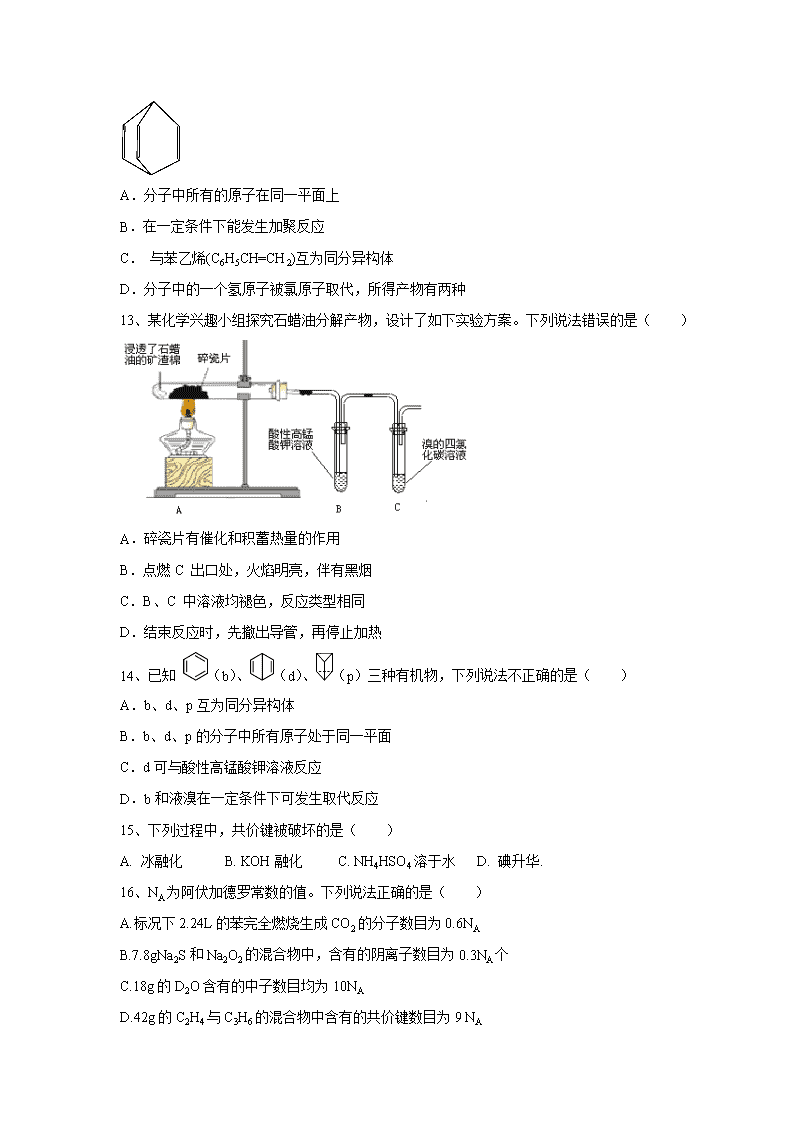
四川省内江市第六中学2019-2020学年高一下学期期中考试试题 考试时间:90分钟 满分:100分 可能用到的相对原子质量:Na-23 O -16 S -32- 第Ⅰ卷 选择题(满分48分) 1、用化学用语表示CH4+Cl2CH3Cl+HCl中的相关微粒,其中错误的是( ) A. 中子数为20的氯原子: B. Cl的结构示意图: C. CH4的比例模型: D. HCl的电子式:H∶Cl 2、空气质量是政府和公众普遍关注的问题,下列物质不列入空气质量指数首要污染物的是( ) A.二氧化硫 B.二氧化碳 C.PM2.5 D.氮氧化物 3、2016 年命名117 元素Ts 为钿(tián)),根据元素周期律推测,下列说法错误的是( ) A. Ts 为金属元素 B. Ts 位于周期表的第七周期第VIIA 族 C. Ts 的主要化合价-1、+7 D.酸性: HClO4> HTsO4 4、检验SO2中是否混有CO2气体,可采用的方法是( ) A.通过品红溶液 B.通过澄清石灰水 C.先通过酸性KMnO4溶液,再通过澄清石灰水 D.先通过NaOH溶液,再通过澄清石灰水 5、下列说法正确的是( ) A.碱性:LiOH>NaOH>KOH>RbOH B.金属性:Li>Na>K>Rb C.原子半径:Li>Na>K>Rb D.熔沸点:Li>Na>K>Rb 6、下列有关性质比较不能用元素周期律解释的是( ) A. Al(OH)3能用于NaOH溶液,Mg(OH)2不能溶解于NaOH B.F2 在暗处遇H2 爆炸,I2 在暗处遇H2 几乎不反应 C. 酸性:HNO3>H3PO4 D. 热稳定性:Na2CO3>NaHCO3 7、 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 8、将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( ) A.NH3 B.O2 C.H2O D.CO2 9、短周期元素X、Y、Z、W 的原子序数依次增大,X 原子最外层有6 个电子,Y 是至今发现非金属性最强的元素,Z 的周期序数等于族序数,W 与Z 相邻。下列说法不正确的是( ) A.可以电解Z的氯化物获得Z单质 B.Y 的氢化物可刻蚀玻璃 C.Z 的氧化物可用作耐火材料 D.W 的氧化物可用作光导纤维 10、元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( ) A.由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F B.人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 C.原子半径随着周期序数的增加而增加 D.短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+ 11、下列各组中的性质比较,正确的是( ) ① 酸性:HClO4>HBrO4>HIO4 ② 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 ③ 还原性:F->C1->Br- ④ 稳定性:HCl>H2S>PH3 A. ① ② ④ B. ① ② ③ C. ② ③ ④ D. 都正确 12、桶烯结构简式如图所示,下列有关桶烯说法不正确的是( ) A.分子中所有的原子在同一平面上 B.在一定条件下能发生加聚反应 C. 与苯乙烯(C6H5CH=CH2)互为同分异构体 D.分子中的一个氢原子被氯原子取代,所得产物有两种 13、某化学兴趣小组探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是( ) A.碎瓷片有催化和积蓄热量的作用 B.点燃C 出口处,火焰明亮,伴有黑烟 C.B、C 中溶液均褪色,反应类型相同 D.结束反应时,先撤出导管,再停止加热 14、已知 (b)、(d)、(p)三种有机物,下列说法不正确的是( ) A.b、d、p互为同分异构体 B.b、d、p的分子中所有原子处于同一平面 C.d可与酸性高锰酸钾溶液反应 D.b和液溴在一定条件下可发生取代反应 15、下列过程中,共价键被破坏的是( ) A. 冰融化 B. KOH融化 C. NH4HSO4溶于水 D. 碘升华. 16、NA为阿伏加德罗常数的值。下列说法正确的是( ) A.标况下2.24L的苯完全燃烧生成CO2的分子数目为0.6NA B.7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.3NA个 C.18g的D2O含有的中子数目均为10NA D.42g的C2H4与C3H6的混合物中含有的共价键数目为9 NA 17、下列叙述不正确的是( ) ①分子内一定含有共价键 ②离子键就是阴、阳离子的静电引力 ③沸点:SnH4 >GeH4 >SiH4>CH4 ④非金属原子间不可能形成离子化合物 ⑤H 和O,H 和N 均可形成既含极性共价键又含非极性共价键的化合物 ⑥水分子很稳定,是因为水分子之间存在氢键作用 ⑦金属性:Be<Mg<Ca<K A.①②④⑥ B.③⑤⑦ C ①②④ D.①④⑥ 18、下列说法正确的是( ) A.某单烯烃与H2 加成后的产物为(C2H5)2CHCH2C(CH3)3,则该烯烃可能的结构简式有5 种 B. 有机物的名称是2,4,4-三甲基戊烷 C.甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 D. 沼气、油田气和可燃冰中均含有甲烷 19、下列说法不正确的是 ( ) A .N2H4 分子中既含极性键又含非极性键 B. 水的熔沸点高于硫化氢是因为水分子内存在氢键。 C. OF2、PCl3、CO2、CS2 分子中各原子均达到8e-稳定结构 D. 化学键断裂,不一定发生化学变化 20、利用如图装置进行铜与浓硫酸反应产物及其性质的验证实验.下列实验操作、现象、结论均正确的是( ) 操作与现象 结 论 A 品红溶液褪色 产物中有SO2 B 石蕊溶液先变红,后褪色 SO2属于酸,具有漂白性 C 向反应后试管中加水, 溶液变蓝。 证明浓硫酸具有强氧化性 D 铜片还有剩余 硫酸反应完全 21、下列离子方程式书写正确的是( ) A. 铁钉放入硫酸铜溶液中:2Fe+3Cu2+=2Fe3++3Cu B. 金属铜溶于稀硝酸中: Cu+2NO3—+4H +=Cu2++2NO↑+2H2O C. 碳酸氢铵溶液中加入足量的氢氧化钠中:NH4++OH-=NH3 + H2O D. 少量二氧化硫通入澄清石灰水中:SO2+Ca2++2OH-=CaSO3↓+H2O 22、X、Y、Z、M、Q、R 皆为前20 号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( ) A.QX 中只存在离子键 B.简单离子半径:r(M-)>r(Q+)>r(R2+) C.X、Y、Z 三种元素组成的化合物可能是盐或碱 D.ZM3 各原子最外层电子数均满足8 电子结构 23、为学利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下: 下列说法错误的是( ) A. 向大气中排放SO2可能导致酸雨发生 B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液 D. 进入离心机的分散系是悬浊液 24. 105 ℃、101 kPa 时,甲烷、乙烷和乙烯组成的混合烃80 mL 与过量O2 混合并完全燃烧,恢复到原来的温度和压强,混合气体总体积增加了20 mL。原混合烃中乙烷的体积分数为( ) A. 12.5% B. 75% C.25% D. 50% 非选择题(共52分) 25、(每空1分,共14分) Ⅰ. 下面列出了几组物质,请将物质的合适组号填写在空格上。 A.金刚石与石墨; B.丙烯与环丙烷; C.氕与氘; D.甲烷与戊烷; E.液氨与氨水;F. ; G. (1)同位素 ,(2)同素异形体 (3)同系物 ,(4)同分异构体 ,(5)同一物质 。 II下列物质中:只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 。 ①Ar ②MgBr2 ③Na2O2 ④H2SO4 ⑤CS2 ⑥NH4Br ⑦BaO ⑧RbOH III 异丁烷的一氯代物有 种,新戊烷的一氯代物有 种。C3H2Cl6的同分异构体有 种,C5HCl11的同分异构体有 种,乙烷和氯气在光照条件下发生取代反应所得产物最多有 种。 26、(8分)A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。 (1)B在周期表中的位置____________________________ (2)F元素的最高价氧化物对应的水化物的化学式为_____________________。 (3)元素C、D、E形成的简单离子半径由小到大的顺序__________________(用离子符号表示)。 (4)写出化合物D2C2的电子式: _ 。 (5)E、F的简单离子的还原性大小顺序为:_______________________________。 (6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_________________。 27、(共12分)从有机反应R-H+Cl2⇌ R-Cl(液)+HCl(气)制取副产品盐酸的设想已成为现实.内江六中高一兴趣小组设计了如图模拟装置图,请回答下列问题: ( 1 ) 写出实验室制Cl2 的离子方程式 。 (2)装置B 中盛放的溶液是 ;作用是 。 (3)装置C 有三种功能:① ② ③观察气泡的产生情况,便于控制两种气体的配比。 (4)玻璃管E 中放在石棉碎块上的碘化钾的作用是__ _;导管末端“肚形”装置的作用是 。 (5)从F 中分离出盐酸的最佳方法是__ _;该套实验装置还存在的缺陷是 。 (6)内江六中高一另一兴趣小组设计Cl2与NH3反应来验证非金属元素氯的氧化性强于和氮,请写出Cl2与足量NH3反应的化学方程式 。 28、(每空2分共18分)下表为元素周期表的粗表,①~⑦分别表示元素周期表中对应位置的元素 ① ⑧ ③ ⑤ ② ④ ⑥ ⑦ (1)用电子式表示①与②形成化合物A 的过程:__________ __________ (2)已知⑥原子的最外层有2 个电子,请画出⑥原子的结构示意图:______________ (3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式: ______________ (4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是____________________ (用化学式表示),其沸点由高到低的顺序是__________________ (用化学式表示) (5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________ (6)①与③ ,①与④能形成18 个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为 。 (7) ⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH 溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是 。 (8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为 。 【参考答案】 选择题(共24题,每题2分共48分) 1-5:D B C CD 6-10: D B B A C 11-15 :A A C B C 16-20 :D A D B A 21-24:D B C D 非选择题(共4题,共52分) 25:(每空1分共14分) I (1)C (2)A (3) D (4) F (5)G II ④⑤ ②⑦ ⑥⑧ ③ III 2 1 4 8 10 26:(前4空每空1分,后2空每空2分) (1)第二周期第ⅤA族; (2)HClO4; (3)Na+查看更多