- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年四川省南充高级中学高二12月月考化学试题 Word版
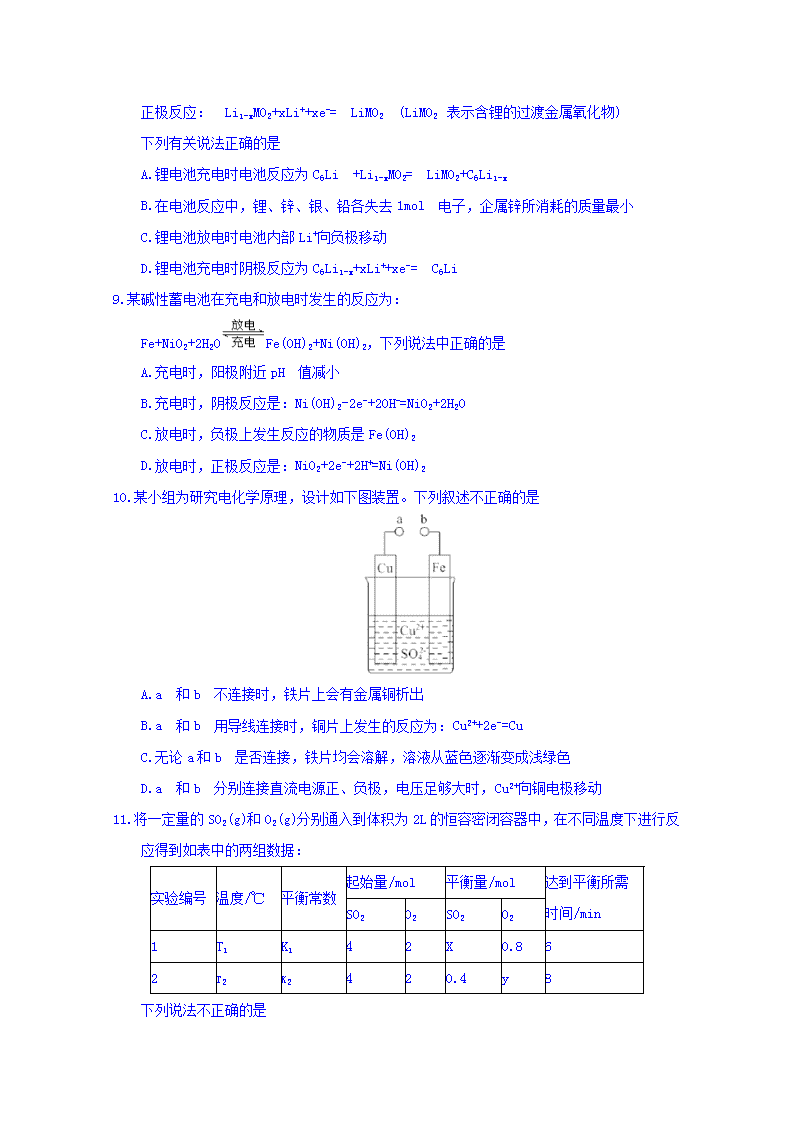
说明: 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题) 满分100分,考试时间90分钟。 2.将第Ⅰ卷的答案代表字母填在答案卷的答题表中。 第Ⅰ卷 (选择题,共48分) 可能到的相对原子质量:H-1 C-12 O-16 Na-23 Li-7 Zn-65 Ag-108 Pb-207 一、单项选择题:本题共16小题,每小题3分,共48分。 1.通过以下反应均可获取H2。下列有关说法正确的是 ①太阳光催化分解水制氢:2H2O(l)=2H2(g )+O2(g) △H1=-571.6kJ·mol-1 ②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=131.3kJ·mo1-1 ③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=206.1kJ·mol-1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,△H3减小 D.反应②中,反应物的键能大于生成物的键能 2.已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1 2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=452 kJ·mol-1 根据以上热化学方程式判断,下列说法正确的是 A.1molCO 完全燃烧,放出热量为283 J B.Na2O2(s)+CO2(s)=Na2CO3(s)+O2(g) △H=-226 kJ·mol-l C.CO(g) 与Na2O2(s)反应放出509kJ 热量时,电子转移数为1.204×1024 D.CO 的燃烧热为566 kJ·mol-1 3.已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1;HCl(aq)与NaOH (aq)反应的△H= -55.6kJ·mol-1。则HCN 在水溶液中电离的△H 等于 A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1 4.中学阶段介绍的应用电解法制备物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述中正确的是 A.电解法制金属钠时,正极反应式:Na++e-=Na B.电解法生产铝时,需对铝士矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH 在阳极附近产生 D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子 5.某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是 A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl- Cl2↑+H2↑ B. 断开K2,闭合K1时,石墨电极附近溶液变红 C断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl- D. 断开K1,闭合K2时,石墨电极作正极 6.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2恰好使溶液恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为 A.0.4 lmol B.0.3 mol C.0.2 mol D.0.1mol 7.有一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法不正确的是 A.在熔融电解质中,O2-由负极移向正极 B.电池的总反应是2C4H10+13O2=8CO2+10H2O C.通入空气的一极是正极,电极反应为O2+4e-=2O2- D.通入丁烷的一极是负极,电极反应为C4H10+13O2-+26e-=4CO2+5H2O 8.锂电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为 负极反应:C6Li-xe-=C6Li1-x+xLi+ (C6Li 表示锂原子嵌入石墨形成的复合材料) 正极反应: Li1-xMO2+xLi++xe-= LiMO2 (LiMO2 表示含锂的过渡金属氧化物) 下列有关说法正确的是 A.锂电池充电时电池反应为C6Li +Li1-xMO2= LiMO2+C6Li1-x B.在电池反应中,锂、锌、银、铅各失去1mol 电子,企属锌所消耗的质量最小 C.锂电池放电时电池内部Li+向负极移动 D.锂电池充电时阴极反应为C6Li1-x+xLi++xe-= C6Li 9.某碱性蓄电池在充电和放电时发生的反应为: Fe+NiO2+2H2OFe(OH)2+Ni(OH)2,下列说法中正确的是 A.充电时,阳极附近pH 值减小 B.充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O C.放电时,负极上发生反应的物质是Fe(OH)2 D.放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 10.某小组为研究电化学原理,设计如下图装置。下列叙述不正确的是 A.a 和b 不连接时,铁片上会有金属铜析出 B.a 和b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu C.无论a和b 是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 D.a 和b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 11.将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据: 实验编号 温度/℃ 平衡常数 起始量/mol 平衡量/mol 达到平衡所需时间/min SO2 O2 SO2 O2 1 T1 K1 4 2 X 0.8 6 2 t2 k2 4 2 0.4 y 8 下列说法不正确的是 A.x=1.6 B.实验1在前6min 的反应速率v (SO2)=0.2mol·L-1·min-1 C.T1、T2的关系:T1>T2 D.K1、K2的关系:K1 >K2 12.下列说法正确的是 A.△H<0、△S>0 的反应在温度低时不能自发进行 B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加方向转变的倾向 C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 13.反应N2O4(g)2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是 A.由图可知B点的平衡常数大于C点的平衡常数 B.A、C 两点气体的颜色: A 深,C 浅 C.A、C 两点气体的平均相对分子质量:A查看更多