- 2021-08-24 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高考化学一轮复习课时规范练24盐类的水解含解析苏教版
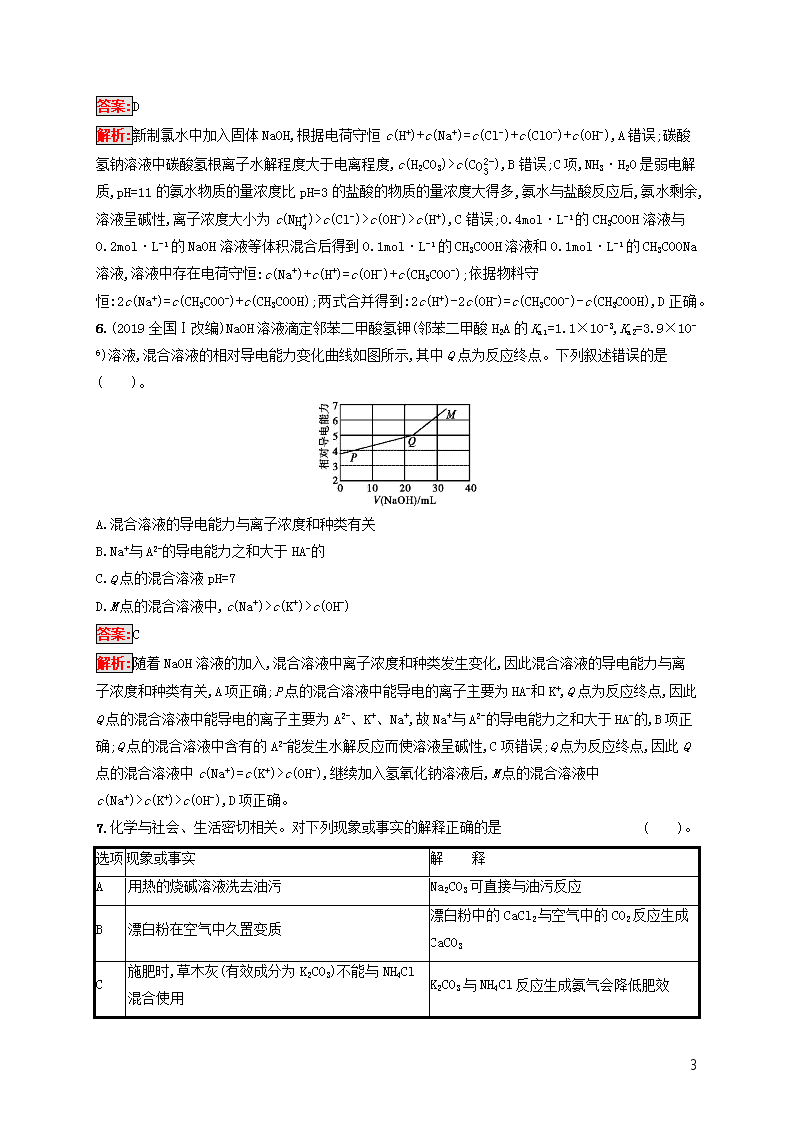
课时规范练24 盐类的水解 (时间:45分钟 满分:100分) 一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求) 1.25 ℃时,浓度均为1 mol·L-1的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol·L-1,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( )。 A.AY溶液的pH小于7 B.AY溶液的pH小于BY溶液的pH C.电离平衡常数K(BOH)大于K(HY) D.稀释相同倍数,BX溶液的pH变化大于BY溶液 答案:D 解析:25℃时,浓度为1mol·L-1的AX溶液的pH=7且溶液中c(X-)=1mol·L-1,则AX是强酸强碱盐,AOH是强碱,HX是强酸。BX溶液的pH=4,HX是强酸,则BX是强酸弱碱盐,BOH是弱碱。相同浓度时,若BY是强酸弱碱盐,则BX和BY溶液的pH应相等,实际上相同浓度时BX溶液的pH小于BY溶液的pH,则HY是弱酸,BY是弱酸弱碱盐,且B+的水解程度大于Y-。AY是强碱弱酸盐,Y-发生水解反应使其溶液显碱性,pH大于7,A项错误;AY溶液显碱性,BY溶液显酸性,显然前者的pH大于后者的pH,B项错误;BY是弱酸弱碱盐,且B+的水解程度大于Y-,离子的水解程度越大,对应电解质的电离程度则越小,故BOH的电离程度小于HY,则有电离平衡常数K(BOH)小于K(HY),C项错误;BX和BY是BOH形成的两种盐,而HX是强酸,HY是弱酸,稀释相同的倍数,BX溶液的pH变化大于BY溶液,D项正确。 2.(2019山东师大附中模拟)下列说法正确的是( )。 A.向CuCl2溶液中加入CaCO3,调节pH可除去溶液中混有的Fe3+ B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 C.用加热的方法可以除去KCl溶液中少量的Fe3+ D.洗涤油污常用热的碳酸钠溶液 答案:D 解析:A项,由Fe3++3H2OFe(OH)3+3H+,加入CaCO3消耗H+,使平衡右移而除去Fe3+,但又引入新的杂质Ca2+,不合理;B项,所加酸应是稀硫酸,否则会引入新杂质;C项,加热法不能除去溶液中少量的Fe3+。 3.已知:常温下浓度为0.1 mol·L-1下列溶液的pH如表所示。下列有关说法不正确的是( )。 溶质 NaCl Na2CO3 NaClO NaHCO3 pH 7 11.6 9.7 8.3 A.在相同温度下,同浓度的三种酸溶液的导电能力:HCl>H2CO3>HClO 9 B.等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:N(Cl-)>N(ClO-) C.向Na2CO3溶液中逐滴滴入少量稀盐酸,反应为:Na2CO3+2HCl2NaCl+CO2↑+H2O D.若将CO2通入0.1 mol·L-1 Na2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.2 mol·L-1 答案:C 解析:由0.1mol·L-1NaCl、NaClO、NaHCO3溶液pH的大小可知酸性:HCl>H2CO3>HClO,故在相同温度下,同浓度的三种酸溶液的导电能力:HCl>H2CO3>HClO,A正确;ClO-在溶液中会发生水解,所以等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:N(Cl-)>N(ClO-),B正确;向Na2CO3溶液中逐滴滴入少量稀盐酸生成碳酸氢钠和氯化钠,其反应的化学方程式为Na2CO3+HClNaHCO3+NaCl,C错误;若将CO2通入0.1mol·L-1Na2CO3溶液至溶液呈中性,根据电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),则溶液中:c(Na+)=2c(CO32-)+c(HCO3-)=0.2mol·L-1,D正确。 4.(2018北京)测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。 时刻 ① ② ③ ④ 温度/℃ 25 30 40 25 pH 9.66 9.52 9.37 9.25 实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。 下列说法不正确的是( )。 A.Na2SO3溶液中存在水解平衡:SO32-+H2OHSO3-+OH- B.④的pH与①不同,是由于SO32-浓度减小造成的 C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致 D.①与④的KW值相等 答案:C 解析:由①④时刻溶液加入盐酸酸化的氯化钡溶液,④产生白色沉淀较多,说明升温过程中亚硫酸钠被空气中的氧气氧化为硫酸钠,导致亚硫酸根浓度减小。A项,亚硫酸钠为强碱弱酸盐,在溶液中水解使溶液显碱性,A正确;B项,④与①的pH不同是因为亚硫酸钠被空气中的氧气氧化为硫酸钠,导致亚硫酸根浓度减小,溶液pH减小,正确;C项,升高温度,水解平衡右移,减小亚硫酸根浓度,平衡左移,错误;D项,①与④的温度相同,则水的离子积常数KW相同,正确。 5.常温下,下列溶液中的微粒浓度关系正确的是( )。 A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) D.0.4 mol·L-1 CH3COOH溶液与0.2 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) 9 答案:D 解析:新制氯水中加入固体NaOH,根据电荷守恒c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),A错误;碳酸氢钠溶液中碳酸氢根离子水解程度大于电离程度,c(H2CO3)>c(CO32-),B错误;C项,NH3·H2O是弱电解质,pH=11的氨水物质的量浓度比pH=3的盐酸的物质的量浓度大得多,氨水与盐酸反应后,氨水剩余,溶液呈碱性,离子浓度大小为c(NH4+)>c(Cl-)>c(OH-)>c(H+),C错误;0.4mol·L-1的CH3COOH溶液与0.2mol·L-1的NaOH溶液等体积混合后得到0.1mol·L-1的CH3COOH溶液和0.1mol·L-1的CH3COONa溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-);依据物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH);两式合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),D正确。 6.(2019全国Ⅰ改编)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中Q点为反应终点。下列叙述错误的是( )。 A.混合溶液的导电能力与离子浓度和种类有关 B.Na+与A2-的导电能力之和大于HA-的 C.Q点的混合溶液pH=7 D.M点的混合溶液中,c(Na+)>c(K+)>c(OH-) 答案:C 解析:随着NaOH溶液的加入,混合溶液中离子浓度和种类发生变化,因此混合溶液的导电能力与离子浓度和种类有关,A项正确;P点的混合溶液中能导电的离子主要为HA-和K+,Q点为反应终点,因此Q点的混合溶液中能导电的离子主要为A2-、K+、Na+,故Na+与A2-的导电能力之和大于HA-的,B项正确;Q点的混合溶液中含有的A2-能发生水解反应而使溶液呈碱性,C项错误;Q点为反应终点,因此Q点的混合溶液中c(Na+)=c(K+)>c(OH-),继续加入氢氧化钠溶液后,M点的混合溶液中c(Na+)>c(K+)>c(OH-),D项正确。 7.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )。 选项 现象或事实 解 释 A 用热的烧碱溶液洗去油污 Na2CO3可直接与油污反应 B 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 C 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 K2CO3与NH4Cl反应生成氨气会降低肥效 9 D FeCl3溶液可用于铜质印刷线路板制作 FeCl3能从含Cu2+的溶液中置换出铜 答案:C 解析:A选项,烧碱是NaOH,错误;B选项,漂白粉变质是因为Ca(ClO)2与空气中的CO2反应,生成CaCO3、HClO,HClO见光分解,错误;D选项,原因是Fe3+与Cu反应生成Fe2+与Cu2+,错误。 8.(2019河南中原名校高三上学期第五次联考)25 ℃时,有下列几种浓度均为0.1 mol·L-1的溶液,下列说法正确的是( )。 A.0.1 mol·L-1NaHSO3溶液的pH=4,则水电离出的c(H+)=10-4 mol·L-1 B.物质的量浓度均为0.1 mol·L-1的Na2CO3和NaHCO3等体积混合,溶液中2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) C.pH=a的NaClO溶液中加入Na2CO3溶液后,溶液pHc(NH4+)>c(SO32-) C.物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小关系:④>①>②>③ D.0.10 mol·L-1 CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) 答案:D 解析:没有给出Na2CO3和NaHCO3的量的关系,若二者的物质的量浓度相等,则离子浓度之间的关系正确,A项错误;根据电荷守恒有c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),溶液pH=7即c(H+)=c(OH-),所以c(NH4+)+c(Na+)=c(HSO3-)+2c(SO32-),根据物料守恒有c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),进而有c(NH4+)+c(H2SO3)=c(SO32-),故有c(Na+)>c(SO32-)>c(NH4+),B项错误;Fe2+的水解抑制NH4+的水解,HCO3-的水解促进NH4+的水解,则c(NH4+)的大小关系为④>①>③>②,C项错误;根据电荷守恒有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)+c(Cl-),溶液pH=7即c(H+)=c(OH-),即 9 c(Na+)=c(CH3COO-)+c(Cl-),根据物料守恒有c(Na+)=c(CH3COO-)+c(CH3COOH),因此c(CH3COOH)=c(Cl-),综合分析得c(Na+)>c(CH3COOH)=c(Cl-),D项正确。 10.25 ℃时,满足c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是( )。 A.该温度下醋酸的电离常数Ka为10-4.75 mol·L-1 B.M点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) D.Q点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液充分反应后pH>7 答案:B 解析:醋酸的电离常数等于c(CH3COO-)×c(H+)c(CH3COOH),Q点时醋酸根离子和醋酸的物质的量浓度相等,则Ka=c(H+)=10-4.75mol·L-1,A正确;M点溶液中电荷守恒,则c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两边加上c(CH3COOH),可知c(Na+)+c(H+)+c(CH3COOH)=c(OH-)+0.1mol·L-1,B错误;从Q→Nc(CH3COO-)逐渐增大,溶液呈酸性,电离大于水解,所以离子浓度大小顺序为c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),C正确;Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后得到醋酸钠溶液,为强碱弱酸盐溶液,溶液呈碱性,pH>7,D正确。 二、非选择题(本题共3个小题,共50分) 11.(16分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系: ①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+) ③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-) 填写下列空白: (1)若溶液中只含有一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。 (2)若四种离子的关系符合③,则溶质为 ;若四种离子的关系符合④,则溶质为 。 (3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是 (填字母)。 9 (4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。 答案:(1)NH4Cl ① (2)NH4Cl和NH3·H2O NH4Cl和HCl (3)B (4)小于 大于 解析:(1)由已知的四种离子可知,当溶液中只存在一种溶质时,为NH4Cl;NH4Cl为强酸弱碱盐,NH4+水解使溶液呈酸性,离子浓度关系符合①。 (2)四种离子的关系符合③时,溶液呈碱性,说明碱过量,则溶液中存在的溶质为NH4Cl和NH3·H2O;当四种离子的关系符合④时,溶液呈强酸性,溶液中存在NH4Cl和HCl。 (3)加水稀释酸性溶液,使溶液中的c(H+)减小,则pH增大,NH4Cl为强酸弱碱盐,稀释促进其水解,产生H+,盐酸为强酸,在溶液中全部电离,稀释过程中不会产生H+,pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,盐酸的pH大于NH4Cl溶液的,B项符合。 (4)体积相等的稀盐酸和氨水混合,若c(HCl)=c(NH3·H2O),则得到NH4Cl溶液,溶液呈酸性,因得到的溶液为中性,则c(NH3·H2O)应略大于c(HCl)。 12.(18分)已知25 ℃时部分弱电解质的电离平衡常数数据如表所示: 化学式 CH3COOH H2CO3 HClO 电离平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8 回答下列问题: (1)物质的量浓度均为0.1 mol·L-1的四种溶液: A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3 pH由小到大排列的顺序是 。 9 (2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。 A.c(H+) B.c(H+)c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)c(H+) E.c(H+)·c(CH3COO-)c(CH3COOH) (3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。 (4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。 (5)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: ①c(OH-)=2c(H2CO3)+ ; ②c(H+)+c(Na+)= 。 答案:(1)A查看更多