- 2021-08-24 发布 |
- 37.5 KB |
- 9页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省上饶中学2020届高三化学6月高考模拟试题(Word版附答案)
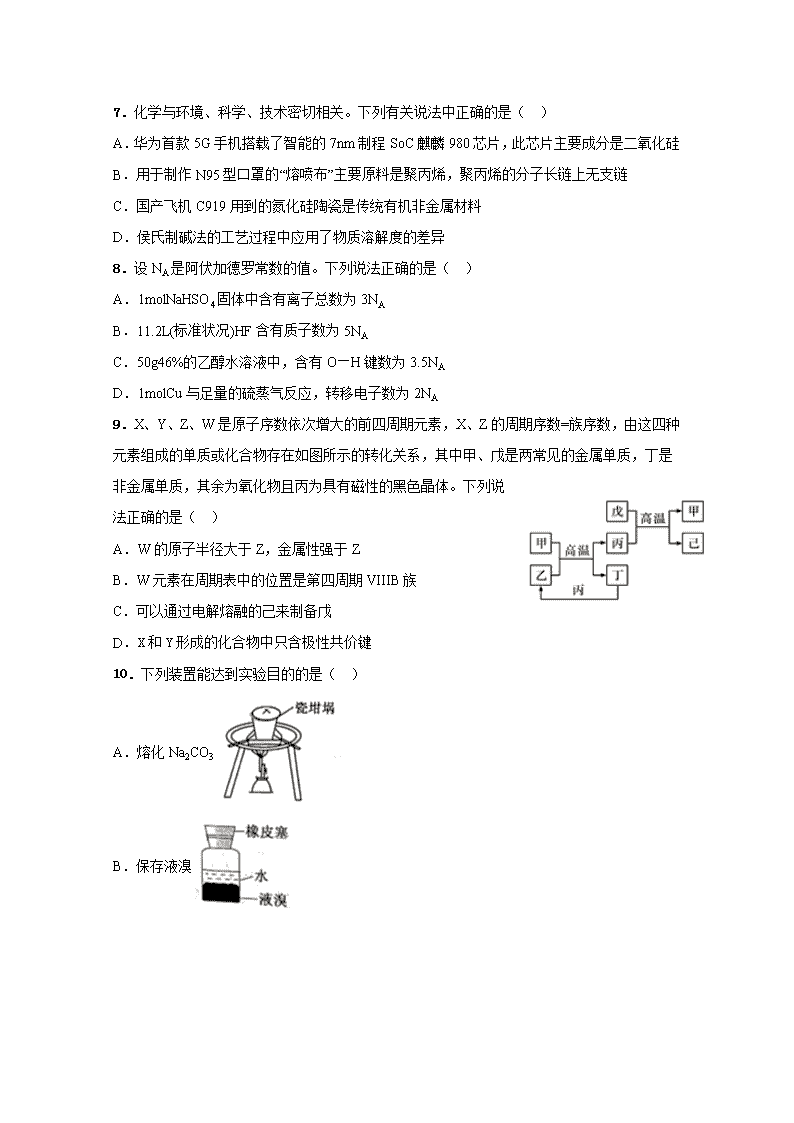
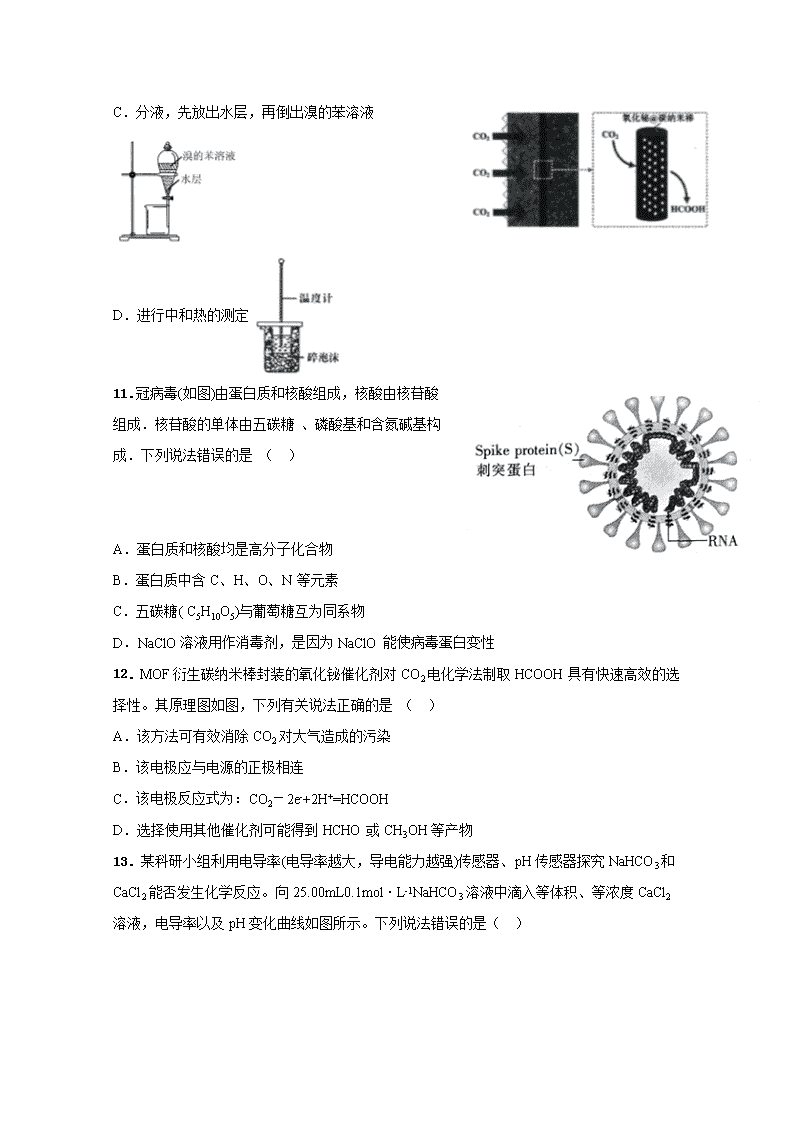
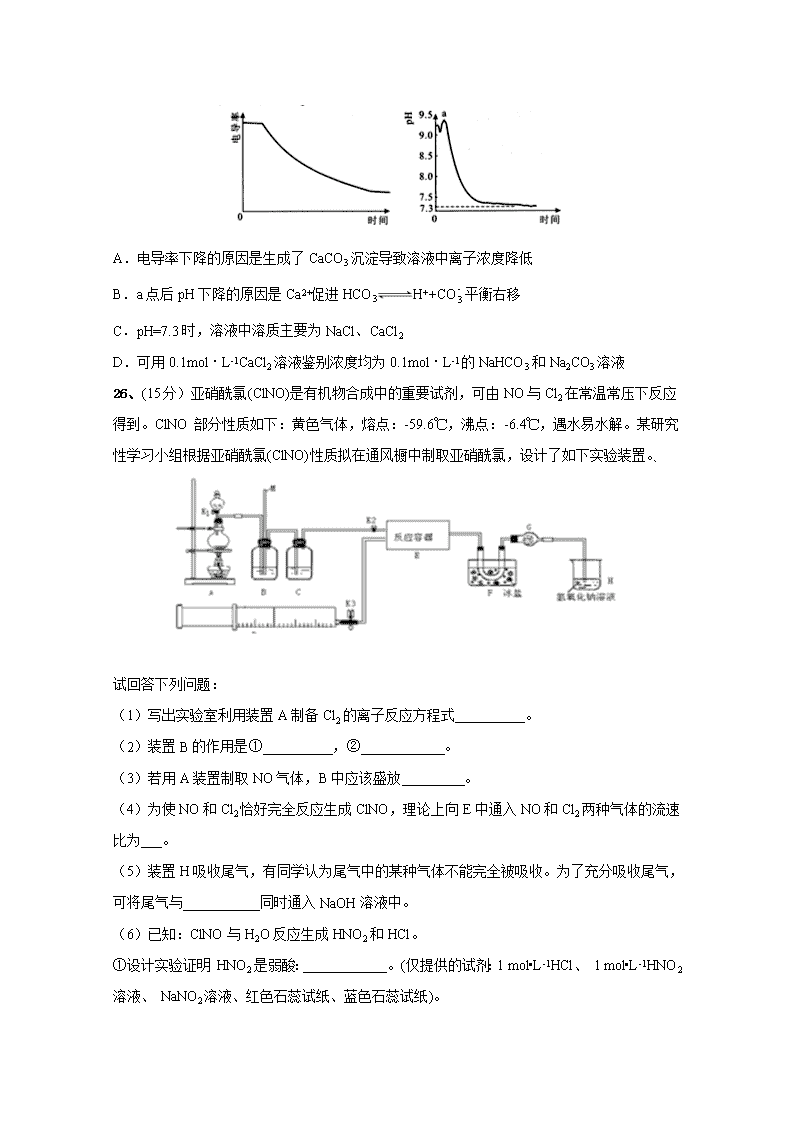
7.化学与环境、科学、技术密切相关。下列有关说法中正确的是( ) A.华为首款 5G 手机搭载了智能的 7nm 制程 SoC 麒麟 980 芯片,此芯片主要成分是二氧化硅 B.用于制作 N95 型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链 C.国产飞机 C919 用到的氮化硅陶瓷是传统有机非金属材料 D.侯氏制碱法的工艺过程中应用了物质溶解度的差异 8.设 NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.1molNaHSO4 固体中含有离子总数为 3NA B.11.2L(标准状况)HF 含有质子数为 5NA C.50g46%的乙醇水溶液中,含有 O—H 键数为 3.5NA D.1molCu 与足量的硫蒸气反应,转移电子数为 2NA 9.X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z 的周期序数=族序数,由这四种 元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是 非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说 法正确的是( ) A.W 的原子半径大于 Z,金属性强于 Z B.W 元素在周期表中的位置是第四周期 VIIIB 族 C.可以通过电解熔融的己来制备戊 D.X 和 Y 形成的化合物中只含极性共价键 10.下列装置能达到实验目的的是( ) A.熔化 Na2CO3 B.保存液溴 C.分液,先放出水层,再倒出溴的苯溶液 D.进行中和热的测定 11.冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸 组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构 成.下列说法错误的是 ( ) A.蛋白质和核酸均是高分子化合物 B.蛋白质中含 C、H、O、N 等元素 C.五碳糖( C5H10O5)与葡萄糖互为同系物 D.NaClO 溶液用作消毒剂,是因为 NaClO 能使病毒蛋白变性 12.MOF 衍生碳纳米棒封装的氧化铋催化剂对 CO2 电化学法制取 HCOOH 具有快速高效的选 择性。其原理图如图,下列有关说法正确的是 ( ) A.该方法可有效消除 CO2 对大气造成的污染 B.该电极应与电源的正极相连 C.该电极反应式为:CO2-2e-+2H+=HCOOH D.选择使用其他催化剂可能得到 HCHO 或 CH3OH 等产物 13.某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH 传感器探究 NaHCO3 和 CaCl2 能否发生化学反应。向 25.00mL0.1mol·L-1NaHCO3 溶液中滴入等体积、等浓度 CaCl2 溶液,电导率以及 pH 变化曲线如图所示。下列说法错误的是( ) A.电导率下降的原因是生成了 CaCO3 沉淀导致溶液中离子浓度降低 B.a 点后 pH 下降的原因是 Ca2+促进 HCO3 H++CO - 3 平衡右移 C.pH=7.3 时,溶液中溶质主要为 NaCl、CaCl2 D.可用 0.1mol·L-1CaCl2 溶液鉴别浓度均为 0.1mol·L-1 的 NaHCO3 和 Na2CO3 溶液 26、(15 分)亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由 NO 与 Cl2 在常温常压下反应 得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究 性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、 试回答下列问题: (1)写出实验室利用装置 A 制备 Cl2 的离子反应方程式__________。 (2)装置 B 的作用是①__________,②____________。 (3)若用 A 装置制取 NO 气体,B 中应该盛放_________。 (4)为使 NO 和 Cl2 恰好完全反应生成 ClNO,理论上向 E 中通入 NO 和 Cl2 两种气体的流速 比为___。 (5)装置 H 吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气, 可将尾气与___________同时通入 NaOH 溶液中。 (6)已知:ClNO 与 H2O 反应生成 HNO2 和 HCl。 ①设计实验证明 HNO2 是弱酸:____________。(仅提供的试剂:1 mol•L-1HCl、 1 mol•L-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。 ②通过以下实验测定 ClNO 样品的纯度。取 F 中所得液体 3.0 g 溶于水,配制成 250 mL 溶液; 取出 25.00 mL 样品溶于锥形瓶中,用 0.20 mol•L-1 AgNO3 标准溶液滴定至终点, 根据表中所给信息,应选用____________做指示剂。 物质 Ag2CrO4 AgCl AgI Ag2S 颜色 砖红色 白色 黄色 黑色 Ksp 1×10-12 1.56×10-10 8.3×10-17 6.3 ×10-50 消耗标准 AgNO3 溶液的体积为 20.00ml,亚硝酰氯(ClNO)的质量分数为________。 27、(14 分)2020 年 5 月 5 日晚 18 时 00 分,我国载人空间站货物返回舱试验舱在我国文昌航 天发射场点火升空, 5 月 8 日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得 圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是 Be 和 MgF2)为原料制备金属铍的工艺流 程。如图: 已知:MgF2 和 CaF2 难溶于水。回答下列问题: (1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式 为 H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。 (2)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学 方程式为__________________________________________________;已知(NH4)2BeF4 易溶于 水,且其在水中的溶解度随温度的升高而大幅度增大,从 NH4F 与滤液Ⅱ发生反应后所得溶液 中获得(NH4)2BeF4 晶体的“一系列操作”具体是指____________________过滤、洗涤、干燥。 (3) “分解”过程中产生的 BeF2 在熔融状态下不能导电,其电子式为_____________;“还原” 过程可以用金属镁制备金属铍的原因是__________________________。 28、(14 分)碳及其化合物在工农业生产和日常生活中有广泛的应用,对其研究具有重要意义。 回答下列问题: (1)利用活性炭的_________作用可去除水中的悬浮杂质。 (2)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速将 SO2 氧化为 SO3,其活化过程 中的能量变化如图所示: (3)已知:CO(g)+2H2(g) CH3OH(g) ∆H,经测定不同温度下该反应的浓度平衡常数 如下: ①该反应的 △ H____0(填“>”或“<");250℃时,某时刻测得反应体系中 c(CO)=0.4mol·L-1、 c(H2)=0.4mol·L-1、c(CH3OH)=0.8mol·L-1,则此时 v 正______v 逆(填“>”、“=”或“<”)。. ②某温度下,在 2L 刚性容器中,充入 0.8molCO 和 1.6molH2,压强为 p,tmin 后达到平衡, 测得压强为 2 3 P。则 v(H2)= ______mol·L-1·min-1,平衡时的 Kp=______。 (4)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了 Y2O3 与 ZrO2 的固体,可在高温下传导 O2-。 ①该电池工作时负极反应方程式为 ___________________________。 ②用该电池电解 100mL 饱和食盐水,若在两极产生的气体体积分别为 V1L、V2L(标准状况), 且 V1>V2,则电解所得溶液的 c(OH-)=____________mol·L-1(忽略气体溶解和溶液体积变化)。 35、(15 分)[化学——选修 3:物质结构与性质]铁系元素是人体必需的微量元素, Fe3+可 以与 KSCN 溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够 维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。 (1)Fe3+的基态核外电子排布式为____________________。 (2)与 SCN−互为等电子体且为非极性分子的化学式为__________(任写一种)。 (3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个 K+,又知该晶体中铁元素有+2 价和+3 价两种,则 Fe3+与 Fe2+的个数比为_________。 (4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高 3 倍,在图乙中画出 Fe2+与 N 原子间的化学键(若是配位键,需要用箭头加以表示)______________ (5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为___________;晶胞是图中的 (填 a、b 或 c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面 体几何体的体积是 2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为 NA,则镁的摩 尔质量的计算式是________________。 36、(15 分)[化学——选修 5:有机化学基础]氟他胺 G 是一种可用于治疗肿瘤的药物。实 验室由芳香烃 A 制备 G 的合成路线如图: 请回答下列问题: (1)A 的化学名称为_________;C 中官能团的名称是____________。 (2)③的反应试剂和反应条件分别是______,该反应类型是_________。 (3)T(C7H7NO2)是 E 在碱性条件下的水解产物,同时符合下列条件的 T 的同分异构体有______ 种。其中核磁共振氢谱上有 4 组峰且峰面积比为 1:2:2:2 的物质的结构简式为 _______________。 ①—NH2 直接连在苯环上②能与新制氢氧化铜悬浊液共热产生红色固体 (4)参照上述合成路线,以 CH3CH2COCl 和 为原料,经三步合成某化工 产品 的路线为___(其他无机试剂任)。 上饶中学高三高考模拟考试(参考答案) 化学部分 7.D 8.C 9.C 10.C 11.C 12.D 13.D 26.(15 分)(除标注外,每空 2 分) (1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2)除去挥发的 HCl 气体(1 分)平衡容器内压强(1 分) (3)H2O (4)2:1 (5)O2 (6)用玻璃棒蘸取 NaNO2 溶液,点在红色石蕊试纸上,试纸变蓝,说明 HNO2 是弱酸 K2CrO4 溶液(1 分) 87.3% 27.(14 分)(除标注外,每空 2 分) (1)粉碎废渣、增大 HF 溶液的浓度适当升高温度、充分搅拌(写两项即可)(每空 1 分) Be+4HF=H2BeF4+H2↑ (2)HF、NH4FCaF2+H2SO4 (浓) Δ CaSO4+2HF↑ 蒸发浓缩、冷却结晶 (3) 镁的还原性比铍强 28. (14 分)(除标注外,每空 2 分) (1)吸附(1 分) (2)0.18(1 分)催化(1 分) (3)①<(1 分)<② 0.4 t 2 9 p (4)①CH4-8e-+4O2-=CO2+2H2O ② 2 12V -V 1.12 或 2 150V -25V 28 36.(15 分)(除标注外,每空 2 分) (1)[Ar]3d5(或 1s22s22p63s23p63d5) (2) CO2 或 CS2 (3)1∶1 (4) (5)六方最密堆积 c(1 分) 12 12NAaρ 36.(15 分)(除标注外,每空 2 分) (1)甲苯 氟原子 (2)浓硫酸和浓硝酸、加热 取代反应(或硝化反应) (3)13 (4) (3 分)查看更多