2020年高考化学二轮复习第二部分考前仿真模拟七习题含解析
考前仿真模拟(七)
时间:50分钟 满分:100分
可能用到的相对原子质量 H:1 C:12 O:16 Na:23 S:32 Cl:35.5
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括7个小题,每小题6分,共42分。每小题仅有一个选项符合题意)
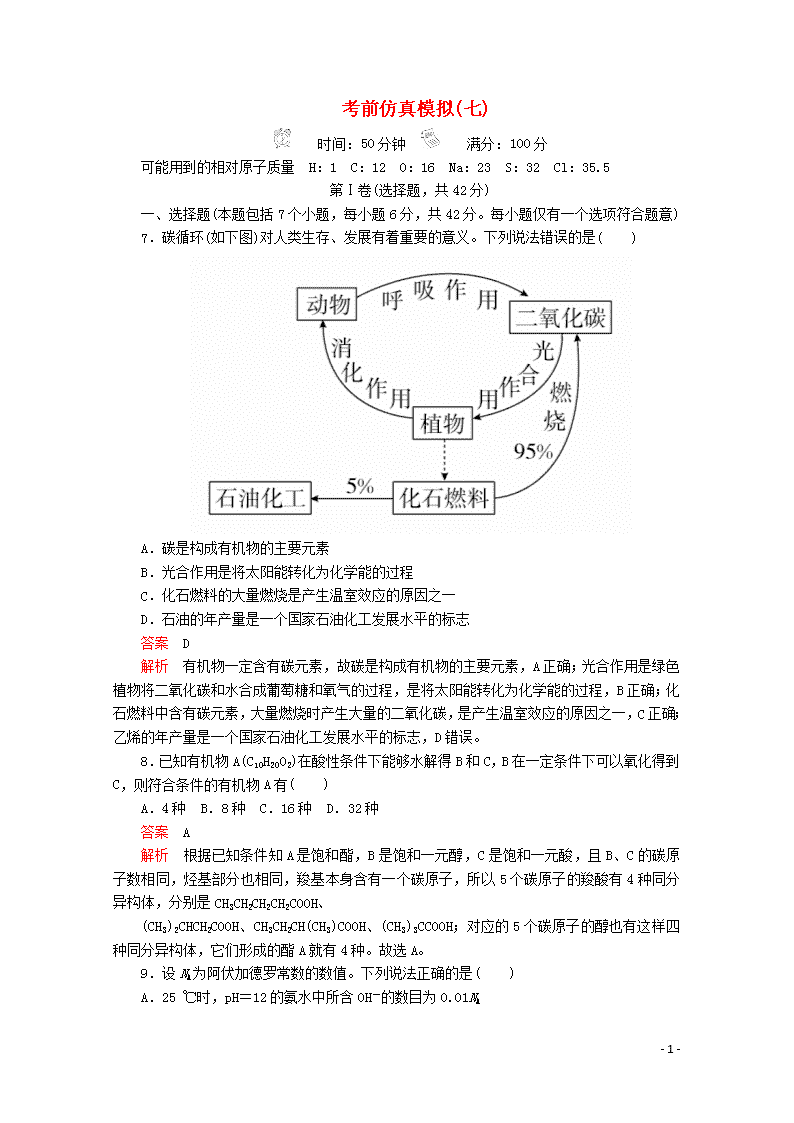
7.碳循环(如下图)对人类生存、发展有着重要的意义。下列说法错误的是( )
A.碳是构成有机物的主要元素
B.光合作用是将太阳能转化为化学能的过程
C.化石燃料的大量燃烧是产生温室效应的原因之一
D.石油的年产量是一个国家石油化工发展水平的标志
答案 D
解析 有机物一定含有碳元素,故碳是构成有机物的主要元素,A正确;光合作用是绿色植物将二氧化碳和水合成葡萄糖和氧气的过程,是将太阳能转化为化学能的过程,B正确;化石燃料中含有碳元素,大量燃烧时产生大量的二氧化碳,是产生温室效应的原因之一,C正确;乙烯的年产量是一个国家石油化工发展水平的标志,D错误。
8.已知有机物A(C10H20O2)在酸性条件下能够水解得B和C,B在一定条件下可以氧化得到C,则符合条件的有机物A有( )
A.4种 B.8种 C.16种 D.32种
答案 A
解析 根据已知条件知A是饱和酯,B是饱和一元醇,C是饱和一元酸,且B、C的碳原子数相同,烃基部分也相同,羧基本身含有一个碳原子,所以5个碳原子的羧酸有4种同分异构体,分别是CH3CH2CH2CH2COOH、
(CH3)2CHCH2COOH、CH3CH2CH(CH3)COOH、(CH3)3CCOOH;对应的5个碳原子的醇也有这样四种同分异构体,它们形成的酯A就有4种。故选A。
9.设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.25 ℃时,pH=12的氨水中所含OH-的数目为0.01NA
- 14 -
B.36 g由35Cl和37Cl组成的氯气中所含质子数一定为17NA
C.7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA
D.30 g由甲醛(HCHO)与乙酸混合的溶液中所含C—H键的数目为2NA
答案 C
解析 题中缺少溶液体积,无法计算溶液中氢氧根离子数目,A错误;35Cl和37Cl的物质的量之比不确定,故36 g由35Cl和37Cl组成的氯气中所含质子数也不确定,B错误;Na2O2与足量酸性KMnO4溶液反应时只作还原剂,1 mol Na2O2失去2 mol电子,7.8 g Na2O2的物质的量为0.1 mol,转移的电子数为0.2NA,C正确;1 mol甲醛(HCHO)含有2 mol C—H,1 mol乙酸含有3 mol C—H,甲醛(HCHO)与乙酸的最简式相同,但物质的量之比不确定,故所含C—H键的数目不确定,D错误。
10.短周期主族元素X、Y、Z、R、W原子序数依次递增,且Y原子半径在这5种原子中最小,R单质是将太阳能转化为电能的常用材料,X和R原子最外层电子数相同;W2-的最外层为8电子结构,单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )
A.简单离子半径W>Y>Z
B.化合物ZY和RY4化学键类型相同
C.W、R最高价氧化物均能与水反应,且生成的酸的酸性W>R
D.W的最高价氧化物对应的水化物在与X单质反应时既显氧化性又显酸性
答案 A
解析 短周期主族元素X、Y、Z、R、W的原子序数依次增大,R单质是将太阳能转化为电能的常用材料,R为Si元素;X和R原子最外层电子数相同,则X为C元素;W2-的最外层为8电子结构,W为S元素;单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,Z为钠元素,燃烧生成的产物为过氧化钠;Y原子半径在这5种原子中最小,则Y可能为N、O、F中的一种,根据选项B的物质组成,Y为F元素。电子层越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,简单离子半径S2->F->Na+,A正确;化合物ZY和RY4分别为NaF和SiF4,分别为离子化合物和共价化合物,化学键类型不同,B错误;W、R最高价氧化物分别为三氧化硫和二氧化硅,二氧化硅不能与水反应,C错误;W的最高价氧化物对应的水化物为硫酸,浓硫酸与C单质反应生成二氧化碳和二氧化硫,只表现氧化性,D错误。
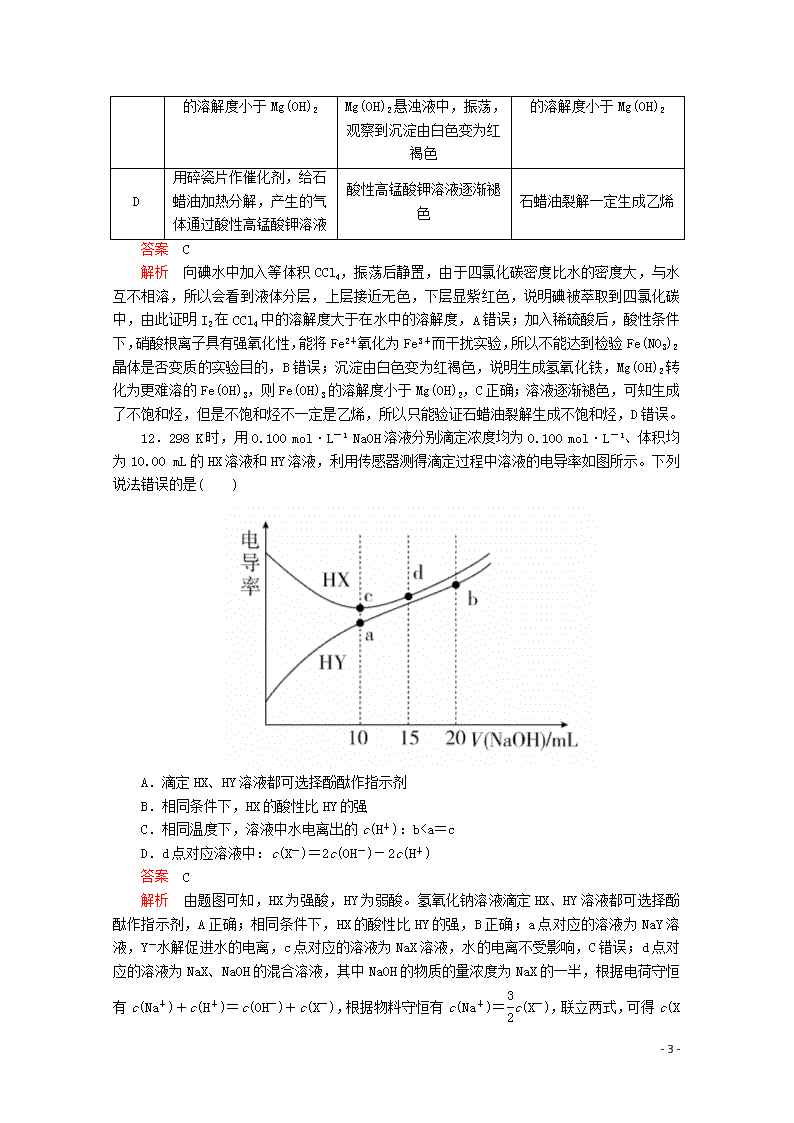
11.(2019·山东师大附中高三模拟)由下列实验、现象以及由现象推出的结论均正确的是( )
选项
实验方法
现象
结论
A
向碘水中加入等体积CCl4,振荡后静置
下层接近无色,上层显紫红色
I2在CCl4中
的溶解度大于在水中的溶解度
B
检验Fe(NO3)2
晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
检验Fe(NO3)2
晶体是否已氧化变质
C
验证Fe(OH)3
将FeCl3
验证Fe(OH)3
- 14 -
的溶解度小于Mg(OH)2
溶液加入Mg(OH)2悬浊液中,振荡,观察到沉淀由白色变为红褐色
的溶解度小于Mg(OH)2
D
用碎瓷片作催化剂,给石蜡油加热分解,产生的气体通过酸性高锰酸钾溶液
酸性高锰酸钾溶液逐渐褪色
石蜡油裂解一定生成乙烯
答案 C
解析 向碘水中加入等体积CCl4,振荡后静置,由于四氯化碳密度比水的密度大,与水互不相溶,所以会看到液体分层,上层接近无色,下层显紫红色,说明碘被萃取到四氯化碳中,由此证明I2在CCl4中的溶解度大于在水中的溶解度,A错误;加入稀硫酸后,酸性条件下,硝酸根离子具有强氧化性,能将Fe2+氧化为Fe3+而干扰实验,所以不能达到检验Fe(NO3)2晶体是否变质的实验目的,B错误;沉淀由白色变为红褐色,说明生成氢氧化铁,Mg(OH)2转化为更难溶的Fe(OH)3,则Fe(OH)3的溶解度小于Mg(OH)2,C正确;溶液逐渐褪色,可知生成了不饱和烃,但是不饱和烃不一定是乙烯,所以只能验证石蜡油裂解生成不饱和烃,D错误。
12.298 K时,用0.100 mol·L-1 NaOH溶液分别滴定浓度均为0.100 mol·L-1、体积均为10.00 mL的HX溶液和HY溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )
A.滴定HX、HY溶液都可选择酚酞作指示剂
B.相同条件下,HX的酸性比HY的强
C.相同温度下,溶液中水电离出的c(H+):b
9溶解)
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需_________________。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO或Cr2O),以便于与杂质离子分离;另一方面是___________________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________________________。
(5)钠离子交换树脂的原理为:Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
________Na2Cr2O7+________SO2+________ ________===_______Cr(OH)(H2O)5SO4+________Na2SO4。
答案 (1)65.2 250 mL容量瓶、胶头滴管
- 14 -
(2)沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2~3次
(3)2Fe2++H2O2+2H+===2Fe3++2H2O
(4)Fe3+、Al3+
(5)Ca2+、Mg2+
(6)1 3 11 H2O 2 1
解析 (1)由于实验室中没有200 mL的容量瓶,故配制200 mL 4.8 mol·L-1的硫酸溶液时需要用250 mL的容量瓶,根据题中数据可求出浓硫酸的物质的量浓度为 mol·L-1=18.4 mol·L-1,设配制该硫酸溶液时需要量取的浓硫酸的体积为V,则18.4 mol·L-1×V=4.8 mol·L-1×250 mL,解得V≈65.2 mL。
(3)加入H2O2不仅能氧化Cr3+,还能将Fe2+氧化成Fe3+:2Fe2++H2O2+2H+===2Fe3++2H2O。
(4)根据表格中数据可知当调节溶液的pH=8时,Al3+和Fe3+均完全转化成沉淀除去。
(5)根据硫酸浸取液中含有Cr3+、Fe2+、Fe3+、Al3+、Ca2+、Mg2+及题给流程图可知,被交换的杂质离子应为Ca2+和Mg2+。
(6)根据得失电子守恒和原子守恒可配平该反应的化学方程式。
28.(2019·广东重点中学高三期末联考)(14分)燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1 mol/L (NH4)2SO3溶液的pH________(填“>”“<”或“=”)7。将烟气通入(NH4)2SO3溶液可以继续吸收SO2,用离子方程式表示出能吸收二氧化硫的原因__________________。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g)N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是________(填选项编号)。
A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290 ℃、催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230 ℃,向容器中投入0.5 mol CO2和1.5 mol H2,当转化率达80%时放出热量19.6 kJ能量,写出该反应的热化学方程式______________。
②一定条件下,往2 L恒容密闭容器中充入1.0 mol CO2和3.0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图1所示:
- 14 -
催化剂效果最佳的是催化剂________(填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v正________v逆(填“>”“<”或“=”)。此反应在a点时已达平衡状态,a点的转化率比c点高的原因是______________________________________。已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字)(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________________。
答案 (1)> SO+SO2+H2O===2HSO
(2)BD (3)①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49 kJ/mol ②Ⅰ > 该反应为放热反应,温度升高,平衡逆向移动 8.3×10-4或 kPa-2
(4)加入催化剂 将容器的体积快速压缩至2 L
解析 (1)已知NH3·H2O的电离平衡常数大于H2SO3的Ka2,则在(NH4)2SO3溶液中NH的水解能力小于SO的水解程度,可知溶液显碱性,即pH>7;(NH4)2SO3溶液吸收SO2生成NH4HSO3,发生反应的离子方程式为SO+SO2+H2O===2HSO。
(2)在恒容条件下,能判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,各组分含量不变。单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g),说明反应逆向进行,不能说明反应达到平衡状态,故A不符合;碳是固体,当平衡发生移动,气体质量会发生变化,容器体积不变,所以混合气体的密度不再发生改变可以说明反应达到平衡状态,故B符合;反应前后气体总物质的量不变,反应体系的压强始终不发生改变,不能判定平衡,故C不符合;C为固体,混合气体的平均相对分子质量保持不变,可知气体的质量不变,为平衡状态,故D符合。
(3)①已知0.5 mol CO2和1.5 mol H2转化率达80%时放热19.6 kJ,则该反应的热化学方程式:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-=-49 kJ·mol-1;
- 14 -
②由图像知:催化剂Ⅰ在较低温度T3时CO2就达到最大转化率,催化剂效果最佳的是催化剂Ⅰ,T3的b点时,反应未达到限度,故v正>v逆;该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低,T4的a点转化率比T5的c点高。c点时:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
: 1 3 0 0
: 0.6 1.8 0.6 0.6
: 0.4 1.2 0.6 0.6
在恒容恒温条件下,气体的压强与气体的物质的量成正比,则平衡时总压强p总=100 kPa×=70 kPa,该反应的平衡常数Kp=≈8.3×10-4 kPa-2。
(4)图像分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,说明改变的条件是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量浓度突然增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变。曲线Ⅰ,体积为3 L,平衡时一氧化碳浓度为3 mol/L,改变条件变为曲线Ⅲ,平衡时一氧化碳浓度为4.5 mol/L,则3∶V=4.5∶3,V=2 L,所以将容器的体积快速压缩至2 L满足条件。
三、选考题(两个题中任选一题作答,共15分)
35.[化学——选修3:物质结构与性质](15分)
目前,广泛推广使用的磷酸铁锂电池的工作原理为
LiFePO4+CLixC+Li1-xFePO4。
回答下列问题:
(1)LiFePO4中基态铁粒子的价层电子排布图为________________。基态碳原子s能级、p能级上电子数之比为________。
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是________(填元素符号),判断依据是___________________;NH3的键角略大于PH3,从原子结构角度说明原因:_______________。
(3)卤素与磷可形成多种磷化物。例如,PCl3、PBr3等。PCl3中磷的杂化类型为________;PBr3的空间构型为________。与PO互为等电子体的分子有____________________(填一种即可)。
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图Ⅰ所示,1 mol 足球烯含________个π键。
- 14 -
(5)锂、铁单质晶胞分别如图Ⅱ、图Ⅲ所示,铁、锂晶胞的配位数之比为________。图Ⅱ晶胞的堆积方式是________________(填名称)。
(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。金刚石中C—C键的键长为________pm(用代数式表示)。
答案 (1) 2∶1
(2)N N和P位于同主族,N的原子半径小于P,N的第一电离能大于P;N和O位于同周期,N原子的2p能级达到半充满的稳定状态,N的第一电离能大于O
N的原子半径小于P,氢氮键之间排斥力大于氢磷键
(3)sp3 三角锥形 CCl4、SiCl4、CBr4、SiF4等(任写一种) (4)30NA (5)3∶2 体心立方堆积
(6)× ×1010
解析 (1)LiFePO4中含亚铁离子,Fe2+的价层电子排布式为3d6,由此可得其价层电子排布图。基态碳原子的核外电子排布式为1s22s22p2。
(2)N和P位于同主族,N的原子半径小于P,所以,N的第一电离能大于磷;N和O位于同周期,N的2p能级达到半充满的稳定状态,O的2p能级上有4个电子,所以,N的第一电离能大于O,故这三种元素中N的第一电离能最大。N的原子半径小于P,NH3分子中H—N键之间的排斥力大于PH3中H—P键,所以NH3分子的键角大于PH3。
(3)PCl3分子中P原子的价层电子对数为4,其杂化类型为sp3。PBr3分子中P的价层电子对数为4,有1个孤电子对,其空间构型呈三角锥形。与PO互为等电子体的分子有CCl4、CBr4、SiF4、SiCl4、SiBr4等。
(4)足球烯中每个碳原子形成两个单键、一个双键,每个键为两个碳原子共有,一个双键中含一个σ键和一个π键,则每个碳原子净摊个π键,1个C60含30个π键。
(5)图Ⅱ、Ⅲ晶胞中配位数分别为8、12,配位数之比为2∶3。图Ⅱ晶胞的堆积方式为体心立方堆积。
(6)设金刚石的晶胞参数为a cm,一个金刚石晶胞含8个碳原子,由ρ=得,a=2× 。设碳碳键键长为R,其等于体对角线长度的1/4,则有(4R)2=3a2 cm2,R=a cm=× ×1010 pm。
36.(2019·北京师大附中高三期中)[化学——选修5:有机化学基础](15分)
- 14 -
色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如下:
已知:
(1)A的结构简式是________;根据系统命名法,F的名称是________。
(2)B→C所需试剂a是________;试剂b的结构简式是________。
(3)C与足量的NaOH反应的化学方程式为____________________________。
(4)G与银氨溶液反应的化学方程式为___________________。
(5)已知:①2HJ+H2O;②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出下列化合物的结构简式:_____________。
- 14 -
答案 (1) 1-丙醇 (2)Br2和Fe(或FeBr3)
(4)CH3CH2CHO+2Ag(NH3)2OH
CH3CH2COONH4+2Ag↓+3NH3+H2O
- 14 -
解析 A的分子式是C6H6,结构简式为,A发生硝化反应生成B,B为,由D的结构简式及反应条件,可知C为。F的分子式是C3H8O,能催化氧化生成醛基,则含有—CH2OH结构,结构简式为CH3CH2CH2OH,F催化氧化生成G,G为CH3CH2CHO,G催化氧化生成H,H为CH3CH2COOH。
(2)B→C是苯环上的溴代反应,则试剂a为Br2和Fe(或FeBr3);由D的结构简式和已知①,可知试剂b为。
(3)C与足量的NaOH反应为卤代烃的水解反应和酸碱中和反应。
(4)G与银氨溶液发生醛基的氧化反应。
(5)由D的结构简式和已知①可知,E为
- 14 -
- 14 -