- 2021-08-24 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习人教版硫及其化合物作业
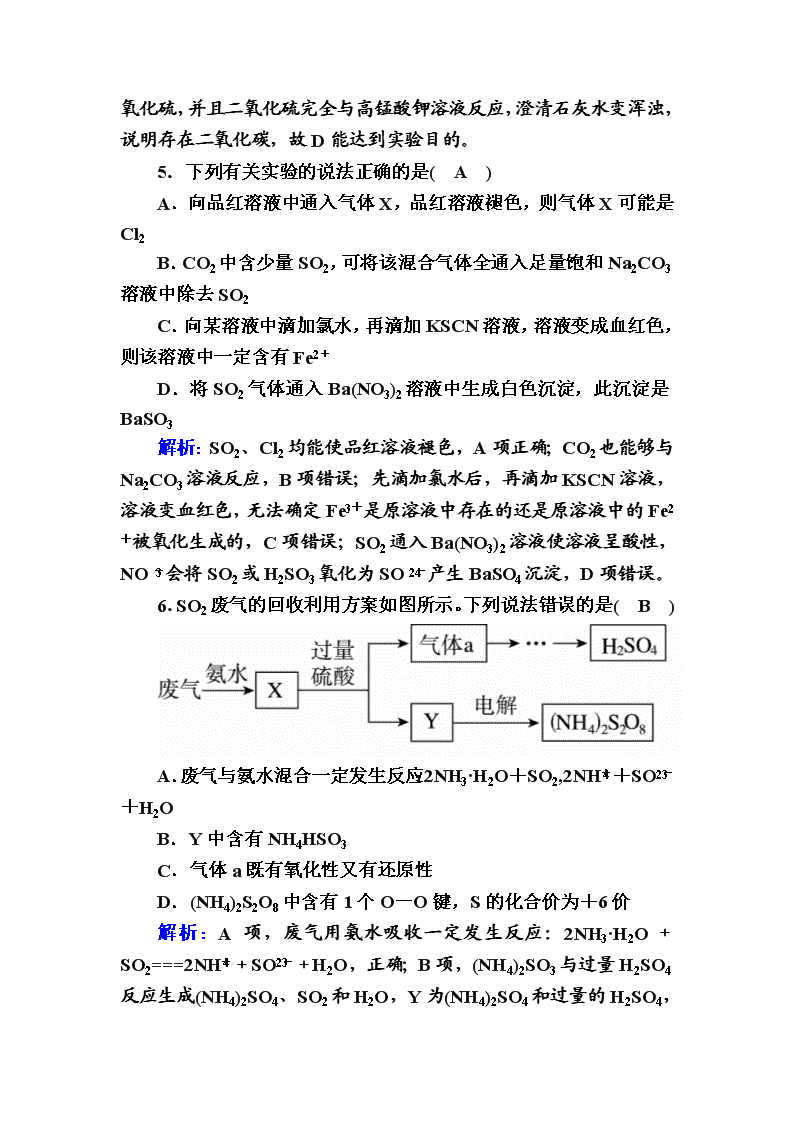
硫及其化合物 时间:45分钟 1.酸雨形成的示意图如下。下列说法中,不正确的是( C ) A.汽车尾气是导致酸雨的原因之一 B.酸雨会使土壤、湖泊酸化 C.酸雨形成中不涉及氧化还原反应 D.燃煤中加入石灰石可防治酸雨 解析:NO2→HNO3、SO2→H2SO4等过程中均发生了氧化还原反应。 2.有以下六种溶液:①Ba(OH)2溶液②Ba(NO3)2溶液 ③KMnO4溶液 ④品红试液 ⑤Na2SiO3溶液 ⑥NaHCO3溶液,可用于区分CO2和SO2这两种气体的有( B ) A.2种 B.3种 C.4种 D.5种 解析:本题考查元素化合物知识以及氧化还原反应等。①Ba(OH)2溶液与CO2、SO2反应现象相同,均可得到白色沉淀,CO2、SO2过量时,沉淀再溶解;②CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液反应可得到BaSO4沉淀;③SO2可使KMnO4溶液褪色,而CO2不能;④SO2可使品红溶液褪色,而CO2不能;⑤Na2SiO3溶液与CO2、SO2反应现象相同,均得到白色沉淀;⑥CO2通入NaHCO3溶液中不反应,逸出气体,SO2通入NaHCO3溶液中虽反应,但同CO2的现象相同,也是逸出气体,无法鉴别。故可用于区别CO2、SO2的物质有3种。B项正确。 3.下列说法中,正确的是( A ) A.在BaCl2溶液中通入SO2气体,溶液仍澄清,滴入3%的过氧化氢溶液有白色沉淀产生 B.可以用澄清石灰水来鉴别SO2与CO2 C.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 D.SO2能使溴水褪色,体现了SO2的漂白性 解析:盐酸的酸性强于亚硫酸,因此BaCl2溶液中通入SO2,二者不反应,溶液仍澄清,SO2具有还原性,H2O2具有强氧化性,二者发生反应H2O2+SO2,H2SO4、BaCl2+H2SO4,2HCl+BaSO4↓,溶液中有白色沉淀产生, 故A正确;SO2和CO2都能使澄清石灰水变浑浊,故B错误;硫无论在空气中还是纯氧中燃烧,产物均是SO2,故C错误;SO2使溴水褪色,发生反应SO2+Br2+2H2O,H2SO4+2HBr,体现了SO2的还原性,故D错误。故选A。 4.为了检验浓硫酸与木炭加热后产生的三种物质。将混合气体慢慢通过检验试剂,并记录现象。下列实验能够达到实验目的的是( D ) 解析: 溶液中逸出的气体中带有水蒸气,会干扰原有水蒸气的检验,所以需要先检验水蒸气,故A不能达到实验目的;酸性高锰酸钾溶液紫色褪去,不能保证二氧化硫与高锰酸钾完全反应,残留的二氧化硫会干扰二氧化碳的检验,故B、C不能达到实验目的;无水硫酸铜变蓝说明存在水蒸气,酸性高锰酸钾溶液紫色变浅,说明存在二氧化硫,并且二氧化硫完全与高锰酸钾溶液反应,澄清石灰水变浑浊,说明存在二氧化碳,故D能达到实验目的。 5.下列有关实验的说法正确的是( A ) A.向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 B.CO2中含少量SO2,可将该混合气体全通入足量饱和Na2CO3溶液中除去SO2 C.向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成血红色,则该溶液中一定含有Fe2+ D.将SO2气体通入Ba(NO3)2溶液中生成白色沉淀,此沉淀是BaSO3 解析:SO2、Cl2均能使品红溶液褪色,A项正确;CO2也能够与Na2CO3溶液反应,B项错误;先滴加氯水后,再滴加KSCN溶液,溶液变血红色,无法确定Fe3+是原溶液中存在的还是原溶液中的Fe2+被氧化生成的,C项错误;SO2通入Ba(NO3)2溶液使溶液呈酸性, NO会将SO2或H2SO3氧化为SO产生BaSO4沉淀,D项错误。 6.SO2废气的回收利用方案如图所示。下列说法错误的是( B ) A.废气与氨水混合一定发生反应:2NH3·H2O+SO2,2NH+SO+H2O B.Y中含有NH4HSO3 C.气体a既有氧化性又有还原性 D.(NH4)2S2O8中含有1个O-O键,S的化合价为+6价 解析:A项,废气用氨水吸收一定发生反应:2NH3·H2O+SO2===2NH+SO+H2O,正确;B项,(NH4)2SO3与过量H2SO4反应生成(NH4)2SO4、SO2和H2O,Y为(NH4)2SO4和过量的H2SO4 ,不含NH4HSO3,错误;C项,气体a为SO2,SO2中S元素的化合价为+4价,既有氧化性又有还原性,正确;D项,(NH4)2S2O8中含有一个O-O键,其中O元素的化合价为-1价,剩下6个O原子中O元素的化合价为-2价,N元素的化合价为-3价,H元素的化合价为+1价,根据化合物中各元素正负化合价代数和为0,可得S元素的化合价为+6价,正确。故选B。 7.下表所示有关物质检验的实验结论正确的是( D ) 解析:A项,该溶液中也可能含Ag+;B项,该溶液中也可能含HSO;C项,该气体也可能是Cl2、O3等。故选D。 8.为探究Na2SO3溶液的性质,某学习小组设计了一系列实验,并记录实验现象,具体如下表所示。 则以下说法不正确的是( B ) A.Na2SO3溶液具有漂白性 B.Ksp(Ag2SO4)<Ksp(Ag2SO3) C.实验③,SO与Cu2+发生了氧化还原反应 D.实验④发生反应的离子方程式为:3SO+2Al3++3H2O===2Al(OH)3↓+3SO2↑ 解析:A.Na2SO3溶液能使品红溶液褪色,说明Na2SO3溶液具有漂白性,故A正确;B.在饱和Ag2SO4溶液中滴加Na2SO3溶液有白色沉淀生成,说明Ksp(Ag2SO4)>Ksp(Ag2SO3),故B错误;C.CuSO4溶液中滴加Na2SO3溶液,溶液先变绿,继续滴加产生砖红色沉淀,说明生成Cu2O沉淀,则SO与Cu2+发生了氧化还原反应,故C正确;D.Al2(SO4)3溶液中滴加Na2SO3溶液,产生白色沉淀,并有刺激性气味的气体生成,说明溶液中存在双水解反应,发生反应的离子方程式为3SO+2Al3++3H2O===2Al(OH)3↓+3SO2↑,故D正确。故选B。 9. 如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是( B ) A.关闭K2,打开K1,滴加硫酸,则装置B中每消耗1 mol Na2O2,转移电子数为NA B.关闭K1,打开K2,试剂X是酸性KMnO4或FeCl3溶液,均可证明SO2有还原性 C.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性 解析:A.装置B中发生的反应为SO2+Na2O2===Na2SO4,则每消耗1 mol Na2O2,转移电子数为2NA,选项A错误;B.关闭K1,打开K2,试剂X是酸性KMnO4或FeCl3溶液,产生的二氧化硫能被氧化而使溶液褪色或变色,均可证明SO2有还原性,选项B正确;C.为防止环境污染,装置C和E中的试剂均取用浓的氢氧化钠溶液,保证将未反应的二氧化硫吸收完全,避免造成污染,选项C错误;D.实验过程中体现了硫酸的强酸性、难挥发性,二氧化硫的还原性,选项D错误。答案为B。 10.实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( B ) A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ C.装置D中品红溶液褪色可以验证SO2的漂白性 D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 解析:A.铁丝与浓硫酸反应生成SO2,因为酸性高锰酸钾具有强氧化性,装置B中酸性高锰酸钾溶液褪色,体现了SO2的还原性,故A说法正确;B.浓硫酸具有强氧化性,可能把生成的Fe2+氧化成Fe3+,因此不能检验是否铁丝和浓硫酸反应生成的是Fe3+,故B说法错误;C.品红溶液褪色,体现SO2的漂白性,故C说法正确;D.导管a的作用是使内外压强相同,防止装置B中的溶液倒吸,故D说法正确。故选B。 11.某校化学兴趣小组探究SO2与FeCl2溶液的反应,所用装置如图所示(夹持仪器已略去)。 (1)实验前,应先检查装置的________;实验中产生的尾气应通入________溶液中。 (2)实验过程中需要配置100 mL 1 mol·L-1FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、________。 (3)该小组同学向5 mL 1 mol·L-1FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是__________________________ ______________________________________________。 (4)该小组同学在进行(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。 查阅资料,Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO。SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+的原因是________________; Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是________________________________________________________________________。 (5)若实验中用5 mL一定浓度的浓硫酸与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mol·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓硫酸的浓度为________。(忽略过程中溶液的体积变化) 解析: (1)在制取气体之前应先检查装置的气密性;实验中产生的二氧化硫尾气用NaOH溶液吸收。 (2)配制100 mL 1 mol·L-1FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100 mL的容量瓶。 (3)向FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,则发生反应:2Fe3++SO2+2H2O===2Fe2++SO+4H+,再逐滴加入NaOH稀溶液时,开始时OH-先中和H+,无明显现象,后来产生Fe(OH)2白色沉淀。 (4)SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+的原因是Fe3+与H2SO3电离出的HSO结合生成Fe(HSO3)2+。Fe(HSO3)2+被Fe3+氧化为SO,Fe3+被还原为Fe2+,根据得失电子守恒、电荷守恒、原子守恒配平离子方程式:Fe3++H2O+Fe(HSO3)2+===2Fe2++SO+3H+。 (5)Cu2+恰好完全沉淀时得到Na2SO4溶液,根据钠元素守恒,n(Na2SO4)=n(NaOH)=×4 mol·L-1×0.03 L=0.06 mol,根据硫元素守恒,有n(H2SO4)=n(SO2)+n(Na2SO4)=+0.06 mol=0.03 mol+0.06 mol=0.09 mol,c(H2SO4)==18 mol·L-1。 答案:(1)气密性 NaOH (2)100 mL的容量瓶、胶头滴管 (3)一开始无明显现象,后来生成白色沉淀 (4)Fe3+与亚硫酸电离出的HSO结合生成Fe(HSO3)2+ Fe3++H2O+Fe(HSO3)2+===2Fe2++SO+3H+ (5)18 mol·L-1 12.SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。 (1)二氧化硫的水溶液 ①SO2易溶于水,常温常压下溶解度为1∶40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3 固体,有气体冒出,原因是________________。(结合有关平衡方程式简要说明) ②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:A→________________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为________________________________________________________________________。 (2)二氧化硫的还原性 已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出) 解析:(1)② 次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与漂白粉溶液直接反应判断亚硫酸与次氯酸的酸性强弱,应先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强,间接作出判断。A装置制备二氧化硫,由于浓盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠溶液除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液除去二氧化碳中的二氧化硫,用品红溶液检验二氧化硫是否除尽,再通入F中。(2)A中制备二氧化硫,X干燥二氧化硫,C中是SO2与Na2O2反应,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气。E装置检验I-还原性弱于SO2,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气。 答案:(1)①SO2的水溶液中存在如下平衡:SO2+H2OH2SO3H++HSO,加入NaHSO3固体增大了c(HSO),平衡左移,SO2增多,从饱和溶液中逸出 ②C→B→E→D→F D中品红溶液不褪色,F中产生白色沉淀 (2)①Na2O2+SO2===Na2SO4 ②溶液蓝色褪去 ③SO2+I2+2H2O===2I-+SO+4H+ ④红色变浅或褪色查看更多