【化学】黑龙江省大庆市第四中学2019-2020学年高二下学期第一次月考
黑龙江省大庆市第四中学2019-2020学年高二下学期第一次月考
考试时间:90分钟 分值:100 分
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
第Ⅰ卷(选择题、共48分)
可能用到的相对原子质量:H- 1 、C -12、 N -14 、O -16、 Na -23 、 Ca - 40
一、选择题(每小题只有一个选项是正确的,共16小题,每题3分,共48分)
1、设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.1molNa2O2与SO2完全反应,转移2NA个电子
B.标准状况下,11.2L乙醇中含有的极性共价键数目为3.5NA
C.18g的D2O中含有的中子数为10NA
D.1L 0.1mol·L-1 Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
2、用下列实验装置进行相应实验,能达到实验目的是 ( )
A.用所示装置分离CCl4和I2的混合物
B.用所示装置获取少量SO2气体
C.用所示装置除去CO2气体中的少量SO2
D.用所示装置蒸发NaCl溶液获得NaCl晶体
3、下列有关物质分类或归类中,正确的是( )
①混合物:盐酸、漂白粉、氯水、水银 ②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
A.①③ B.②③ C.③④ D.④
4、化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“朝坛雾卷,曙岭烟沉”中的雾是一种气溶胶,能产生丁达尔效应
B.“丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是升华和凝华过程
C.“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),该过程中发生了分解反应
D.“曾青得铁则化为铜”,其原理和现代湿法冶金一致
5、室温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.0.1 mol·L-1 KI溶液:Na+、K+、ClO-、OH-
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
C.0.1 mol·L-1 HCl溶液:Ba2+、K+、CH3COO-、NO
D.0.1 mol·L-1 NaOH溶液:Mg2+、Na+、SO、HCO
6、下列关于离子方程式的评价正确的是( )
选项
离子方程式
评价
A
将2 mol Cl2通入含1 mol FeI2的溶液中:
2Fe2++4I-+3Cl2===2Fe3++6Cl-+2I2
正确;Cl2过量,Fe2+、I-均被氧化
B
用Cu作电极电解NaCl溶液,阳极的电极反应式:
2Cl--2e-===Cl2↑
正确;Cl-优先于OH-放电
C
过量SO2通入NaClO溶液中:
SO2+H2O+ClO-===HClO+HSO
正确;H2SO3的酸性强于HClO
D
Mg(HCO3)2溶液与足量的NaOH溶液反应:
Mg2++2HCO+2OH-===MgCO3↓+2H2O
正确;MgCO3比Mg(OH)2更难溶
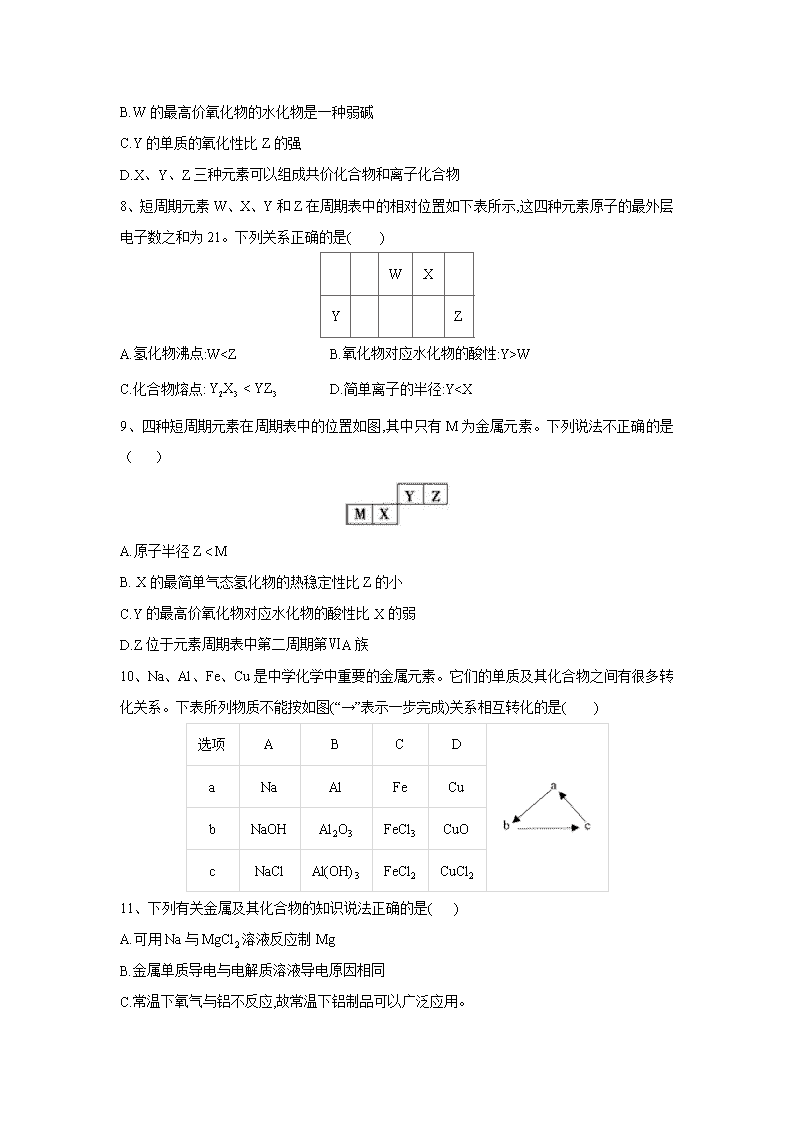
7、短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是( )
A.原子半径:
B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强
D.X、Y、Z三种元素可以组成共价化合物和离子化合物
8、短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A. 氢化物沸点:W
W
C.化合物熔点: D.简单离子的半径:Y c(HCO3-)> c(H+)= c(OH-)> c(CO32-)
16、某反应aA(g) + bB(g) cC(g)⊿H<0, 在体积为2L的密闭容器中反应.在I、II、III不同阶段体系中改变某一条件,体系中各物质的量(mol)随时间变化的曲线如图所示。下列说法不正确的是:
A. 该反应的化学反应方程式为:A + 3B 2C
B. 用物质A表示第I阶段20分钟内平均反应速率为:v(A)=0.025mol.L-1.min-1
C. 三个阶段反应的平衡常数关系为:KI v(B)II > v(B)III,各段内转化率AI%> AII%>AIII%
第Ⅱ卷(非选择题、共52分)
17、(共8分))已知A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是__________(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式__________________________________________。
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为__________________(用离子符号表示)。
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为________,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是__________。
(4)D、A、C和碳元素组成的化合物的水溶液呈________性,用离子方程式解释其原因_________________________________________________________________________。
18、(共14分)技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如下图:
(1)向沉淀池中要通入CO2和氨气,应先通入 (填化学式)。
(2)沉淀池中发生反应的化学方程式 。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是 ,加入细小食盐颗粒的作用是 。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 (填化学式)。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 。
(5)侯氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中碳酸钠的纯度为: 。
19、(共17分)氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为____ ______。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
①根据如图判断该反应的△H___________0(填“>”“<”或“=”)。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=_______________________,反应的平衡常数K=____________(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有________(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为_________________________________
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________
(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
20、(共13分)已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备AlCl3.
(1)装置A中发生反应的离子方程式为________________________________________
(2)装置B盛放的试剂是______,其作用是_______________________________;
装置C盛放的试剂是__________ ,其作用是__________________________________
(3) 装置G的作用是________________,
G中发生反应的化学方程式是________________________________________
(4)F中盛放的试剂是______,其作用是___________________________________
参考答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A
D
C
B
B
A
D
D
C
B
D
B
D
A
C
C
17、(每空1分,共8分)
(1)H2O SO2+Br2+2H2O===H2SO4+2HBr
(2)N3->O2->Na+>Mg2+>Al3+
(4)碱 HCO+H2OH2CO3+OH-
18、(每空2分,共14分)
(1)NH3(2分)
(2)NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl(2分)
(3)NH4Cl(2分) 增大Cl-浓度,使NH4Cl更多析出(2分)
(4)HClO(2分) 3Cl2+2NH4++8OH-=N2+6Cl-+8H2O(2分)
(5)%(2分)
19、(共17分)
(1)CO2(g)+ 2NH3(g) = CO(NH2)2(s) + H2O(l) △H=-87.0kJ/mol (2分)
(2) ①< (2分) ②0.02mol·L-1·min-1 (2分) 2.025(2分) ③D (2分)
(3) 增大(1分) 2NH3 - 6e- + 6OH- = N2 + 6H2O (2分)
(4) c(Na+)>c(N3-)>c(OH-)>c(H+) (1分) 中(1分) 0.5a-b (2分)
20、 (共13分)
(1) MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (1分)
(2) 饱和食盐水(1分); 除去Cl2中的HCl气体(1分) ; 浓H2SO4(1分) ; 干燥Cl2(或除去Cl2中的水蒸气)(1分)
(3) 吸收多余的Cl2,防止污染环境(2分)
Cl2+2NaOH═NaCl+NaClO+H2O (2分)
(4) 浓H2SO4 (2分)
吸收水蒸气,防止G中水蒸气进入E中使AlCl3遇潮产生白雾(2分)