山东省济南市历城第二中学2021届高三化学10月检测试题(Word版附答案)
历城二中55级10月份学情检测化学试题
可能用到的分子量:H: 1 C: 12 N:14 O: 16 Na: 23 S: 32 Fe: 56 Co: 51
一、 选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生活,科技及环境密切相关,下列说法正确的是( )
A.光分解水制氢气和植物秸秆制沼气都涉及生物质能的利用
B.华为继麒麟980之后自主研发的7nm芯片问世,芯片的主要成分为二氧化硅
C.客机CR929机身大量使用了碳纤维,碳纤维属于有机高分子纤维
D.蜡蛾幼虫会啃食聚乙烯塑料袋,并且能将其转化为乙二醇,这项研究有助于减少白色污染
2.关于NA下列说法正确的是( )
A.常温常压下,17g羟基(—18OH)所含中子数为9NA
B.0.1mol NH3溶于水形成的溶液中,微粒NH3·H2O和微粒NH4+的数目之和为0.1NA
C.常温下电解饱和食盐水,当溶液pH值由7变为12时,电路中转移的电子数为0.01NA
D.标准状况下,足量的甲烷与22.4LCl2(假设氯气完全反应)在光照条件下发生取代反应,形成C-Cl键的数目为NA
3.四氯化锡(SnCl4) 用作媒染剂和有机合成上的氯化催化剂。实验室制备四氯化锡的装置如图(部分夹持装置已略去),已知:①金属锡熔融时通入干燥氯气反应可生成四氯化锡;②无水四氯化锡熔点-33 ℃,沸点114.1 ℃;③无水四氯化锡遇水蒸气生成白色烟雾。下列说法不正确的是( )
A.实验时滴加浓盐酸反应一段时间,然后再点燃④处的酒精灯
B.①、②、⑥、⑦的试管中依次盛装MnO2、饱和食盐水、浓H2SO4、NaOH溶液
C.⑤装置用于收集SnCl4,浸泡在冷水浴中效果更好
D.⑥、⑦两个试管可以用一个装有碱石灰的干燥管来代替
4.食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或
吸收方法正确的是( )
A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
D.石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
5.短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如图所示,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质能与沸水反应,且该单质可制造照明弹,f为固体单质。下列有关说法正确的是 ( )
A.简单离子半径:Y>Z>X B.元素的非金属性:W>X
C.最高价氧化物对应水化物的碱性:Y>Z D.X、Y两种元素组成的化合物只含离子键
6.以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述错误的是( )
A.过程Ⅰ中的能量转化形式是太阳能→化学能
B.过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C.过程Ⅱ的化学方程式为3FeO+H2O(g)Fe3O4+H2↑
D.铁氧化合物循环制H2具有节约能源、产物易分离等优点
7.氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应可制得氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自然,遇水反应。用图示装置制备氮化钡时,下列说法不正确的是( )
A.装置乙中反应的化学方程式为
B.气流由左向右的字母连接顺序为c→a→b→d→e→g→f
C.实验时,先点燃装置乙中的酒精灯,反应一段时间后,再点燃装置丙中的酒精喷灯
D.装置甲中的浓硫酸和装置丁中的碱石灰都是用于吸收水蒸气,防止水蒸气进入装置丙中
8.以太阳能为热源,热化学硫碘循环分解水是一种高效、环保制氢方法,其流程图如下:
相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq);ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) =SO2(g) + H2O(l) +1/2O2(g);ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) =H2(g) + I2(g); ΔH3 = +172 kJ·mol-1
下列说法不正确的是( )
A. 该过程实现了太阳能到化学能的转化
B. SO2和I2对总反应起到了催化剂的作用
C. 总反应的热化学方程式为:2H2O(l)=2H2(g)+O2(g);ΔH = +286 kJ·mol-1
D. 该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
9.下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
NH、Fe2+、SO
少量Ba(OH)2溶液
2NH+SO+Ba2++2O-===BaSO4↓+2NH3·H2O
B
Mg2+、HCO、Cl-(物质的量比1:1:1)
过量NaOH溶液
Mg2++HCO+3OH-=H2O+Mg(OH)2↓+CO
C
K+、NH3·H2O、CO
通入少量CO2
2OH-+CO2==CO+H2O
D
Na+、NO、SO
NaHSO4溶液
SO+2H+===SO2↑+H2O
10.下列实验操作、实验现象和结论均正确的是( )
选项
实验操作
现象
结论
A
常温下,测定等浓度的HCOOK和K2S溶液的pH
pH(HCOONa) < pH(K2S)
Ka(HCOOH)>Ka2 (H2S)
B
向淀粉溶液中加稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热
无砖红色沉淀生成
淀粉没有发生水解
C
加热石蜡
生成的气体能使酸性高锰酸钾溶液褪色
加热石蜡产生的气体一定是乙烯
D
向MgCl2溶液中滴加足量NaOH溶液,再滴加CuCl2溶液
先生成白色沉淀,后又有蓝色沉淀生成
Ksp[Cu(OH)2]
Si
15.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是( )
A. 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应
B. 1mol迷迭香酸最多能和7mol溴水发生反应
C. 迷迭香酸含有五种官能团 D.迷迭香酸属于芳香烃
三.非选择题:本大题共5小题,共60分。
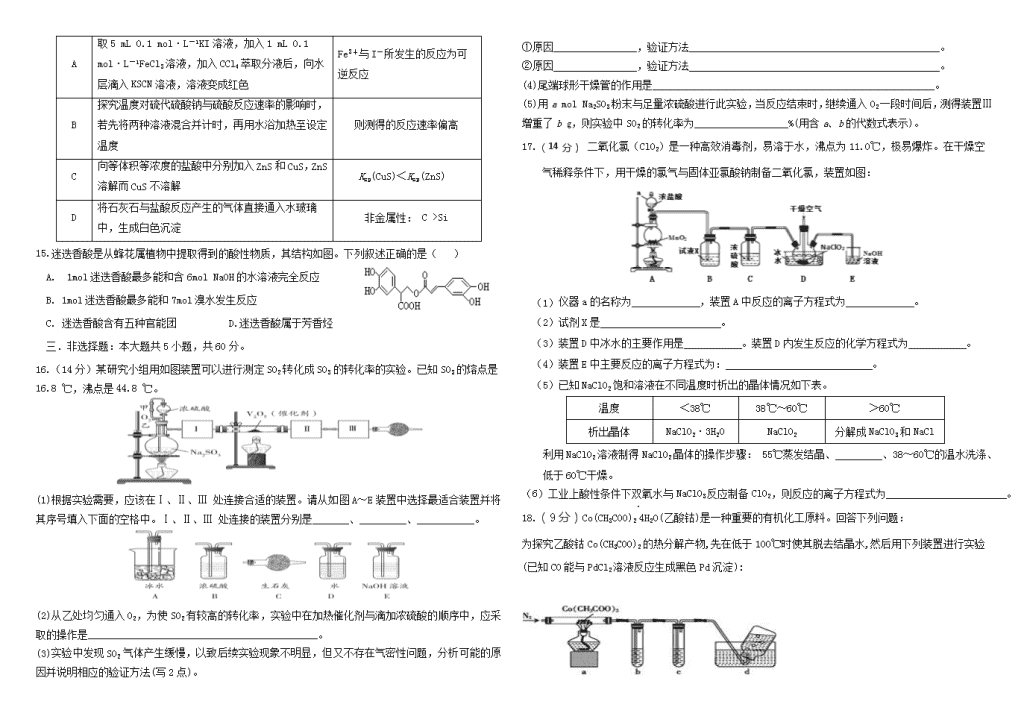
16.(14分)某研究小组用如图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ 处连接合适的装置。请从如图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ 处连接的装置分别是_______、_________、___________。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________________________________________。
(3)实验中发现SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,分析可能的原因并说明相应的验证方法(写2点)。
①原因________________,验证方法________________________________________________。
②原因________________,验证方法________________________________________________。
(4)尾端球形干燥管的作用是______________________________________________________。
(5)用a mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了b g,则实验中SO2的转化率为__________________%(用含a、b的代数式表示)。
17.(14分) 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸。在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:
(1) 仪器a的名称为 ,装置A中反应的离子方程式为 。
(2)试剂X是 。
(3)装置D中冰水的主要作用是 。装置D内发生反应的化学方程式为 。
(4)装置E中主要反应的离子方程式为: 。
(5)已知NaClO2饱和溶液在不同温度时析出的晶体情况如下表。
温度
<38℃
38℃~60℃
>60℃
析出晶体
NaClO2·3H2O
NaClO2
分解成NaClO3和NaCl
利用NaClO2溶液制得NaClO2晶体的操作步骤: 55℃蒸发结晶、 、38~60℃的温水洗涤、低于60℃干燥。
(6)工业上酸性条件下双氧水与NaClO3反应制备ClO2,则反应的离子方程式为 。
18.(9分)Co(CH3COO)2⋅4H2O(乙酸钴)是一种重要的有机化工原料。回答下列问题:
为探究乙酸钴Co(CH3COO)2的热分解产物,先在低于100℃时使其脱去结晶水,然后用下列装置进行实验(已知CO能与PdCl2溶液反应生成黑色Pd沉淀):
①通N2的目的是_________________________。
②澄清石灰水和PdCl2溶液分别用于检验CO2和CO,其中盛放PdCl2溶液的装置是_________(填字母)。
③实验结束时,为防止倒吸,正确的操作是___________________________。
④装置a中完全反应后得到钴的一种氧化物,固体残留率(固体样品的剩余质量固体样品的起始质量×100%)为45.4%.该氧化物的化学式为____ _______。(相对原子质量:Co 59)
19.(9分)氟化铬CrF3可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物
Fe(OH)3
Mg(OH)2
Cr(OH)3
Fe(OH)2
开始沉淀的pH
2.3
8.8
4.9
7.5
沉淀完全的pH
4.1
10.4
6.8
9.7
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有 种。
(2)将铬云母矿石粉碎的目的是 。
(3)滤渣1主要成分的用途是 。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为__ _。
(5)第一次滴加氨水调节pH范围为 。
(6)第二次滴加氨水调节pH为6.8∼8.8的目的是 ,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:
。
20.(14分)工业上常用钒炉渣(主要含FeO•V2O3,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:
(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,写出该反应的化学方程式 该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。
(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
历城二中55级10月份学情检测化学试题评分标准
1- -10(每小题2分,共20分分)1--5 D D B C C 6--10 C B C B A
11--15 BD C D BD AB(每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得1分,有选错的得0分。)
16.(14分)
(1)B A E(3分)
(2)先加热催化剂再加热浓硫酸(2分)
(3)①Na2SO3变质变成Na2SO4,(1分)取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质;(1分)
②甲中用稀H2SO4代替浓H2SO4 (1分) 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸;(1分)
(4)防止空气中的CO2及水蒸气干扰,造成误差(2分)
(5).(3分)
17.(14分)
(1)分液漏斗(1分) MnO2+2Cl-+4H+= Mn2++Cl2↑+2H2O(2分)
(2)饱和食盐水 (1分)
(3)冷凝ClO2 (2分) 2NaClO2+Cl2=2NaCl+2ClO2 (2分)
(4)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(5)趁热过滤 (2分)
(6)2ClO3-+H2O2+2H+=2 ClO2 + O2+2 H2O(2分)
18.(9分)①排出装置内空气,使反应产生的气体全部进入后续装置;(2分)
②c;(2分)
③先熄灭装置a的酒精灯,冷却后停止通入氮气;(2分)
④Co3O4;(3分)
19. (9分)
(1) 3;(1分)
(2)增大矿石与稀硫酸的接触面积,加快反应速率,提高矿石浸取率;(1分)
(3)光导纤维;(1分)
(4)Cr2O3 +3H2SO4=Cr2(SO4)3+3H2O;(2分)
(5) 4.1⩽pH<4.9;(1分)
(6)使Cr3+完全沉淀;(1分) Cr(OH)3+OH− =CrO2−+2H2O。(2分)
20.(14分)
(1)4FeO•V2O3+4Na2CO3+5O2=8NaVO3+2Fe2O3+4CO2(2分)
V Fe (1分) Fe2O3;(1分)
(2)MgSiO3 Mg3(PO4)2(2分)
(3) HVO3(2分)
(4) 在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条。(2分)
(5) ①溶液由黄色变为蓝色,且半分钟不恢复原色(1分)
②0.08mol·L-1(2分)
③偏低(1分)