- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习素养提升专项练五含解析鲁科版
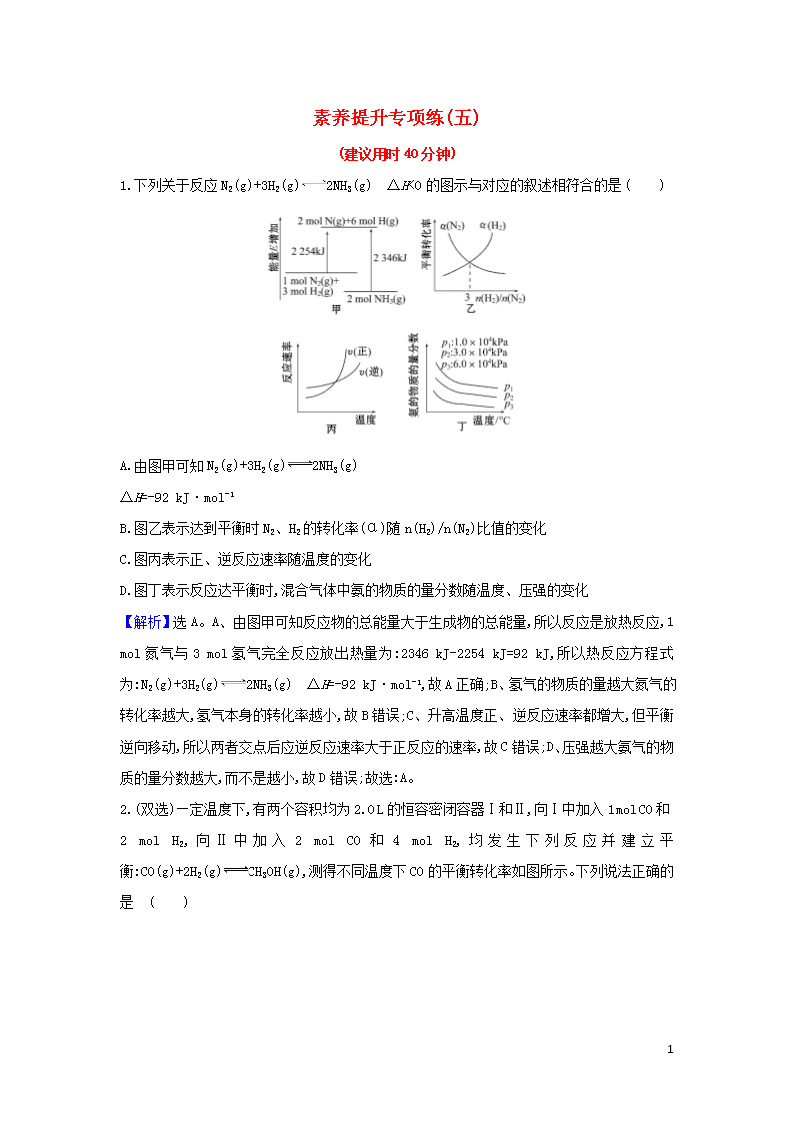
素养提升专项练(五) (建议用时40分钟) 1.下列关于反应N2(g)+3H2(g)2NH3(g) ΔH<0的图示与对应的叙述相符合的是 ( ) A.由图甲可知N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1 B.图乙表示达到平衡时N2、H2的转化率(α)随n(H2)/n(N2)比值的变化 C.图丙表示正、逆反应速率随温度的变化 D.图丁表示反应达平衡时,混合气体中氨的物质的量分数随温度、压强的变化 【解析】选A。A、由图甲可知反应物的总能量大于生成物的总能量,所以反应是放热反应,1 mol氮气与3 mol氢气完全反应放出热量为:2346 kJ-2254 kJ=92 kJ,所以热反应方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1,故A正确;B、氢气的物质的量越大氮气的转化率越大,氢气本身的转化率越小,故B错误;C、升高温度正、逆反应速率都增大,但平衡逆向移动,所以两者交点后应逆反应速率大于正反应的速率,故C错误;D、压强越大氨气的物质的量分数越大,而不是越小,故D错误;故选:A。 2.(双选)—定温度下,有两个容积均为2.0 L的恒容密闭容器Ⅰ和Ⅱ,向Ⅰ中加入1 mol CO和2 mol H2,向Ⅱ中加入2 mol CO和4 mol H2,均发生下列反应并建立平衡:CO(g)+2H2(g)CH3OH(g),测得不同温度下CO的平衡转化率如图所示。下列说法正确的是 ( ) 10 A.该反应的ΔH>0 B.N点的化学平衡常数K=0.59 C.L、M两点容器内压强:p(M)>2p(L) D.向N点平衡体系中再加入1 mol CH3OH,建立新平衡时被分解的CH3OH的物质的量小于0.4 mol 【解析】选C、D。 A.图象分析可知,CO(g)+2H2(g)CH3OH(g),反应中CO转化率随温度升高减小,说明升温逆向移动,逆反应为吸热反应,正反应为放热反应,ΔH<0,A错误;B.根据化学平衡三段式列式计算M点平衡浓度,CO的转化率为60%, CO(g)+2H2(g)CH3OH(g), 起始量 (mol·L-1) 1 2 0 变化量 (mol·L-1) 0.6 1.2 0.6 平衡量 (mol·L-1) 0.4 0.8 0.6 计算平衡常数K==≈2.34,平衡常数随温度变化,M、N点温度相同,化学平衡常数相同,B错误;C.不考虑温度,L、M两点容器内压强之比等于气体的物质的量之比等于1∶2,p(M)=2p(L),但温度升高,M点压强增大,p(M) >2p(L),C正确;D.N点平衡体系中再加入1 mol CH3OH,相当于Ⅰ中再加入1 mol CO和2 mol H2,最后达到平衡状态和Ⅱ中加入2 mol CO和4 mol H2的平衡状态相同,甲醇最后平衡状态为1.2 mol,CO转化率60%,则相当于逆向进行甲醇分解率为40%,加入1 mol甲醇增大压强平衡正向进行,则分解率小于40%,分解的甲醇小于0.4 mol,D正确,答案选CD。 3.(2020·石嘴山模拟)工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g) 10 CH3OCH3(g)+CO2(g),为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3 mol CO、3 mol H2)、体积(10 L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是 ( ) A.X、Y两点对应的正反应速率相等 B.合成二甲醚反应的ΔH>0 C.反应温度应控制在240~260 ℃之间 D.选择合适催化剂,可以提高CO的转化率 【解析】选C。X、Y两点所对应的温度不同,故正反应速率不同,A项错误;CO转化率达到最高后再升温,转化率降低,故合成二甲醚的反应为放热反应,即ΔH<0,B项错误;由图象可知,CO的转化率在240~260 ℃之间可达到最高点,即转化率较大,C项正确;催化剂只能改变化学反应速率,不能使平衡移动,不能提高CO的转化率,D项错误。 4.(2020·邢台模拟)在两个容积均为2 L的恒容密闭容器中,起始时均充入a mol H2S,以温度、Al2O3催化剂为实验条件变量,进行H2S的分解实验[反应为2H2S(g)2H2(g)+S2(g)]。测得的结果如图所示。(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率) 下列说法正确的是 ( ) A.温度升高,H2S分解的速率增大,S2的含量减少 B.由曲线Ⅱ、Ⅲ可知,加入Al2O3可提高H2S的平衡转化率 C.900 ℃时,t s后达到平衡,则H2的生成速率为mol·L-1·s-1 D.约1 100 ℃时,曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性 【解析】选D。根据图示可知,温度升高,H2S转化率增大,说明升高温度,平衡正向移动,S2的含量增大,A项错误;加入Al2O3可提高H2S的分解速率,但不能使化学平衡移动,因此H2S 10 的平衡转化率不变,B项错误;根据图示可知900℃时,H2S的转化率是50%,t s后H2的物质的量为0.5a mol,H2的生成速率为 mol·L-1·s-1,C项错误;根据图示可知,在约1 100 ℃时,曲线Ⅱ,Ⅲ几乎重合,说明不论有无催化剂Al2O3,物质的反应速率基本相同,则Al2O3可能几乎失去催化活性,D项正确。 5. (2020·合肥模拟)在容积一定的密闭容器中,充入一定量的NO和足量碳发生化学反应C(s)+2NO(g)CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是 ( ) A.该反应的ΔH>0 B.在T2时,若反应体系处于状态D,则此时v(正)>v(逆) C.若状态B、C、D的压强分别为pB、pC、pD,则有pC=pD>pB D.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1查看更多