2017-2018学年江苏省盐城市伍佑中学高二12月阶段考试化学试题
2017-2018学年江苏省盐城市伍佑中学高二12月阶段考试
化学试卷
本卷可能用到的相对原子质量 H:1 C:12 N:14 O:16 Ne:20 Na:23 Cl:35.5 Fe:56
Cu:64 Mg:24
第Ⅰ卷(选择题,共69分)
一、单项选择题(本题包括23小题,每题只有1个选项符合题意,每小题3分。)
1.下列物质中既含有离子键又含有共价键的是
A.MgCl2 B.NH4Cl C.H2SO4 D. H2O
2.美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A.47 B.57 C.61 D.293
3.标准状况下,2molCl2和2molH2O相比较,下列叙述中正确的是( )
A.分子数相等 B.原子数相等 C.体积相等 D.质量相等
4.对于熔融状态下进行的反应:TiCl4+4Na == 4NaCl+Ti,下列说法正确的是( )
A.该反应说明钠是强还原剂,可用于冶炼金属 B.TiCl4是还原剂
C.该反应也可以在水溶液中进行 D.该反应中Ti元素被氧化
5.下列反应中生成物总能量高于反应物总能量的是( )
A.氧化钙溶于水 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.碳酸钙受热分解
6.下列化学用语正确的是( )
A.乙烯的结构式:CH2=CH2 B.氮气的结构式:NN
C.硫化氢的电子式: D.氯原子的结构示意图:
7.下列说法错误的是( )
A.稀有气体的原子核外电子排布都是稳定结构
B.让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路”
C.工业上用氮气和氢气合成氨气属于人工固氮过程
D.硅是应用广泛的半导体材料,常温下化学性质活泼
8.下列关于甲烷和乙烯的说法中正确的是
A.甲烷在空气中燃烧,出现明亮的蓝紫色火焰
B.乙烯使酸性KMnO4溶液褪色是因为乙烯被酸性KMnO4溶液氧化
C.甲烷与氯气光照条件下反应生成的三氯甲烷常温下是气态
D.乙烯分子中含一个碳碳双键和两个碳氢单键
9.下列储存药品的方法中,正确的是( )
A.氢氟酸保存在玻璃试剂瓶中 B.浓硝酸保存在棕色试剂瓶中
C.金属钠保存在无水乙醇中 D.烧碱溶液保存在玻璃塞试剂瓶中
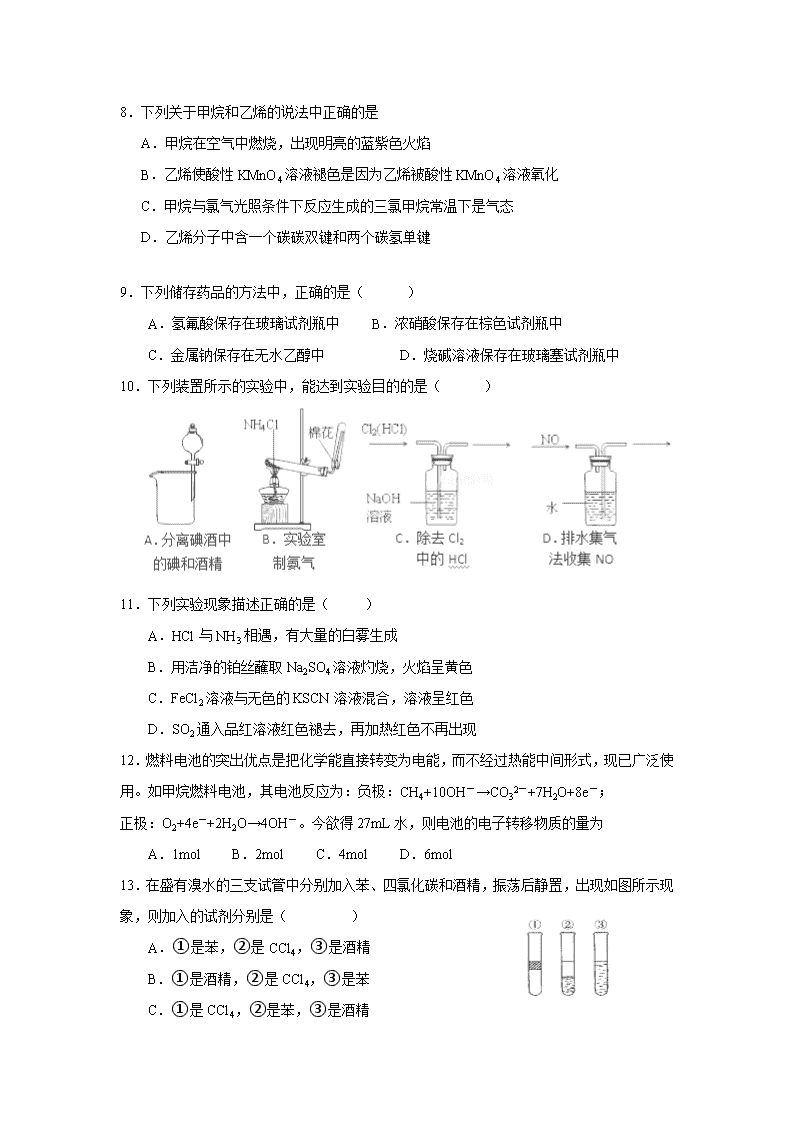
10.下列装置所示的实验中,能达到实验目的的是( )
11.下列实验现象描述正确的是( )
A.HCl与NH3相遇,有大量的白雾生成
B.用洁净的铂丝蘸取Na2SO4溶液灼烧,火焰呈黄色
C.FeCl2溶液与无色的KSCN溶液混合,溶液呈红色
D.SO2通入品红溶液红色褪去,再加热红色不再出现
12.燃料电池的突出优点是把化学能直接转变为电能,而不经过热能中间形式,现已广泛使用。如甲烷燃料电池,其电池反应为:负极:CH4+10OH-→CO32-+7H2O+8e-;
正极:O2+4e-+2H2O→4OH-。今欲得27mL水,则电池的电子转移物质的量为
A.1mol B.2mol C.4mol D.6mol
13.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
A.①是苯,②是CCl4,③是酒精
B.①是酒精,②是CCl4,③是苯
C.①是CCl4,②是苯,③是酒精
D.①是苯,②是酒精,③是CCl4
14.阿伏加德罗常数NA的数值为6.02×1023,下列叙述中正确的是( )
A.1mol H2O 中所含的原子数为2×6.02×1023
B.10克氖气所含的原子数为6.02×1023
C.0.5mol单质镁与足量盐酸反应,转移的电子数为6.02×1023
D.22.4L氯气分子中所含的氯气分子为6.02×1023
15.下列离子方程式书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O
C.向AlCl3溶液中加入过量的氨水溶液:Al3+ + 3OH- = Al(OH)3↓
D.铁和稀硝酸反应:Fe + 2H+ = Fe 2+ + H 2↑
16.下列物质性质的比较,正确的是( )
A.还原性:Na>Mg>Al B.原子半径:P< S
Na2CO3 D.热稳定性:NaHCO3>Na2�CO3>H2CO3
17.用左图表示的一些物质或概念间的从属关系中不正确的是( )
X
Y
Z
A
质子
原子核
原子
B
胶体
分散系
混合物
C
电解质
离子化合物
化合物
D
氧化物
化合物
纯净物
18.下列关于苯的说法中,不正确的是( )
A.分子中含有三个C-C键和三个C=C键
B.在空气中燃烧时产生较多的黑烟
C.分子中C、H元素的质量为12∶1
D.在一定条件下可与氢气发生加成反应
19.下列实验方法正确的是
A.用Ca(OH)2溶液检验碳酸氢钠溶液中是否含有碳酸钠
B.用分液漏斗分离乙酸和乙酸乙酯
C.用盐酸酸化的氯化钡检验某无色溶液中是否含有SO42-
D.用品红溶液鉴别SO2和CO2两种气体
20.下列反应属于取代反应的是( )
A.2CH3CHO + O2 2CH3COOH
B.
C.
D.nCH2=CH2 [ CH2-CH2] n
21.下列说法正确的是( )
A.糖类、油脂、蛋白质都能发生水解反应
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油指、蛋白质都是高分子化合物
D.油脂有油和脂肪之分,但都属于酯
22.X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物是强碱,Z的原子半径最小。据此判断下列说法不正确的是( )
A.X是第ⅠA元素,Z是第ⅦA元素
B.X、Y、Z三种元素的最高化合价逐渐减小
C.Z的最高价氧化物对应的水化物是强酸
D.X、Z形成的化合物是离子化合物
23.1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
第Ⅱ卷(非选择题,共31分)
24.(15分)本题有A、B两题,分别对应于《化学与生活》和《有机化学基础》两个选修模块的内容。请选择其中一题作答,若A、B两题均答,则按A题得分计入总分。
A.《化学与生活》
(1)合理选择饮食、正确使用药物是保证身心健康的重要方面,请填写下列空格。
水在人体内起着十分重要的作用,可以作为溶剂,调节人体体温,还是一种必不可少的反应物。请写出淀粉在人体内完全水解的反应 。人每天都要补充一定量的水,体内体液也有自己的性质,例如人的血液呈 (选填:弱酸性,中性,弱碱性)。我国居民形成了摄入蔬菜和水果偏少的习惯,一般尿液呈 (选填:弱酸性,中性,弱碱性)。
通过食物的调整,人体可以保持健康。可是如果生病了,我们还是要去医院就诊,医生所开的药一般有R标记,表示 (选填:处方药或非处方药)。青霉素的种类比较多,目前临床上广泛使用的青霉素G的钠盐其俗名是 。
阿司匹林的结构简式为 具有的官能团有酯基和 (写
名称)。阿司匹林和水可缓慢水解,该反应的化学方程式为 。
(2)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。请填写下列空格。
A.传统无机硅酸盐材料包括 等三种。
B.合金材料钢铁里的Fe和C在潮湿的空气中因构成许多原电池而易发生电化学腐蚀,正极反应方程式为 。
C.居室装修材料如化纤地毯、三合板等均会释放出污染空气的 气体。
A. 甲醛 B. 氡 C. CO
D.玻璃中加入适量的溴化银(AgBr)和极少量氧化铜的微小晶粒,经过适当的热
处理,可以制成变色玻璃,强光照射变色玻璃变成灰黑色。请写出变色后的玻璃
又变成 无色透明时发生反应的化学方程式 。
(3) 地球环境日益恶化,为了保护环境人类正在尽力治理。下列说法正确的是
A.CO、甲苯、尼古丁等不是室内污染物
B.污水处理方法化学包括混凝法、中和法、沉淀法
C.“白色污染”的会危及海洋生物的生存
D.铅笔芯的原料的重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
E.为防止流感传染,可将教室门窗关闭后,用甲醛熏蒸,进行消毒
F.CO有毒,生有煤炉的居室,可放置数盆水这样可有效地吸收CO,以防煤气中毒
B.《有机化学基础》
⑴(5分)同分异构现象是有机化合物种类繁多的重要原因,正确识别和判断同分异构体是学习有机化学的重要能力。
①下列分子式中不能仅表示一种化学物质的是 。
A.CH4O B. C2H4 C.C2H5Cl A.C2H4O2
②利用核磁共振氢谱可判断出分子式为C2H6O的有机物有两种同分异构体,在核磁共振氢谱上有一种特征峰的有机物的结构简式是 。
③已知C4H9Cl共有四种结构,则分子式为C5H10O的醛有 种同分异构体。
④某有机物X与碳酸钠溶液反应可放出CO2气体,X的分子式为C4H8O2,则X的结构中含有的官能团的名称是 ,X的结构简式可能是 。
⑵(5分)乙酸乙酯广泛应用于化学工业。实验室可用乙酸、乙醇和少量浓硫酸在加热的条件下制备乙酸乙酯,实验装置如图所示。
1 写出乙酸和乙醇反应制取乙酸乙酯的化学反应方程式:
;
②乙酸乙酯不溶于水,密度比水 。(选填“大”或“小”)
③实验室一般用饱和碳酸钠溶液接收反应的生成物,如不振
荡试管,在试管中可以看到的现象是 ,
分离出乙酸乙酯用到的主要仪器的名称是 。
⑶(5分)由乙烯和其他无机原料合成环状化合物E的合成过程如下图所示:
(部分反应条件、水及其他无机产物均已省略)
回答下列问题:
①反应①的类型是___________ ,反应②的类型是 。
②B物质的名称是 。
③C物质的结构简式是___________________。
④B、D在一定条件下除能生成环状化合物E外,还可反应生成一种分子式为C4H6O5的有机物F,则F的结构简式是 。
25.(6分)下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)请回答以下问题:
(1)物质F的化学式为 。
(2)物质D的电子式为 。
(3)反应①的离子方程式为 ;
反应②的化学方程式为 。
26.(10分)工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等)制备MnSO4·H2O 的一种工艺流程如下:
已知:1. 浸出过程中发生的主要反应化学方程式为MnO2+SO2===MnSO4;
2. 浸出液中阳离子主要有Mn2+、Fe2+、Al3+等。
回答下列问题:
(1) 物质X最好选用________(填字母)。 a. 盐酸 b. 硫酸 c. 硝酸
(2) 酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是____________________。
(3) 流程中“氧化”步骤主要反应的离子方程式是________。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除
去。检验Fe3+是否除尽的最佳方法是________________________。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量
MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:① 2Mn2++O2+4OH-===2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+===Mn2++I2+3H2O;
③ I2+2S2O===S4O+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位)(写出计算过程)。
参考答案
一、选择题(每题3分,共69分)
题号
1
2
3
4
5
6
7
8
答案
B
B
A
A
D
B
D
B
题号
9
10
11
12
13
14
15
16
答案
B
D
B
C
A
C
B
A
题号
17
18
19
20
21
22
23
答案
C
A
D
B
D
B
D
二、非选择题(共31分)
24.(15分)
(1)nH2O+(C6H10O5)n→ nC6H12O6
(淀粉) (葡萄糖)
弱碱性、弱酸性、处方药、盘尼西林
羧基(以上每空1分) (方程式略)(此空2分)
(2)玻璃、陶瓷、水泥;O2+2H2O+4e—=4OH-;
CuO
A; 2Ag+Br2 ==== 2AgBr
(3)BC
25.(6分)
(1)HCl (1分)
(2)CaCl2的电子式略(1分)
(3) CO2 + Ca2+ + 2OH-= CaCO3↓+ H2O;(2分)
Ca(ClO)2 + CO2+ H2O= CaCO3↓+ 2HClO(2分)
26.(10分)
(1) b
(2) pH控制在3左右,温度控制在40 ℃左右
(3) MnO2+2Fe2++4H+Mn2++2Fe3++2H2O
(4) 取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+已除尽
(5) n(S2)=5.00×10-3mol·L-1 × 12.0 ×10-3 L= 6.00×10-5 mol
O2 ~ 2MnO(OH)2~2I2~4S2
1 mol 4 mol
n(O2) 6.00×10-5 mol
n(O2)=1.50×10-5 mol
水样中溶解氧的浓度为1.50×10-5 mol × 32 g·mol-1×1 000 mg·g-1÷0.1 L=4.80 mg·L-1